修回日期: 2008-12-15
接受日期: 2008-12-22
在线出版日期: 2009-01-18
目的: 分析Plk1基因在肝细胞癌(hepatocellular carcinoma, HCC)中的表达, 及其与预后的关系.
方法: 用半定量RT-PCR及Western blot方法检测我院2003-01/2008-05原发性肝癌患者213例的Plk1基因蛋白表达, 同时应用Kaplan-Meier法及多变量Cox比例险模型, 分析Plk1基因的表达及临床病理因素与预后的关系.
结果: Plk1基因在肝癌组织中阳性表达率为83.6%. Plk1阳性组的1、3、5年的生存率明显低于阴性组(P = 0.004). 原发性肝癌的预后与Plk1阳性表达, Edmondson分级, 肉眼癌栓, 显微癌栓及肿瘤数目相关; 与HBsAg、肝硬化、AFP、假包膜、肿瘤大小无关; 多因素Cox回归分析显示Edmondson分级、Plk1基因蛋白表达、肉眼癌栓及肿瘤数目4项指标反映肝癌预后情况, 危险度分别为1.717、1.938、1.537及2.355.
结论: Plk1基因的检测有助于有高危肝癌患者的选择,为Plk1基因靶向治疗肝癌提供了有力依据.
引文著录: 何自力, 钟德玝, 郑核, 苗雄鹰, 胡继雄, 文宇, 陈勇. 原发性肝癌Plk1基因表达及其与预后的相关性. 世界华人消化杂志 2009; 17(2): 146-150
Revised: December 15, 2008
Accepted: December 22, 2008
Published online: January 18, 2009
AIM: To investigate expression of polo-like kinase1 (Plk1) in hepatocellular carcinoma (HCC) tissue and to explore relationship between Plk1 expression and prognosis of HCC.
METHODS: Protein expressions of Plk1 were detected using semi-quantitative RT-PCR and Western blot in 213 HCC cases at our hospital from Jan 2003 to May 2008. And clinicopathologic factors and prognosis were analyzed by the application of Kaplan-Meier method and multivariate Cox proportional hazards model.
RESULTS: The positive expression rate of Plk1 in HCC was 83.6%. 1, 3, 5-year survival rates were significantly lower in positive expression group than in negative group (P = 0.004). The prognosis of HCC was correlated with the positive expression of Plk1, Edmondson grade, macroscopic venous invasion, microscopic venous invasion and tumor number in HCC, but not with HbsAg, cirrhosis, AFP, tumor encapsulation or tumor size. In multivariate Cox regression analysis, Edmondson grade, the expression of Plk1, macroscopic venous invasion and tumor number were four important prognostic factors for HCC. The risk ratio of Edmondson grade, positive expression of Plk1, macroscopic tumor thrombosis and tumor number were 1.717, 1.938, 1.537, 2.355, respectively.
CONCLUSION: The expression of Plk1 would be helpful in selecting the high risk cases and providing reliable evidence for Plk1 gene targeted therapy.
- Citation: He ZL, Zhong DW, Zheng H, Miao XY, Hu JX, Wen Y, Chen Y. Expression of gene Plk1 and its relationship with prognosis of hepatocellular carcinoma: an analysis of 213 cases. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 146-150
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.146
Plk1基因是有丝分裂的一种重要激酶, 对中心体的成熟[1]、纺锤体的形成[2]、胞质的分离[3]等细胞增殖方面起着重要的作用. Plk1在增殖活跃的细胞中呈高水平表达, 如胎盘、卵巢、睾丸组织, 而在多数成体组织(如肝、肾、心脏等)不表达或表达水平很低[4]. 近年来, Plk1与肿瘤的关系也受到人们的关注, 在结肠癌[5]、卵巢癌[6]、乳腺癌[7]、黑色素瘤[8]等呈过表达状态. 与Plk1的高度表达和肿瘤患者的低存活率之间具有显著的统计相关性, 提示Plk1在某些肿瘤类型中可以作为负性预后指标[9]. 但Plk1基因在肝癌中的研究甚少, 我们自2003-01-01起, 监测肝癌手术患者213例的Plk1的表达及预后, 现报道如下.
原发性肝癌患者213例的标本为中南大学湘雅二医院2003-01/2008-05手术切除获取. 其中男141例, 女72例, 年龄在19-67(中位年龄43)岁. 所有标本在离体30 min内新鲜取材, 液氮固定, -70℃冰箱保存待用. 手术后均进行了随访, 随访率100%. 随访起始时间为手术治疗开始日起, 观察终止时间为2008-07-31. 引物(Sangon公司)RT-PCR试剂盒(Promega公司), 兔抗人Plk1 mAb(Biolegend公司), ECL试剂盒(GE公司)、蛋白提取试剂盒(Millipore公司)、TRIzol(Invitrogen公司)、Super Script试剂盒(Invitrogen公司).
引物设计, 根据Plkl, β-actin的mRNA序列(GenBank NM-005030, NM-001101), 应用在线引物设计软件Primer3设计相关引物(表1). 按厂家说明书, 取肝癌组织50-100 mg用匀浆器彻底匀浆后, 在冰上加入1 mL TRIzol, 离心后加入0.2 mL氯仿. 用Super Script试剂盒提取RNA. 将逆转录产物cDNA于95℃变性5 min后, 行PCR扩增. 扩增产物行琼脂凝胶电泳, EB染色用凝胶图像分析仪分析结果.
| 目的基因 | 片段长度(bp) | 引物序列 |
| Plkl | 296 | 上游: 5'-GATTCCACGGCTTTTTCGAG-3' |
| 下游: 5'-CCCACACAGGGTCTTCTTCC-3' | ||
| β-actin | 550 | 上游: 5'-CGCGAGAAGATGACCCAGAT-3' |
| 下游: 5'-GCACTGTGTTGGCGTACAGG-3' |
在213例肝癌组织行RT-PCR检测Plk1的mRNA癌组织中的表达, 并随机抽取20例行Western blot检测Plk1蛋白的表达.
统计学处理 用SPSS13.0 for Windows统计软件包进行统计分析, 用Perason Chi-square检验各病理因素与Plk1的关系, 用Kaplan-Meier法描述生存曲线, 用Log-rank法进行统计学意义检验, 用Cox比例危险度模型作多因素预后分析. P<0.05认为有显著性差异.
Plk1 mRNA癌组织中表达为0.582±0.144, 明显高于癌旁组织0.301±0.057(P<0.01). Plk1的阳性率为88.26%(188/213)(图1). Plk1蛋白癌组织中表达值为0.615±0.164, 明显高于癌旁组织0.158±0.048(P<0.01, 图2). 说明肝癌患者Plk1的RT-PCR检测和Western blot检测结果一致.
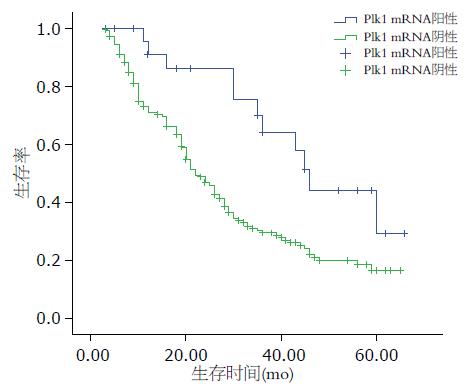
本组213例原发性肝癌患者的1、3、5年总的生存率为73.1%、33.1%及17.6%. Plk1基因蛋白阳性的1、3、5年生存率为90.9%、64.1%及29.3%, Plk1基因蛋白阴性的1、3、5年生存率为70.9%、29.4%及16.4%. 有明显的差异性(P = 0.004, 图3).
通过Perason Chi-square检验Plk1基因蛋白表达与肿瘤数目、肉眼癌栓、显微癌栓相关, 而与Edmondson分期、HBsAg、肝硬化、AFP、假包膜、肿瘤大小等临床病理因素无相关性(表2).
| n | Plk1 RNA | P | |||
| + | - | ||||
| HBsAg | 0.386 | ||||
| + | 152 | 136 | 16 | ||
| - | 61 | 52 | 9 | ||
| AFP(μg/L) | 0.186 | ||||
| ≤400 | 93 | 79 | 14 | ||
| >400 | 120 | 109 | 11 | ||
| 肉眼癌栓 | 0.020 | ||||
| + | 69 | 66 | 3 | ||
| - | 144 | 122 | 22 | ||
| 显微癌栓 | 0.061 | ||||
| + | 88 | 82 | 6 | ||
| - | 125 | 106 | 19 | ||
| Edmondson分级 | 0.064 | ||||
| Ⅰ-Ⅱ | 165 | 142 | 23 | ||
| Ⅲ-Ⅳ | 48 | 46 | 2 | ||
| 肿瘤大小(cm) | 0.120 | ||||
| ≤5.0 | 141 | 121 | 20 | ||
| >5.0 | 72 | 67 | 5 | ||
| 肿瘤假包膜 | 0.113 | ||||
| + | 53 | 50 | 3 | ||
| - | 160 | 138 | 22 | ||
| 肝硬化 | 0.408 | ||||
| + | 167 | 149 | 18 | ||
| - | 46 | 39 | 7 | ||
| 肿瘤数目 | 0.032 | ||||
| 单个肿瘤 | 138 | 116 | 22 | ||
| 多发肿瘤 | 75 | 72 | 3 | ||
Kaplan-Meier法分析原发性肝癌的预后的单因素相关因子显示与Plk1阳性表达、Edmondson分级、肉眼癌栓、显微癌栓及肿瘤数目相关; 与HBsAg、肝硬化、AFP、假包膜、肿瘤大小无关(表3); 多因素Cox回归分析显示Edmondson分级、Plk1基因蛋白表达、肉眼癌栓及肿瘤数目4项指标反映肝癌预后情况, 危险度分别为1.717、1.938、1.537及2.355(表4).
| 阳性定义 | P值 | |
| Plk1 mRNA阳性表达 | 0.582±0.144 | 0.004 |
| Edmondson分级 | Ⅲ-Ⅳ | 0.034 |
| 肉眼癌栓 | 可发现 | 0.007 |
| 显微癌栓 | 可发现 | 0.047 |
| 肿瘤数目(个) | ≥2 | 0.000 |
| HBsAg | 阳性 | 0.483 |
| 肝硬化 | 存在 | 0.887 |
| AFP(μg/L) | >400 | 0.422 |
| 假包膜 | 存在 | 0.428 |
| 肿瘤大小(cm) | >5.0 | 0.687 |
| 偏回归系数 | 偏回归系数标准误 | P值 | 相对危险度 | 相对危险度95%的可信区间 | ||
| 低值 | 高值 | |||||
| Plk1 mRNA阳性表达 | 0.696 | 0.320 | 0.030 | 2.005 | 1.071 | 3.753 |
| Edmondson分级 | 0.467 | 0.220 | 0.034 | 1.596 | 1.036 | 2.458 |
| 肿瘤数目 | 0.846 | 0.174 | 0.000 | 2.330 | 1.656 | 3.280 |
| 肉眼癌栓 | 0.434 | 0.183 | 0.018 | 1.543 | 1.078 | 2.208 |
| 显微癌栓 | 0.112 | 0.188 | 0.553 | 1.118 | 0.773 | 1.616 |
原发性肝癌是我国常见恶性肿瘤之一, 每年我国死于肝癌的患者约有11万, 居恶性肿瘤病死率的第2位[10]. 其起病隐匿, 侵袭性生长快速, 预后差, 近些年来其发病率和死亡率有逐年升高的趋势. 近几年来随着对肝癌基础研究不断深入, 生物治疗在肝癌的综合治疗中取得了较大进展, 成了继手术、放疗、化疗后肿瘤治疗的第四大疗法, 但其临床疗效仍不十分满意, 其相关的关键理论和实验技术仍需进一步研究和发展.
2003-01/2008-05我们检测原发性肝癌213例的Plk1 mRNA的表达及预后的关系. 结果显示在肝癌组织中, Plk1的mRNA表达阳性率均高于癌旁组织, 有明显统计学差异. 同时随机抽样20例行Western blot检测也是表明Plk1的蛋白达阳性率亦高于癌旁组织. Plk1的基础研究表明DNA受损可以导致Plk1下调, 而当Plk1的苏氨酸基团突变为天冬氨酸基团后, 细胞周期不因DNA损伤而停滞[11]. 这就是说, 当Plk1变异时, Plk1的自我保护机制被破坏, 受损的DNA就能被复制并分配到子代细胞, 大大增加了癌变的频率. 这可能是Plk1致癌的机制. 我们推断Plk1在肝癌的高表达可能与Plk1基因的变异有关, Plk1可能肝癌细胞的增殖调控过程中起了重要作用.
Perason Chi-square检验各病理因素与Plk1的关系表明Plk1基因的高表达与肿瘤数目、肉眼癌栓、显微癌栓相关. 众多文献表明: 肿瘤数目、血管的侵犯是肝癌肝内转移和复发的常用观测指标, Plk1的高表达与这些指标相关, 说明Plk1可能在肝癌细胞的肝内转移和复发中起着重要作用. 这些在基础研究中也得到证实. Izawa et al[12]认为Plk1磷酸化IF(intermediate filaments)可能与肿瘤的发展、侵袭与转移相关. Chen et al[13]认为Plk1的高表达与肝癌的复发相关; Ito et al[14]认为Plk1的高表达与甲状腺髓样癌的高侵袭性相关. 由此, 我们认为Plk1可能参与了肝癌细胞的转移和复发.
最后, 我们比较Plk1 mRNA阳性和阴性的1、3、5年的生存率. Plk1 mRNA阳性组明显低于Plk1 mRNA阴性组, 有显著性性差异. 单因素分析还显示Edmondson分级、肿瘤数目、肉眼癌栓、显微癌栓、等临床病理因素均和肝癌的预后相关. 多因素分析示: Edmondson分级、Plk1基因蛋白表达、肉眼癌栓及肿瘤数目4项指标反映肝癌预后情况,危险度分别为1.717、1.938、1.537及2.355. Plk1是肝癌预后的独立风险因素.
目前关于Plk1的研究已经广泛深入各临床和基础的方面, Plk1的小分子抑制剂、Plk1的siRNA抑制作为肿瘤靶点的试验取得不断进步[15-17], 在美国Plk1的抑制剂BI 2536已经进入Ⅰ期临床试验阶段[18]. 这为Plk1基因作为肿瘤的抗癌靶点提供了丰富的理论依据. 通过我们的试验, 我们认为Plk1基因在肝癌的增殖、转移、复发和预后起着重要作用, Plk1的基因靶点干预有望为肝癌治疗提供一个崭新平台.
Plk1基因是有丝分裂的一种重要激酶, 对中心体的成熟、纺锤体的形成、胞质的分离等细胞增殖方面起着重要的作用. Plk1在增殖活跃的细胞中呈高水平表达,如胎盘、卵巢、睾丸组织, 而在多数成体组织(如肝、肾、心脏等)不表达或表达水平很低.
钱林学, 教授, 首都医科大学附属北京友谊医院内科
近年来, Plk1与肿瘤的关系也受到人们的关注, 其在结肠癌、卵巢癌、乳腺癌、黑色素瘤等呈过表达状态.
本文研究肝癌组织中Plk1基因的表达与预后的相关性分析, 其创新在于第一次提出了Plk1基因与肝癌预后的关系, 对肝癌的基因治疗提供了重要的理论指导.
本文的科学性、可读性较好, 能反映肝癌发生中基础研究的当前热点.
编辑: 李军亮 电编:何基才
| 1. | Sumara I, Giménez-Abián JF, Gerlich D, Hirota T, Kraft C, de la Torre C, Ellenberg J, Peters JM. Roles of polo-like kinase 1 in the assembly of functional mitotic spindles. Curr Biol. 2004;14:1712-1722. [PubMed] [DOI] |
| 2. | Sunkel CE, Glover DM. polo, a mitotic mutant of Drosophila displaying abnormal spindle poles. J Cell Sci. 1988;89:25-38. [PubMed] |
| 3. | Taniguchi E, Toyoshima-Morimoto F, Nishida E. Nuclear translocation of plk1 mediated by its bipartite nuclear localization signal. J Biol Chem. 2002;277:48884-48888. [PubMed] [DOI] |
| 4. | Golsteyn RM, Schultz SJ, Bartek J, Ziemiecki A, Ried T, Nigg EA. Cell cycle analysis and chromosomal localization of human Plk1, a putative homologue of the mitotic kinases Drosophila polo and Saccharomyces cerevisiae Cdc5. J Cell Sci. 1994;107:1509-1517. [PubMed] |
| 5. | Weichert W, Kristiansen G, Schmidt M, Gekeler V, Noske A, Niesporek S, Dietel M, Denkert C. Polo-like kinase 1 expression is a prognostic factor in human colon cancer. World J Gastroenterol. 2005;11:5644-5650. [PubMed] |
| 6. | Weichert W, Denkert C, Schmidt M, Gekeler V, Wolf G, Köbel M, Dietel M, Hauptmann S. Polo-like kinase isoform expression is a prognostic factor in ovarian carcinoma. Br J Cancer. 2004;90:815-821. [PubMed] [DOI] |
| 7. | Weichert W, Kristiansen G, Winzer KJ, Schmidt M, Gekeler V, Noske A, Müller BM, Niesporek S, Dietel M, Denkert C. Polo-like kinase isoforms in breast cancer: expression patterns and prognostic implications. Virchows Arch. 2005;446:442-450. [PubMed] [DOI] |
| 8. | Strebhardt K, Kneisel L, Linhart C, Bernd A, Kaufmann R. Prognostic value of pololike kinase expression in melanomas. JAMA. 2000;283:479-480. [PubMed] [DOI] |
| 9. | Spänkuch-Schmitt B, Bereiter-Hahn J, Kaufmann M, Strebhardt K. Effect of RNA silencing of polo-like kinase-1 (PLK1) on apoptosis and spindle formation in human cancer cells. J Natl Cancer Inst. 2002;94:1863-1877. [PubMed] |
| 10. | Sherman M. Hepatocellular carcinoma: epidemiology, risk factors, and screening. Semin Liver Dis. 2005;25:143-154. [PubMed] [DOI] |
| 11. | Smits VA, Klompmaker R, Arnaud L, Rijksen G, Nigg EA, Medema RH. Polo-like kinase-1 is a target of the DNA damage checkpoint. Nat Cell Biol. 2000;2:672-676. [PubMed] [DOI] |
| 12. | Izawa I, Inagaki M. Regulatory mechanisms and functions of intermediate filaments: a study using site- and phosphorylation state-specific antibodies. Cancer Sci. 2006;97:167-174. [PubMed] [DOI] |
| 13. | Chen XJ, Wu LM, Xu XB, Feng XW, Xie HY, Zhang M, Shen Y, Wang WL, Liang TB, Zheng SS. [Expression and prognostic value of Polo-like kinase 1, E-cadherin in the patients with hepatocellular carcinoma]. Zhonghua Waike Zazhi. 2007;45:1354-1358. [PubMed] |
| 14. | Ito Y, Nakamura Y, Yoshida H, Tomoda C, Uruno T, Takamura Y, Miya A, Kobayashi K, Matsuzuka F, Kuma K. Polo-like kinase 1 expression in medullary carcinoma of the thyroid: its relationship with clinicopathological features. Pathobiology. 2005;72:186-190. [PubMed] [DOI] |
| 15. | Lénárt P, Petronczki M, Steegmaier M, Di Fiore B, Lipp JJ, Hoffmann M, Rettig WJ, Kraut N, Peters JM. The small- molecule inhibitor BI 2536 reveals novel insights into mitotic roles of polo-like kinase 1. Curr Biol. 2007;17:304-315. [PubMed] [DOI] |
| 16. | Steegmaier M, Hoffmann M, Baum A, Lénárt P, Petronczki M, Krssák M, Gürtler U, Garin-Chesa P, Lieb S, Quant J. BI 2536, a potent and selective inhibitor of polo-like kinase 1, inhibits tumor growth in vivo. Curr Biol. 2007;17:316-322. [PubMed] [DOI] |
| 17. | Chi YH, Haller K, Ward MD, Semmes OJ, Li Y, Jeang KT. Requirements for Protein Phosphorylation and the Kinase Activity of Polo-like Kinase 1 (Plk1) for the Kinetochore Function of Mitotic Arrest Deficiency Protein 1 (Mad1). J Biol Chem. 2008;283:35834-35844. [PubMed] [DOI] |
| 18. | Mross K, Frost A, Steinbild S, Hedbom S, Rentschler J, Kaiser R, Rouyrre N, Trommeshauser D, Hoesl CE, Munzert G. Phase I dose escalation and pharmacokinetic study of BI 2536, a novel Polo-like kinase 1 inhibitor, in patients with advanced solid tumors. J Clin Oncol. 2008;26:5511-5517. [PubMed] [DOI] |