修回日期: 2008-12-13
接受日期: 2008-12-15
在线出版日期: 2009-01-18
目的: 探讨罗布麻叶提取物对两肾一夹加高糖高脂饮食大鼠脂肪性肝病的影响.
方法: 采用两肾一夹术和喂高糖高脂饲料12 wk复制代谢综合征大鼠脂肪性肝病模型, 第5周测定大鼠收缩压, 取收缩压达160 mmHg以上的大鼠42只, 随机分为罗布麻叶提取物高、中、低剂量组[200、100、50 mg/(kg·d), n = 8]、卡托普利组[30 mg/(kg·d), n = 8]和模型组[0.5%羧甲基纤维素5 mg/(kg·d), n = 10], 另设假手术组[0.5%羧甲基纤维素5 mg/(kg·d), n = 10], 按上述设定剂量每天9:00-10:00灌胃一次连续8 wk. 第13周, 称体质量和肝湿质量, 测收缩压、血清胰岛素和FFA水平、肝功能、肝组织氧化和抗氧化指标, HE染色观察肝组织形态学改变.
结果: 模型组大鼠血清胰岛素、FFA、GOT和GPT水平明显升高, 肝组织中T-SOD和GSH-Px活力和ISI明显下降, 脂质过氧化物MDA含量显著增加, HE染色示肝小叶中大部分肝细胞肿胀, 胞质中出现大小不等的脂滴空泡, 以大泡性脂肪滴为主, 核居边, 细胞界限不清, 肝窦狭窄, 且存在小叶内及门管区炎症细胞浸润. 与模型组比较, 罗布麻叶提取物高中剂量能明显降低代谢综合征大鼠血清胰岛素、FFA、GOT和GPT水平(41.31±14.46, 48.03±10.19 vs 62.56±19.48; 468.52±205.36, 584.14±185.89 vs830.51±355.17; 192.63±67.41, 325.18±96.47 vs 466.16±95.63; 49.06±21.52, 108.32±38.63 vs 178.37±66.55,P<0.05或0.01), 提高肝组织中T-SOD和GSH-Px活力以及ISI, 减少脂质过氧化物MDA含量(83.80±7.10, 70.86±11.68 vs47.33±12.53; 681.85±173.99, 481.27±70.05 vs 250.50±102.97; -5.19±0.44, -5.45±0.31 vs -5.79±0.42; 17.36±3.45, 25.69±5.46 vs 37.69±4.13, P<0.05或0.01), 改善肝细胞的脂质沉积和小叶内及汇管区炎症细胞浸润.
结论: 罗布麻叶提取物具有抗氧化应激和改善代谢综合征大鼠脂肪性肝病的作用.
引文著录: 杨新波, 吴向起, 杨解人, 黄正明, 陈红艳, 曹文斌, 耿淼, 王建华, 温航远. 罗布麻叶提取物对两肾一夹高糖高脂饮食大鼠脂肪性肝病的保护作用. 世界华人消化杂志 2009; 17(2): 135-140
Revised: December 13, 2008
Accepted: December 15, 2008
Published online: January 18, 2009
AIM: To explore effect of extracts of Apocynum venetum L extract (AVLE) on fatty liver disease of rats with metabolic syndrome.
METHODS: Fatty liver disease of rats with metabolic syndrome were copied by two-Kidney, one-Clip method (2K1C) and high-fat and refined-carbohydrate diet for twelve weeks. Systolic blood pressure (SBP) was determined at 5th week. Forty-two rats with SBP exceeding 160 mmHg were randomly assigned to five groups: AVLE with high-, middle- and low-dose groups [200, 100, 50 mg/(kg·d), n = 8], captopril group [30 mg/(kg·d), n = 8) and model group (0.5% carboxymethylcellulose [5 mg/(kg·d), n = 10], another laying sham-operation group [0.5% carboxymethylcellulose 5 mg/(kg·d), n = 10]. Rats were intragastrically administrated between 9:00-10:00 everyday for eight weeks according to above-mentioned setting dosage. At 13th week, body weight and liver humid weight were weighed, SBP and functional, oxidative and antioxidative indexes for liver tissue were determined. Pathological changes of liver tissue was observed using hematoxylin-eosin staining method.
RESULTS: Levels of insulin, FFA, GOT and GPT in serum were significantly increased in model group; activities of T-SOD and GSH-Px in liver tissue and ISI were notably decreased, and content of lipid perhydride MDA was increased. HE staining revealed that there was hepatic cellular swelling in hepatic lobules, inequality of size of lipid droplets (most of fat drops were bullous) in periplast, nucleus on one side, narrowed sinus hepaticus and inflammatory cell infiltration in hepatic lobules and portal area. Decrease levels of insulin, FFA, GOT and GPT for serum (41.31 ± 14.46, 48.03 ± 10.19 vs 62.56 ± 19.48; 468.52 ± 205.36, 584.14 ± 185.89 vs 830.51 ± 355.17; 192.63 ± 67.41, 325.18 ± 96.47 vs 466.16 ± 95.63; 49.06 ± 21.52, 108.32 ± 38.63 vs 178.37 ± 66.55, P < 0.05 or 0.01) and content of lipid perhydride MDA (17.36 ± 3.45, 25.69 ± 5.46 vs 37.69 ± 4.13) for liver tissue were obviously observed in high- and middle-dosage AVLE groups; activities of T-SOD and GSH-Px in liver tissue and ISI were notably increased (83.80 ± 7.10, 70.86 ± 11.68 vs 47.33 ± 12.53; 681.85 ± 173.99, 481.27 ± 70.05 vs 250.50 ± 102.97; -5.19 ± 0.44, -5.45 ± 0.31 vs -5.79 ± 0.42, P < 0.05 or 0.01); lipidoses in liver cells and inflammatory cell infiltration in hepatic lobules and portal area were ameliorated.
CONCLUSION: AVLE plays a great role in antioxidative stress and has protective effect upon fatty liver disease of rats with metabolic syndrome.
- Citation: Yang XB, Wu XQ, Yang JR, Huang ZM, Chen HY, Cao WB, Gen M, Wang JH, Wen HY. Hepatoprotective effect of Apocynum venetum L extract on fatty liver disease of 2K1C rats with high-fat and refined-carbohydrate diet. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 135-140
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/135.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.135
代谢综合征(metabolic syndrome, MS)为导致心血管疾病和2型糖尿病危险因素的症候群, 其包括中心性肥胖、高血脂、高血压、糖尿病或空腹血糖的升高[1]. 随着社会经济的发展和人们饮食结构的改变, 全球有1/4的成年人患有MS, 并且由于肥胖在儿童和青少年的流行处增长趋势, 其发病率更高[2-4]. MS其主要组分不但与糖尿病心血管病变和事件密切相关, 而且在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发生和发展中起着重要作用[5-6]. 一些学者则认为NAFLD可成为MS的另一特征[7]. Day et al提出肝细胞脂肪变性和氧化应激为NAFLD进一步发展的2个必要条件[8].
前瞻性研究发现, 抗氧化剂对NAFLD患者具有保护作用[9]. 研究表明罗布麻叶提取物(extracts of Apocynum venetum L leaves, AVLE)具有降压, 降脂, 抗氧化和保肝护肾等作用[10-12], 但罗布麻叶提取物是否能通过抗氧化作用, 改善MS大鼠脂肪性肝病尚未见报道. 本实验采用两肾一夹术和高糖高脂饮食诱导建立MS大鼠脂肪性肝病模型, 从抗氧化角度探索AVLE在MS脂肪性肝病发生和发展中的作用, 为MS脂肪性肝病的防治提供新的策略.
清洁级♂Sprague-Dawley大鼠52只, 体质量200-240 g(北京维通利华实验动物技术有限公司, 许可证号: SCXK(京)2007-0001). 于中国人民解放军总医院实验动物中心清洁级啮齿类动物实验室分笼饲养, 保持室温24-26℃, 相对湿度60%-65%, 自由进食和饮水. 罗布麻叶提取物(纯度>85%), 由解放军第302医院药学部提取; 卡托普利(captopril, cap), 批号: 071016, 北京曙光药业有限责任公司. 总超氧化物歧化酶(total-erythrocuprein, T-SOD)、谷胱甘肽过氧化酶(glutathione peroxidase, GSH-PX)、丙二醛(malonaldehyde, MDA)和游离脂肪酸(free fatty acid, FFA)测试盒均购于南京建成生物工程研究所. 胰岛素(insulin)放射免疫分析药盒, 批号: 20080829, 北京普尔伟业生物科技有限公司.
1.2.1 模型建立、分组及给药方法: 采用改良内径0.25 mm银夹使左肾动脉缩窄方法[13]复制大鼠肾血管性高血压模型, 30 g/L戊巴比妥钠注射液ip麻醉, 腹部做切口, 分离左肾周围脂肪组织, 小心分离左肾动静脉, 用银夹环绕左肾动脉, 夹紧, 造成左肾动脉狭窄, 关闭切口; 对照组大鼠, 不上银夹, 其他步骤同上. 术后给予青霉素100 万单位/kg ip 3 d, 无大鼠死亡. 1 wk后除假手术组(sham operated group, sham), 其余大鼠喂清洁级高糖高脂饲料[25%蔗糖, 15%猪油, 5%蛋黄, 2%胆固醇, 53%普通饲料; 由中国人民解放军军事医学科学院实验动物中心制作, 许可证号: SCXK(军)2002-018]持续12 wk. 尾袖法(ALC-nibp无创尾动脉血压测定分析系统, 上海奥尔科特生物科技有限公司)测定大鼠术后5 wk收缩压(systolic blood pressure, SBP), 血压达160 mmHg以上视为造模成功大鼠, 其中75%的大鼠符合以上标准.
取造模成功大鼠42只, 按预试结果设置如下组别和剂量: AVLE高剂量组[200 mg/(kg·d), n = 8]、AVLE中剂量组[100 mg/(kg·d), n = 8]、AVLE低剂量组[50 mg/(kg·d), n = 8]、cap阳性对照组[30 mg/(kg·d), n = 8]、和MS组[0.5%羧甲基纤维素5 mg/(kg·d), n = 10]. 另设sham组[0.5%羧甲基纤维素5 mg/(kg·d), n = 10]. 药物用0.5%羧甲基纤维素充分溶解, 于每日上午九时灌胃给药, 连续给药8 wk.
1.2.2 标本采集与测定: 13 wk末测定大鼠SBP、尾静脉血空腹血糖水平(fasting blood glucose, FBG)、称大鼠体质量(body weight, BW)、30 g/L戊巴比妥钠(30 mg/kg)腹腔麻醉、腹主动脉采血, 取肝脏于4℃ 0.9% NaCl冲洗, 滤纸拭干, 称其湿质量(liver humid weight, LHW), 并取部分肝脏研磨后制备10%组织匀浆, 分别以3000 r/min离心10 min. 酶联仪[Sunrise Remote/Touch Screen, F039300, 天美(天津)国际贸易有限公司]测定肝匀浆T-SOD、GSH-PX和MDA含量; 722光栅分光光度计(山东高密分析仪器厂)测定血清FFA水平; BS-120全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)测定血清谷草转氨酶(glutamic oxalacetic transaminase, GOT)和谷丙转氨酶(glutamate-pyruvate transaminase, GPT)活力; GC-911γ放射免疫计数器(中国科学技术大学科技实业总公司)测定空腹血清胰岛素水平(fasting insulin, FIns), 并用李氏法[15]计算胰岛素敏感指数(ISI): ISI = Ln(1/FBG×FIns).
1.2.3 肝脏HE染色: 40 g/L甲醛固定肝组织, 常规包埋、切片、HE染色, 光镜下观察肾脏形态学改变.
统计学处理 采用DAS 2.0软件, 数值以mean±SD表示, 组间均数比较采用单因素方差分析, 均数间的两两比较用t检验, 方差不齐用t'检验, 显著性水平P = 0.05.
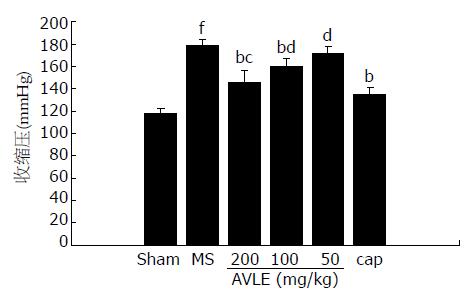
与正常对照组相比, 模型组SBP明显增高(P<0.01); 与模型组相比, 罗布麻叶提取物高中剂量和卡托普利组SBP明显降低; 说明罗布麻叶提取物和卡托普利具有降低代谢综合征大鼠血压的作用(P<0.05或P<0.01, 图1).
与正常对照组相比, 模型组血清胰岛素和游离脂肪酸水平明显增高以及胰岛素敏感指数明显下降(P<0.01); 与模型组相比, 罗布麻叶提取物高剂量和卡托普利组血清胰岛素和游离脂肪酸水平明显降低, 胰岛素敏感指数显著上升; 说明罗布麻叶提取物和卡托普利具有改善代谢综合征大鼠胰岛素敏感性和降低其血清游离脂肪酸水平的作用(P<0.05或P<0.01, 表1).
与正常对照组相比, 模型组LHW、LHW/BW以及血清中GOT和GPT活力明显增高(P<0.01); 与模型组相比, 罗布麻叶提取物高中剂量和卡托普利组LHW、LHW/BW以及血清中GOT和GPT活力明显降低; 说明罗布麻叶提取物和卡托普利具有改善代谢综合征大鼠肝功能的作用(P<0.05或P<0.01, 表2).
| 分组 | 剂量(mg/kg) | n | LHW(g) | LHW/BW(mg/g) | GOT(IU/L) | GPT(IU/L) |
| 假手术组 | 10 | 14.67±1.29 | 2.80±0.08 | 85.73±41.25 | 23.86±11.55 | |
| 模型组 | 10 | 24.61±2.44f | 3.90±0.23f | 466.16±95.63f | 178.37±66.55f | |
| 高剂量组 | 200 | 8 | 17.44±2.53b | 3.11±0.30b | 192.63±67.41b | 49.06±21.52b |
| 中剂量组 | 100 | 8 | 20.17±1.96bd | 3.47±0.18bd | 325.18±96.47bd | 108.32±38.63ad |
| 低剂量组 | 50 | 8 | 22.56±3.00d | 3.72±0.36d | 434.06±92.41d | 154.28±43.79d |
| 卡托普利组 | 30 | 8 | 15.27±3.11b | 2.96±0.22b | 121.62±72.28b | 37.31±15.92b |
与正常对照组相比, 模型组肝组织中T-SOD和GSH-PX活力明显降低, MDA含量明显增高(P<0.01); 与模型组相比, 罗布麻叶提取物高中剂量和卡托普利组肝组织中T-SOD和GSH-PX活力明显升高, MDA含量明显减少; 说明罗布麻叶提取物和卡托普利具有抗氧化作用(P<0.01, 表3).
| 分组 | 剂量(mg/kg) | n | T-SOD(NU/L) | GSH-Px(U) | MDA(mol/L) |
| 假手术组 | 10 | 101.87±6.19 | 856.88±155.80 | 9.35±3.14 | |
| 模型组 | 10 | 47.33±12.53f | 250.50±102.97f | 37.69±4.13f | |
| 高剂量组 | 200 | 8 | 83.80±7.10a | 681.85±173.99a | 17.36±3.45a |
| 中剂量组 | 100 | 8 | 70.86±11.68ad | 481.27±70.05ad | 25.69±5.46ad |
| 低剂量组 | 50 | 8 | 53.38±8.06d | 360.78±134.85d | 32.60±6.77d |
| 卡托普利组 | 30 | 8 | 94.06±7.35a | 798.36±108.49a | 14.11±4.11a |
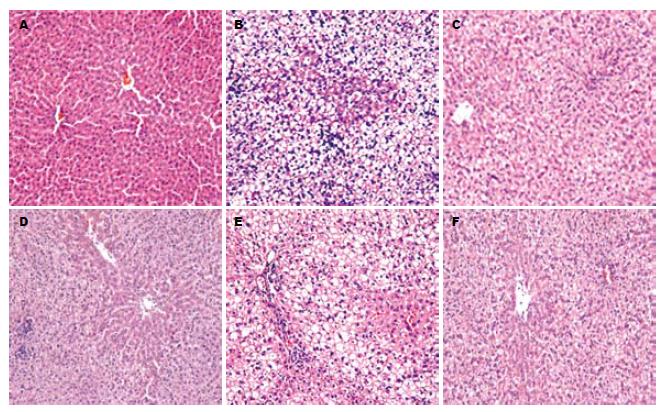
与正常对照组相比, 模型组肝小叶中大部分肝细胞肿胀, 胞质中出现大小不等的脂滴空泡, 以大泡性脂肪滴为主, 核居边, 细胞界限不清, 肝窦狭窄, 且存在小叶内及汇管区炎症细胞浸润. 与模型组相比, 罗布麻叶提取物组和卡托普利组上述病理变化均有不同程度的改善, 尤其罗布麻叶提取物高中组和卡托普利组改善较为明显(图2).
NAFLD表现为单纯脂肪变性到脂肪性肝炎以致最终的肝硬化的一组广泛的肝病谱[15], 目前对其机制了解甚少, 但"二次打击"学说较广泛接受, MS以中心性肥胖和胰岛素抵抗(insulin resistance, IR)为主要特征, 由于IR, 使其通过抑制激素敏感脂肪酶的活性发挥抗脂解的作用受损, 从而引起血中出现高浓度的FFA, 导致其在肝脏沉积从而使甘油三脂合成增加, 引起肝脂肪变性, 在这次"打击"基础上, 由于过多的游离脂肪酸经过β氧化除产生能量外还产生了氧自由基, 线粒体为氧化应激的重要场所, 一旦线粒体活化氧产物的反应启动, 就会引起更多的脂质过氧化, 线粒体破坏, β氧化受抑制, 而且形成一个连续的破坏链, 其主要包括: 线粒体损伤、致炎症细胞因子的释放、Kupffer细胞的破坏, 以及肝脏抗氧化酶的持续消耗, 而造成第二次"打击", 从而增加了肝脏细胞凋亡和坏死的易感性, 进一步促进肝纤维化和肝硬化的发生和发展, 而IR贯穿于这"二次打击"的始终. 肝细胞受到持续"打击", 可以表现为肝酶升高、间质纤维化和肝硬化等一系列肝病症状[8,16-22].
文献报道, 高脂饮食28 d可诱导SD大鼠产生IR和血清游离脂肪酸明显增多[23]. 另外在两肾一夹高血压大鼠模型中, 肾素-血管紧张素系统(renin-angiotensin system, RAS)对高血压的发展和维持起着关键作用[24], 而RAS在IR的发病机制中扮演着十分重要角色[25]. 本实验前期研究发现大鼠单纯高糖高脂饮食24 wk血压有所升高, 而处于MS血压发展的早期阶段[26], 故本实验采用两肾一夹术和高糖高脂饮食12 wk复制MS大鼠脂肪性肝病模型, 模拟MS血压发展的后期阶段, 观察在此阶段NAFLD发展情况, 结果发现模型组大鼠血清GOT和GPT水平明显升高, HE染色示肝小叶中大部分肝细胞肿胀, 胞质中出现大小不等的脂滴空泡, 以大泡性脂肪滴为主, 核居边, 细胞界限不清, 肝窦狭窄, 且存在小叶内及汇管区炎症细胞浸润, 表明此模型的建立符合人类MS脂肪性肝病的发病规律; 另发现模型组大鼠血清中胰岛素和FFA含量明显增高以及胰岛素敏感指数降低, 表明代谢综合征大鼠存在胰岛素抵抗和由此引起的血清FFA的升高; 并且肝组织中T-SOD和GSH-Px活力明显下降, 脂质过氧化物MDA显著升高, 说明肝组织也存在明显的氧化应激反应; 以上结果均提示血中高浓度的FFA和肝中继发的氧化应激状态可能在代谢综合征大鼠导致的脂肪性肝病的发生和发展中起着重要作用.
罗布麻叶提取物在本室前期研究中发现其可通过抗氧化作用对大鼠局灶性脑缺血再灌注损伤具有保护作用[27], 另外Xiong et al[12]采用CCl4、D-半乳糖胺和脂多糖所致的小鼠肝损伤模型发现口服罗布麻叶水提取物对肝有保护作用, 并认为黄酮醇苷是罗布麻叶起肝保护作用的主要有效成分. 另外文献报道卡托普利具有抗氧化作用[28-29], 又鉴于其对代谢综合征大鼠的治疗效果显著[30], 因此本次实验采用卡托普利为阳性药. 在此模型中, 当给予罗布麻叶提取物和卡托普利治疗后, 随着给药剂量的增加, 肝功能改善, 肝组织的T-SOD和GSH-Px活性以及胰岛素敏感指数得到恢复, 血清中胰岛素和FFA含量以及肝组织中MDA含量逐渐下降, 肝脂肪变性以及小叶内和汇管区炎症细胞浸润等均有不同程度改善, 提示罗布麻叶提取物和卡托普利参与保护肝脏的机制与其抗氧化应激和改善胰岛素敏感性作用有密切相关, 正由于罗布麻叶提取物的抗氧化作用, 使得导致NAFLD的第二次打击得以减弱, 以致线粒体损伤减弱、致炎症细胞因子的释放减少和Kupffer细胞的破坏减轻, 从而使肝脏炎症细胞浸润得以改善; 另外, 由于其改善胰岛素敏感性, 使得血清中FFA明显下降, 继而引起脂质在肝细胞的沉积减少和肝脏湿质量减轻, 从而减轻第一次打击继使"二次打击"减弱而发挥保肝作用, 但罗布麻叶提取物对胰岛素抵抗的增敏作用有待于进一步研究. 高血压可通过影响血流动力学促使代谢综合征脂肪性肝病的发展, 本次实验中可发现罗布麻叶提取物高中剂量和卡托普利能明显的降低血压, 相应的代谢综合征大鼠脂肪性肝病也得到明显的改善, 提示罗布麻叶提取物参与保肝的机制也可能与其降压作用密切有关.
总之, 罗布麻叶提取物对代谢综合征大鼠脂肪性肝病具有明显的保护作用, 其机制可能与改善胰岛素敏感性、抗氧化应激和降压作用密切相关. 但确切机制有待于进一步研究.
随着社会经济的发展, 人们生活方式的改变(主要包括高糖高脂饮食和运动的减少), 代谢综合征的发病率越来越高, 而由此导致的非酒精性脂肪性肝病(NAFLD)也呈逐年的上升趋势. 然而, 目前对NAFLD尚无有效的疗法, 主要采用多种药物的联合治疗, 这样既提高药物的不良反应又增加了治疗成本; 研究表明中药治疗具有多靶点多层次效应, 且作用温和不良反应少, 因此具有研究和开发前景.
徐列明, 教授, 上海中医药大学附属曙光医院(东部)肝二科
罗布麻在我国资源丰富, 其叶以清热、利尿、平肝和安神而用于高血压、头晕、心悸和失眠症, 并收载于2005年《中华人民共和国药典》之中; 现代药理学研究又进一步发现其叶提取物具有抗氧化、降脂、保肝护肾、抗焦虑和抗抑郁等作用, 而本研究组前期研究也发现其叶提取物对局灶性脑缺血再灌注模型具有保护作用且机制与其抗氧化作用有关.
研究表明罗布麻叶提取物具有降压, 降脂, 抗氧化和保肝护肾等多种药理作用. 而罗布麻叶提取物多途径、多靶位的作用恰恰体现出其治疗代谢综合征脂肪性肝病的独特优势.
用罗布麻叶提取物治疗代谢综合征脂肪性肝病国内外尚未见报道, 因此本次采用两肾一夹加高糖高脂饮食12 wk, 模拟代谢综合征血压发展的后期阶段诱导建立代谢综合征大鼠脂肪性肝病模型, 从抗氧化角度探索罗布麻叶提取物在MS脂肪性肝病发生和发展中的作用, 为MS脂肪性肝病的防治提供新的策略.
本文结果显示罗布麻叶的有效部位对代谢综合征大鼠脂肪性肝病具有保护作用, 其机制可能与改善胰岛素敏感性、抗氧化应激和降压作用密切相关, 这提示我们应用罗布麻叶提取物于NAFLD的预防有较大的开发前景.
本文实验结果比较漂亮, 如重新从降压角度分析归纳罗布麻叶对模型大鼠的作用, 可能更合理.
编辑: 李军亮 电编:何基才
| 1. | Alberti KG, Zimmet P, Shaw J. Metabolic syndrome--a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med. 2006;23:469-480. [PubMed] |
| 2. | Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, Yeckel CW, Allen K, Lopes M, Savoye M, Morrison J. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med. 2004;350:2362-2374. [PubMed] [DOI] |
| 3. | Cook S, Weitzman M, Auinger P, Nguyen M, Dietz WH. Prevalence of a metabolic syndrome phenotype in adolescents: findings from the third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr Adolesc Med. 2003;157:821-827. [PubMed] [DOI] |
| 4. | Cruz ML, Weigensberg MJ, Huang TT, Ball G, Shaibi GQ, Goran MI. The metabolic syndrome in overweight Hispanic youth and the role of insulin sensitivity. J Clin Endocrinol Metab. 2004;89:108-113. [PubMed] [DOI] |
| 5. | Musso G, Gambino R, De Michieli F, Cassader M, Rizzetto M, Durazzo M, Fagà E, Silli B, Pagano G. Dietary habits and their relations to insulin resistance and postprandial lipemia in nonalcoholic steatohepatitis. Hepatology. 2003;37:909-916. [PubMed] [DOI] |
| 6. | Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30:1356-1362. [PubMed] [DOI] |
| 7. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. [PubMed] [DOI] |
| 8. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 9. | Hasegawa T, Yoneda M, Nakamura K, Makino I, Terano A. Plasma transforming growth factor-beta1 level and efficacy of alpha-tocopherol in patients with non-alcoholic steatohepatitis: a pilot study. Aliment Pharmacol Ther. 2001;15:1667-1672. [PubMed] [DOI] |
| 10. | Tagawa C, Kagawa T, Nakazawa Y, Onizuka S, Nishibe S, Kawasaki H. [Studies on antihypertensive effect of Luobuma (Apocynum venetum L.) leaf extract (3)]. Yakugaku Zasshi. 2004;124:851-856. [PubMed] [DOI] |
| 11. | Kim DW, Yokozawa T, Hattori M, Kadota S, Namba T. Inhibitory effects of an aqueous extract of Apocynum venetum leaves and its constituents on Cu(2+)-induced oxidative modification of low density lipoprotein. Phytother Res. 2000;14:501-504. [PubMed] [DOI] |
| 12. | Xiong Q, Fan W, Tezuka Y, Adnyana IK, Stampoulis P, Hattori M, Namba T, Kadota S. Hepatoprotective effect of Apocynum venetum and its active constituents. Planta Med. 2000;66:127-133. [PubMed] [DOI] |
| 13. | Prieto-Carrasquero MC, Botros FT, Pagan J, Kobori H, Seth DM, Casarini DE, Navar LG. Collecting duct renin is upregulated in both kidneys of 2-kidney, 1-clip goldblatt hypertensive rats. Hypertension. 2008;51:1590-1596. [PubMed] [DOI] |
| 15. | Uno M, Kurita S, Misu H, Ando H, Ota T, Matsuzawa-Nagata N, Kita Y, Nabemoto S, Akahori H, Zen Y. Tranilast, an antifibrogenic agent, ameliorates a dietary rat model of nonalcoholic steatohepatitis. Hepatology. 2008;48:109-118. [PubMed] [DOI] |
| 16. | Lalor PF, Faint J, Aarbodem Y, Hubscher SG, Adams DH. The role of cytokines and chemokines in the development of steatohepatitis. Semin Liver Dis. 2007;27:173-193. [PubMed] [DOI] |
| 17. | Tilg H, Diehl AM. Cytokines in alcoholic and nonalcoholic steatohepatitis. N Engl J Med. 2000;343:1467-1476. [PubMed] [DOI] |
| 18. | Xu A, Wang Y, Keshaw H, Xu LY, Lam KS, Cooper GJ. The fat-derived hormone adiponectin alleviates alcoholic and nonalcoholic fatty liver diseases in mice. J Clin Invest. 2003;112:91-100. [PubMed] |
| 19. | Pagano G, Pacini G, Musso G, Gambino R, Mecca F, Depetris N, Cassader M, David E, Cavallo-Perin P, Rizzetto M. Nonalcoholic steatohepatitis, insulin resistance, and metabolic syndrome: further evidence for an etiologic association. Hepatology. 2002;35:367-372. [PubMed] [DOI] |
| 20. | Kojima H, Sakurai S, Uemura M, Fukui H, Morimoto H, Tamagawa Y. Mitochondrial abnormality and oxidative stress in nonalcoholic steatohepatitis. Alcohol Clin Exp Res. 2007;31:S61-S66. [PubMed] [DOI] |
| 22. | 刘 聪, 吴 波, 李 莉, 陈 威, 李 玲, 韩 萍, 郑 长青. 代谢综合征小鼠肝脏过氧化物增殖体受体γ共同作用因子-1的表达. 世界华人消化杂志. 2007;15:1989-1994. [DOI] |
| 23. | Jiao K, Liu H, Chen J, Tian D, Hou J, Kaye AD. Roles of plasma interleukin-6 and tumor necrosis factor-alpha and FFA and TG in the development of insulin resistance induced by high-fat diet. Cytokine. 2008;42:161-169. [PubMed] [DOI] |
| 24. | Kagiyama S, Varela A, Phillips MI, Galli SM. Antisense inhibition of brain renin-angiotensin system decreased blood pressure in chronic 2-kidney, 1 clip hypertensive rats. Hypertension. 2001;37:371-375. [PubMed] |
| 25. | Yamagishi S, Takenaka K, Inoue H. Role of insulin-sensitizing property of telmisartan, a commercially available angiotensin II type 1 receptor blocker in preventing the development of atrial fibrillation. Med Hypotheses. 2006;66:118-120. [PubMed] [DOI] |
| 28. | Lapenna D, De Gioia S, Mezzetti A, Ciofani G, Di Ilio C, Cuccurullo F. The prooxidant properties of captopril. Biochem Pharmacol. 1995;50:27-32. [PubMed] [DOI] |
| 29. | Benzie IF, Tomlinson B. Antioxidant power of angiotensin-converting enzyme inhibitors in vitro. Br J Clin Pharmacol. 1998;45:168-169. [PubMed] [DOI] |
| 30. | Ernsberger P, Johnson JL, Rosenthal T, Mirelman D, Koletsky RJ. Therapeutic actions of allylmercaptocaptopril and captopril in a rat model of metabolic syndrome. Am J Hypertens. 2007;20:866-874. [PubMed] [DOI] |