修回日期: 2008-12-12
接受日期: 2008-12-15
在线出版日期: 2009-01-18
目的: 观察神经肽Y(neuropeptide Y, NPY)在小鼠胚胎胃内的表达, 分布及发育规律, 探讨胃组织形态的变化、功能与NPY的关系.
方法: 采用HE染色法和免疫组化SABC法, 免疫组化图像分析系统对切片进行定量测定, 研究小鼠胚胎13D(embryonic days, E13D)至出生前(E21D)胃NPY的表达情况.
结果: 首先于胚胎14 d的肌间处及黏膜上皮出现NPY免疫反应物阳性表达, 随发育相继出现在黏膜下层, 固有层及黏膜肌层内, 在鼠胎胃发育的E14D-E18D, 免疫物反应阳性由弱到强, E18D到高峰. NPY在胃壁的总数密度E15D时明显增加, E15D组与E14D组间有差异(2.26±4.19 vs 1.05±3.91, P<0.05); 总面密度E18D时明显增加, 与其之前的E14-16D及随后的E19D-21D差异具有显著性(9.00±3.41 vs 1.12±1.10, 1.88±4.75, 3.77±5.09, 3.39±3.11, 3.36±4.11, 3.43±3.16, P<0.01); 黏膜阳性表达密度E18D较其他组显著升高(7.35±5.01 vs 2. 45±2.79, 3.41±3.25, 5.89±7.43, 3.55±3.78, 4.33±6.52, 3.21±6.25, 2.77±6.13, P<0.05或0.01).
结论: E14D-E18D是鼠NPY在胎鼠胃发生发育的一个关键时期; NPY发生发育与胃发育及功能的建立有着密切关系.
引文著录: 徐小冬, 俞利平, 尹洪萍, 陈小囡, 陈辉. 神经肽Y在小鼠胃发育中的表达及变化. 世界华人消化杂志 2009; 17(2): 120-123
Revised: December 12, 2008
Accepted: December 15, 2008
Published online: January 18, 2009
AIM: To observe expression, distribution and development of neuropeptide Y in stomach of mouse embryo and to investigate relationship between the histological changes, functions and neuropeptide Y.
METHODS: HE staining and immunohistochemistry SABC method were used to study the expression of mouse stomach neuropeptide Y from embryonic day 13 (E13D) to day 21 (E21D).
RESULTS: Neuropeptide Y was positively expressed in embryonic muscle and epithelial mucosa with the successive growth in the mucosal plexus, muscular mucosa, submucosa, submucosal plexus in the fetal rat stomach at different development stages. Immune-response was increasingly strong with its peak value in E18D. There was a significant increase in the total number density of NPY in the stomach wall in E15D and significant differences were observed between E15D and E14D (2.26 ± 4.19 vs 1.05 ± 3.91, P < 0.05). The total area density was significantly increased in E18D, and significant difference was noted between E14-16D and E19D-21D (9.00 ± 3.41 vs 1.12 ± 1.10, 1.88 ± 4.75, 3.77 ± 5.09, 3.39 ± 3.11, 3.36 ± 4.11, 3.43 ± 3.16, P < 0.01); positive expression mucosa density was significantly higher in E18D than in the other groups (7.35 ± 5.01vs 2. 45 ± 2.79, 3. 41 ± 3.25, 5.89 ± 7.43, 3.55 ± 3.78, 4.33 ± 6.52, 3.21 ± 6.25, 2.77 ± 6.13, P < 0.05 or 0.01).
CONCLUSION: E14-E18D is a critical period in development of mice stomach. Neuropeptide Y is closely related to development of stomach.
- Citation: Xu XD, Yu LP, Yin HP, Chen XN, Chen H. Expression and changes of neuropeptide Y in the development of mouse stomach. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 120-123
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/120.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.120
神经肽Y(neuropeptide Y, NPY)是胰多肽家族的一个成员, 由Tatemoto et al首先从猪脑中分离出来, 具有36个氨基酸的酰胺肽[1]. 生物化学和免疫组织化学技术研究揭示, 神经肽Y广泛分布在脊椎动物(从鱼类至哺乳类)的神经系统. 具有多种生理作用, 如控制脑垂体激素的释放、控制心率、记忆、食物和水分的摄取、调节摄食与能量平衡以及血浆中胰岛素的水平等. 研究表明, 神经肽在消化活动及其调控中也具有重要的地位. Flatt et al[2]观察到胚胎14 d(embryonic14 days, E14D)至生后35 d, 胃肠SP、NKA和降钙素基因相关肽(calcitonin gene-related peptide, CGRP)的含量与胃和小肠重量的增加相平行. 但有关神经肽Y在小鼠胃的形态发生发育及定量、定性、定位研究的报道尚未见, 本研究系统地观察了神经肽Y的表达在小鼠胎胃出现的时间、部位、形态改变及数量变化等, 探讨其表达变化与胃发生发育的规律和功能的联系, 为进一步阐明神经Y在胃发育中的作用提供新的形态学资料.
用体质量18-22 g的ICR小鼠, 以2:1比例合笼, 次晨8:00检查阴栓, 以查到阴栓日为妊娠0 d. 受孕雌鼠严格记录妊娠日期进行饲养, 共分9组, 每组5只, 分别于妊娠13-21 d, 每天取1组作为出生前发育标本. 孕鼠经拉颈处死, 解剖镜下快速剖腹取出胎鼠胃, 经甲醛液固定, 4℃保存. 分别作HE和免疫组化SABC染色.
1.2.1 SABC染色: 所用抗体及稀释度如下: 第一抗体为兔抗鼠NPY抗血清, 稀释度为1:200, 37℃孵育1 h 后, 置4℃过夜; 第二抗体为即用型生物素化羊抗小鼠IgG血清, 稀释度为1:200, 37℃孵育1 h; 即用型SABC复合物, 37℃孵育1 h. 三者均购自武汉博士德生物工程有限公司. 标本用DAB显色后, 脱水、透明和封片.
1.2.2 对照实验: 用PBS替代第一抗体作阴性对照, 以成年小鼠小肠切片作阳性对照.
1.2.3 结果判断: 免疫染色细胞质着色, 黄色为神经肽Y弱阳性表达, 棕色为阳性, 深棕色为强阳性, 细胞核不着色.
1.2.4 图像分析: 利用Olympus DP70显微成像系统和Image-prodiscovery5.1图像分析系统行定量分析. 免疫组化图像分析对切片进行定量测定(每组5张切片): (1)测量胃整个管壁厚度(含消化管壁四层结构)NPY阳性物的总面密度(阳性物的面积/μm2)和总数密度(阳性物的数量/μm2); (2)分层测量(测量胃肌层、黏膜层的相关指标, 每组5张切片): 黏膜阳性表达密度; 肌层面密度; 肌层阳性细胞的数密度.
统计学处理 对测量结果使用SPSS12.0软件进行数据分析, 行方差分析, 两两比较采用q检验, P<0.05具有统计学意义.
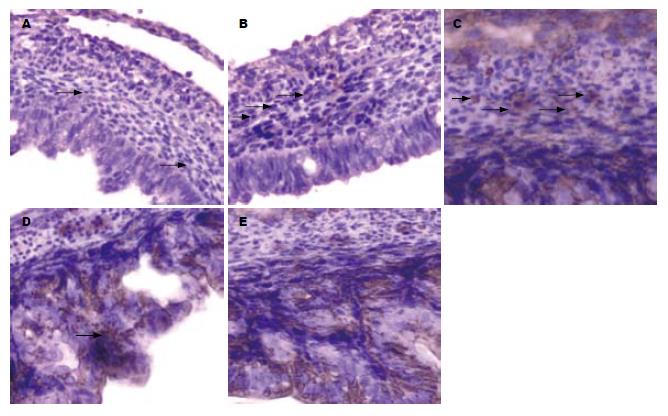
胚胎14 d, 首见神经肽Y位于胃肌间处, 呈单根条索状, 偶可见椭圆形的免疫阳性细胞, 黏膜上皮也可见阳性表达(图1A). 15 d时在肌间处可见阳性细胞数增加, 细胞形状不规则, 有多个突起, 该突起在细胞间以丝状相连(图1B). 在此后的几天内上皮、肌间阳性表达明显增强. 17 d时, 肌间处阳性反应物面积渐增大, 着色较深, 呈团簇状或小颗粒花边状, 出现大量的纤维状物, 还可见多边形的阳性细胞胞体, 黏膜下出现神经肽Y表达阳性, 隐约可见少量阳性细胞(图1C), 黏膜内可见椭圆形的阳性细胞(图1D). 19、20、21 d后少见免疫阳性细胞, 纤维状阳性物也少见. 在胚胎14-18 d, 神经肽Y阳性表达增加较快, 尤以肌间和黏膜上皮明显(图1E).
从表1可见, NPY在胃壁的总数密度, 在E15D时, 随肌层阳性细胞的大量出现而明显增加, E15D组与E14D组间有差异(P<0.05); E18D随阳性细胞和丝状阳性物在肌层的大量出现总面密度明显增加, 与其之前各组E14-16D及随后的E19D-21D差异具有显著性(P<0.01). 黏膜阳性表达密度亦随发育增加, E18D时增至最高, 与各组间差异具有显著性(P<0.01), E18D与E17D比较有差异(P<0.05), NPY阳性表达在E18D出现峰值.
| 胎龄 | 总面密度 | 总数密度 | 肌层面密度 | 肌层阳性细胞数密度 | 黏膜阳性表达密度 |
| E13 | - | - | - | - | - |
| E14 | 1.12±1.10 | 1.05±3.91 | 1.40±1.50 | 2.43±5.82 | 2.45±2.79 |
| E15 | 1.88±4.75 | 2.26±4.19 | 3.07±5.00 | 4.13±4.35 | 3.41±3.25 |
| E16 | 3.77±5.09 | 2.84±5.58 | 2.43±5.82 | 4.43±4.82 | 3.55±3.78 |
| E17 | 8.45±3.22 | 3.14±5.42 | 5.16±3.67a | 7.41±6.62 | 5.89±7.43a |
| E18 | 9.00±3.41b | 3.51±9.38a | 8.27±6.03b | 7.03±4.02b | 7.35±5.01b |
| E19 | 3.39±3.11 | 1.53±2.06 | 1.52±1.76 | 1.20±4.06 | 4.33±6.52 |
| E20 | 3.36±4.11 | 1.55±1.09 | 1.31±3.81 | 1.40±2.16 | 3.21±6.25 |
| E21 | 3.43±3.16 | 1.67±6.75 | 1.43±3.82 | 1.38±2.57 | 2.77±6.13 |
本研究表明, 神经肽Y在胃的最早表达时间为E14D, 与Flatt et al[2]报道的NKA、SP和CGRP等神经肽在胃的检出时间一致. 以往的实验证明, 神经肽在消化系各层中依一定顺序发生, 这一顺序主要取决于神经嵴细胞到位后的局部微环[3-5]. 这一微环境可能决定了神经肽Y发育过程中在胃壁的出现时间, 首先在肌层和黏膜上皮层, 其次随发育相继出现在黏膜下层, 固有层及黏膜肌层内等.
虽然神经肽Y在胃最早见于E14D的肌间处和黏膜上皮层, 以后随小鼠的发育相继出现于黏膜下层, 固有层及黏膜肌层内, 但始终以肌层和黏膜上皮为主, 阳性反应最强, 而其他层的阳性反应较弱. 在E16D-E18D, 特别是E17D, 可见大量的肌间阳性细胞, 而这时上皮免疫反应为深棕色, 呈强阳性, 上皮形成大量绒毛状突起, 肌间免疫阳性细胞E19、20、21D减弱或消失. 这种"一过性"现象也出现于L-ENK、SP、V IP在人胚小肠的发育过程中[6], 与动物和人胚胎期的中枢神经系统中含肽神经元的变化规律非常相似[7-9]. 对此现象有学者认为这是生前发育过程中的"细胞自然死亡"[10-11]. 可见神经肽Y阳性细胞和纤维状物在胃的发生发育主要集中在E14D-E18D, 神经肽Y主要存在神经系统内, 而胎鼠胃壁神经系统的发育也集中在这个时期[12], 说明神经肽Y与胃壁神经的发育有着一定的关联, 但本实验神经肽Y阳性细胞是否神经细胞, 尚需进一步研究证实. 以上提示: E14-E18D是胎鼠胃NPY发生发育的关键时期.
在小鼠消化系的发育过程中, 神经肽Y表达的出现、形态变化、以及定量结果改变与消化系某些结构的发育、功能建立密切相关. 胃的肌层很厚很发达, 也是功能活跃部分, 神经肽Y在胃的表达也始终以肌层和黏膜上皮为主. 已知, 在胃的形态发生过程中要经历由梭形膨大发育为成体囊状结构的过程, 从位置上要经历由垂直方位顺时针旋转90度变成从左上斜向右下方位的变化, 可以推论, 在此, 胃必须加强运动, 才能完成旋转的动作. 而胚胎期神经肽Y在肌间层处丰富的表达, 提示神经肽Y可能与胃的发育和旋转有关. 有资料表明, 神经肽Y可参与调节肠道的蠕动和消化吸收以及摄食的调控[13], 表明神经肽Y与胃肠平滑肌的收缩有关, 这些作用可能是通过激活肌间神经元上的神经肽Y受体或促进平滑肌细胞外钙离子内流所致[14]. 神经肽Y还参与了多种胃肠功能的调节, 如离子转运、血管收缩、消化酶的分泌及神经的兴奋性等, 可能在消化腺分泌细胞、动脉和静脉内皮细胞、平滑肌细胞、肌间神经元均有神经肽Y受体结合位点有关[15]. 结合本实验的结果: 神经肽Y在胃广泛的分布和丰富的表达, 提示神经肽Y对小鼠胃的发育及功能的建立有着密切关系.
近年来有关神经肽Y的研究主要集中在脑、脊髓及血管, 有关其在小鼠胃发育的研究报道尚未见. 本研究系统地观察了神经肽Y在小鼠胎胃出现的时间、部位、形态改变及数量变化等的表达, 探讨其表达变化与胃发生发育的规律和功能的联系.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
关于神经Y生物学功能的相关机制研究热点逐渐深入并涉及到糖尿病、肥胖、高血压等领域, 而后两方面的研究则更为引人注目, 但这些作用机制仍不是很明确.
本文的相关工作为神经Y生物学功能研究提供了实验依据, 在小鼠消化系的发育过程中, 神经肽Y表达的出现、形态变化、以及定量结果改变与消化系某些结构的发育、功能建立密切相关. 该研究为神经Y在胃发育中的作用提供了形态学资料.
本文重点观察神经肽Y在发育13-21 d小鼠胚胎胃内的表达分布规律, 结果对了解胃发育的规律和机制有一定科学意义.
编辑: 史景红 电编:何基才
| 1. | Tatemoto K. Isolation and characterization of peptide YY (PYY), a candidate gut hormone that inhibits pancreatic exocrine secretion. Proc Natl Acad Sci U S A. 1982;79:2514-2518. [PubMed] [DOI] |
| 2. | Flatt PR, Swanston-Flatt SK, Bailey CJ, McGregor GP, Conlon JM. Substance P, neurokinin A and calcitonin gene-related peptide during development of the rat gastrointestinal tract. Regul Pept. 1991;33:313-320. [PubMed] [DOI] |
| 3. | Jaklevic B, Su TT. Cell turnover: flexible coupling meets the needs of development. Curr Biol. 2003;13:R805-R807. [PubMed] [DOI] |
| 4. | Matsumoto A, Hashimoto K, Yoshioka T, Otani H. Occlusion and subsequent re-canalization in early duodenal development of human embryos: integrated organogenesis and histogenesis through a possible epithelial-mesenchymal interaction. Anat Embryol (Berl). 2002;205:53-65. [PubMed] [DOI] |
| 7. | Senba E, Tohyama M, Shiotani Y, Kawasaki Y, Kubo T, Matsunaga T, Emson PC, Steinbusch HW. Peptidergic and aminergic innervation of the facial nucleus of the rat with special reference to ontogenetic development. J Comp Neurol. 1985;238:429-439. [PubMed] [DOI] |
| 8. | Fuji K, Senba E, Fujii S, Nomura I, Wu JY, Ueda Y, Tohyama M. Distribution, ontogeny and projections of cholecystokinin-8, vasoactive intestinal polypeptide and gamma-aminobutyrate-containing neuron systems in the rat spinal cord: an immunohistochemical analysis. Neuroscience. 1985;14:881-894. [PubMed] [DOI] |
| 9. | Marti E, Gibson SJ, Polak JM, Facer P, Springall DR, Van Aswegen G, Aitchison M, Koltzenburg M. Ontogeny of peptide- and amine-containing neurones in motor, sensory, and autonomic regions of rat and human spinal cord, dorsal root ganglia, and rat skin. J Comp Neurol. 1987;266:332-359. [PubMed] [DOI] |
| 10. | Kelly JP, Cowan WM. Studies on the development of the chick optic tectum. 3. Effects of early eye removal. Brain Res. 1972;42:263-288. [PubMed] [DOI] |
| 11. | Oppenheim RW. The absence of significant postnatal motoneuron death in the brachial and lumbar spinal cord of the rat. J Comp Neurol. 1986;246:281-286. [PubMed] [DOI] |
| 14. | Heredia Mdel P, Delgado C, Pereira L, Perrier R, Richard S, Vassort G, Bénitah JP, Gómez AM. Neuropeptide Y rapidly enhances [Ca2+]i transients and Ca2+ sparks in adult rat ventricular myocytes through Y1 receptor and PLC activation. J Mol Cell Cardiol. 2005;38:205-212. [PubMed] [DOI] |
| 15. | Nilsson T, Edvinsson L. Neuropeptide Y stimulates DNA synthesis in human vascular smooth muscle cells through neuropeptide Y Y1 receptors. Can J Physiol Pharmacol. 2000;78:256-259. [PubMed] [DOI] |