修回日期: 2009-05-22
接受日期: 2009-05-25
在线出版日期: 2009-07-08
目的: 探讨阿德福韦酯(ADV)对慢性乙型肝炎(CHB)患者外周血中HBcAg特异性CTL数量的影响.
方法: 选择应用ADV治疗48 wk的HLA-A2阳性CHB患者11例作为研究对象, 应用Tetramer流式细胞技术检测治疗前后PBMC中的HBcAg特异性CTL细胞频率.
结果: HBcAg特异性CTL为0.074%-0.937%. CHB患者体内的特异性CTL频率远低于急性乙型肝炎. 经ADV治疗CHB患者48 wk后, 其BcAg特异性CTL较治疗前无明显变化; 亚组分析也表明无论治疗48 wk后HBV DNA是否转阴、ALT是否恢复正常, 对特异性CTL均无影响.
结论: 应用ADV治疗48 wk, 对CHB患者体内HBcAg特异性CTL细胞频率无明显影响.
引文著录: 闫杰, 谢雯, 蔺亚辉, 冯鑫, 王蓓蓓, 肖江, 欧蔚妮, 王艳斌, 成军. 阿德福韦酯对慢性乙型肝炎患者外周血HBcAg特异性CTL的影响. 世界华人消化杂志 2009; 17(19): 1996-1999
Revised: May 22, 2009
Accepted: May 25, 2009
Published online: July 8, 2009
AIM: To investigate the effect of adeforvir dipivoxil on HBcAg-specific cytotoxic T cells in patients with chronic hepatitis B(CHB).
METHODS: The frequency of circulating HBcAg-specific cytotoxic T cells in 11 HLA-A2+ chronic hepatitis B patients were studied longitudinally before and after adeforvir dipivoxil therapy by HLA-A2/peptide tetramer staining.
RESULTS: The frequency of HBcAg-specific cytotoxic T cells ranged from 0.074% to 0.937%. The frequency of HBcAg-specific cytotoxic T cells in chronic hepatitis B patients was lower than that in acute hepatitis B patients. No significant difference was observed in the frequency of HBcAg-specific cytotoxic T cells between before and after adeforvir dipivoxil therapy. Subgroup analysis indicated that, after therapy with adeforvir dipivoxil for 48 hours, HBV DNA or ALT levels had no effect on the frequency of HBcAg-specific cytotoxic T cells.
CONCLUSION: Adeforvir dipivoxil probably exerts no effect on the frequency of HBcAg-specific cytotoxic T cells in patients with CHB.
- Citation: Yan J, Xie W, Lin YH, Feng X, Wang BB, Xiao J, Ou WN, Wang YB, Cheng J. Effect of adeforvir dipivoxil on the frequency of HBcAg-specific cytotoxic T cells in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1996-1999
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1996.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1996
乙型肝炎病毒(hepatitis B virus, HBV)特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)应答在乙型肝炎发病机制中的作用已受到广泛关注. 在未经治疗的慢性乙型肝炎(chronic hepatitis B, CHB)患者中, 往往存在T细胞的低反应[1-2], 现有研究结果提示, CHB患者体内的高病毒载量和高抗原量的抑制作用可能是其重要原因之一[3]. 阿德福韦酯是一种新型核苷酸类似物, 已广泛应用于CHB治疗中. 为了探讨该药物在降低HBV病毒载量的同时是否伴有HBV特异性CTL活性的恢复, 我们采用了MHC-Ⅰ限制的HLA-A2病毒抗原表位的四聚体技术, 建立了体外直接检测特异性CTL的方法, 并用该方法研究ADV对CHB患者外周血中HBcAg特异性CTL频率的影响.
2005-2006年北京地坛医院肝炎二科门诊应用阿德福韦酯治疗48 wk的HBeAg阳性CHB患者40例, 其中男33例, 平均年龄29.91±9.11, 女7例, 平均年龄26.5±5.83, 诊断符合2000年《病毒性肝炎防治方案》中病毒性肝炎诊断标准[4]. 所有病例符合下列条件: (1)HBV DNA(荧光定量)≥108 copies/L; (2)HBV血清标志物(HBVMs)为: HBsAg阳性, HBeAg阳性, 抗-HBc阳性. 抗-HBs阴性, 抗-HBe阴性; (3)ALT≥80 U/L且ALT≤500 U/L血清总胆红素水平(SB)<40 μmol/L(20 μmol/L为正常值); (4)排除由药物、酒精和其他因素所致的肝功能异常; (5)女性排除妊娠. 除收集临床资料外, 每例患者均保留治疗前后空腹静脉采集全血标本(肝素抗凝)4 mL用于特异性CTL检测[5].
1.2.1 外周血单个核细胞的分离: 将临床采集的全血标本在4 h内用淋巴细胞分离液分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC), 于-80 ℃保存, 待测.
1.2.2 HLA-A2型别鉴定: 应用顺序特异引物聚合酶链反应技术(polymerase chain reaction-sequnce special primer, PCR-SSP)[6]对全部病例进行筛选, 将鉴定获得的HLA-A2阳性患者治疗前后PBMC用于特异性CTL检测.
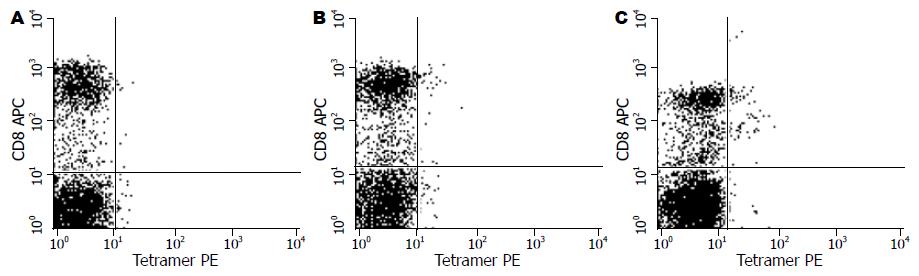
1.2.3 Tetramer流式细胞技术检测HBcAg特异性CTL: HBcAg特异性HLA-肽四聚体(Tetramer)购自美国Sanquin生物技术有限公司, 其特异性肽段为HBVcore18-27短肽(氨基酸序列为FLPSDFFPSV), 以藻红蛋白(PE)标记, 用于流式细胞术检测. 将每份PBMC标本融化复苏后, 用PE标记的Tetramer和APC标记的CD8抗体(BD公司产品)双染色后应用流式细胞仪进行检测, 以淋巴细胞设门, 计数50000个CD8+阳性细胞, 同时计数CD8+和Tetramer双阳性细胞为特异性CD8+细胞, 并以占总计数CD8+细胞的百分比表示.
统计学处理 数据以mean±SD表示, 治疗前后均数比较采用独立样本t检验, 使用SPSS10.0软件进行统计学分析.
本次实验共检测11例CHB患者治疗前后PBMC标本22份, 测得HBcAg特异性CTL为0.074%-0.937%. CHB患者体内的特异性CTL频率远低于急性乙型肝炎, 本实验数据与以往研究数据相符(图1).
40例患者中鉴定获得HLA-A2型11例, 其中男7例, 女4例, 治疗后血清HBV DNA、ALT、AST及白蛋白水平较治疗前出现明显改善(表1), 其中2例出现HBV DNA阴转(<5×105 copies/L), 6例出现ALT复常.
| 治疗前 | 治疗48 wk后 | P值 | |
| ALT(U/L) | 183.00±98.45 | 74.45±73.15 | 0.024 |
| AST(U/L) | 90.46±50.37 | 46.36±43.07 | 0.027 |
| TBIL(μmol/L) | 27.63±33.73 | 16.56±7.26 | 0.331 |
| ALB(g/L) | 44.22±3.87 | 46.96±1.87 | 0.043 |
| lgHBV DNA(lg10) | 7.04±1.26 | 4.59±1.84 | 0.001 |
纳入研究的11例CHB患者经ADV治疗48 wk后的HBcAg特异性CTL较治疗前无明显变化. 随后进行的亚组分析也表明: 无论治疗48 wk后HBV DNA是否转阴、ALT是否恢复正常, 对特异性CTL均无影响(表2).
| n | 治疗前 | 治疗48 wk后 | P值 | |
| 全部患者 | 11 | 0.276±0.206 | 0.238±0.254 | 0.695 |
| HBV DNA转阴者 | 2 | 0.332±0.160 | 0.189±0.013 | 0.402 |
| HBV DNA未转阴者 | 9 | 0.263±0.222 | 0.249±0.282 | 0.900 |
| ALT复常者 | 6 | 0.225±0.142 | 0.279±0.335 | 0.878 |
| ALT未复常者 | 5 | 0.337±0.270 | 0.189±0.122 | 0.725 |
对于HBV感染者而言, 特异性CTL应答是机体清除肝细胞内HBV的主要途径, 但是不充分的特异性CTL应答不仅不能清除病毒, 反而却通过介导非特异性T细胞应答引起肝脏损害. 因此, 检测CHB患者特异性CTL水平对于阐明乙型肝炎慢性化的免疫病理机制以及研发更为有效的治疗药物均有重大意义. 但是由于CHB患者外周血中特异性CTL水平极低, 应用传统免疫学研究技术难以进行准确检测. 1992年Garboczi et al[7]建立了MHC-抗原肽四聚体技术, 并将该技术同流式细胞术相结合, 使得准确检测PBMC中极低细胞频率的特异性CTL成为可能. 我们选用已经证实为MHCⅠ类分子关键结合序列的HBcAg18-27肽段[8]与HLA-A2构建四聚体, 用于CHB患者PBMC中特异性CTL细胞频率的检测. 结果显示, 该方法可检测到细胞频率低至0.074%的HBcAg特异性CTL, 而阴性对照(未受HBV感染的健康人PBMC标本)结果仅为0.003%, 表明四聚体技术联合流式细胞术检测CHB患者特异性CTL的灵敏度和特异度均较高, 适于低水平细胞频率的检测.
既往认为核苷(酸)类似物仅仅通过抑制HBV DNA多聚酶的活性达到抗病毒治疗目的, 对CHB患者的免疫状态不产生直接或间接的影响. 2001年Boni et al[9]报道, 经过拉米夫定(LAM)治疗后, CHB患者外周血中的HBV特异性CD4+细胞和HBV特异性CD8+细胞频率明显升高, 表明LAM能够使CHB患者的HBV特异性CTL功能得到一定程度的恢复. 后续研究显示, LAM仅在最初治疗的1-2 wk可增加CD4+ T淋巴细胞反应, 而在治疗6 mo时, CD4+ T淋巴细胞反应又恢复到治疗前水平; 表明经LAM治疗恢复的HBV特异性CTL反应无法长期维持[10]. Wu et al[11]通过检测3型鼠肝炎病毒(murine hepatitis virus type 3, MHV-3)诱导的小鼠肝炎模型血清细胞因子水平, 以评价替比夫定(telbivudine, LdT)对机体免疫的影响, 结果显示: 在LdT治疗组中TNF-α、IL-12、IL-18和IFN-γ等Th1细胞因子水平明显升高, 而Th2细胞因子(IL-10、IL-4)则明显受到抑制, 提示LdT对于慢性肝炎患者可能具有免疫调节作用, 但尚需进一步研究证实. 为研究ADV对CHB患者外周血中HBV特异性CTL水平的影响, 我们采用四聚体技术检测11例经ADV治疗48 wk的CHB患者治疗前后的PBMC, 结果显示, ADV治疗48 wk后的HBcAg特异性CTL较治疗前无明显变化; 亚组分析也表明无论治疗48 wk后HBV DNA是否转阴、ALT是否恢复正常, 对特异性CTL均无影响. 这一结果同既往研究中LAM对CHB患者特异性CTL的影响基本一致, 说明ADV治疗对CHB患者特异性CTL的恢复也无明显影响.
HBV特异性CTL应答在乙型肝炎发病机制中的作用已受到广泛关注. 在未经治疗的慢性乙型肝炎患者中, 往往存在T细胞的低反应. 新型核苷(酸)类似物是否能够影响机体对HBV的免疫应答, 尚无确切研究结论.
范学工, 教授, 中南大学湘雅医院感染病科
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
1992年Garboczi et al建立了MHC-抗原肽四聚体技术, 并将该技术同流式细胞术相结合, 使得准确检测PBMC中极低细胞频率的特异性CTL成为可能.
本文应用MHC-抗原肽四聚体技术检测CHB患者外周血中的特异性CTL, 克服了传统免疫学技术对极低水平的特异性CTL难以精确定量的方法学难题, 从而保证了结果的准确可信.
本研究选题为热点问题, 对临床医师有较好的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] [DOI] |
| 2. | Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol. 2005;5:215-229. [PubMed] [DOI] |
| 3. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] [DOI] |
| 7. | Garboczi DN, Hung DT, Wiley DC. HLA-A2-peptide complexes: refolding and crystallization of molecules expressed in Escherichia coli and complexed with single antigenic peptides. Proc Natl Acad Sci USA. 1992;89:3429-3433. [PubMed] [DOI] |
| 8. | Penna A, Chisari FV, Bertoletti A, Missale G, Fowler P, Giuberti T, Fiaccadori F, Ferrari C. Cytotoxic T lymphocytes recognize an HLA-A2-restricted epitope within the hepatitis B virus nucleocapsid antigen. J Exp Med. 1991;174:1565-1570. [PubMed] [DOI] |
| 9. | Boni C, Penna A, Ogg GS, Bertoletti A, Pilli M, Cavallo C, Cavalli A, Urbani S, Boehme R, Panebianco R. Lamivudine treatment can overcome cytotoxic T-cell hyporesponsiveness in chronic hepatitis B: new perspectives for immune therapy. Hepatology. 2001;33:963-971. [PubMed] [DOI] |
| 10. | Boni C, Penna A, Bertoletti A, Lamonaca V, Rapti I, Missale G, Pilli M, Urbani S, Cavalli A, Cerioni S. Transient restoration of anti-viral T cell responses induced by lamivudine therapy in chronic hepatitis B. J Hepatol. 2003;39:595-605. [PubMed] [DOI] |
| 11. | Wu Z, Yan W, Guo W, Zou Y, Wang H, Ning Q. Telbivudine preserves Th1 cytokine and inhibits Th2 cytokine production in MHV-3 induced viral hepatitis model. The 59th Annual Meeting of AASLD, Moscone West Convention Center, San Francisco, Oct 31-Nov 4, 2008: Abstract 18. . |