修回日期: 2009-03-24
接受日期: 2009-03-30
在线出版日期: 2009-07-08
目的: 探讨乳源活性肽β-酪啡肽-7(β- Casomorphin-7, β-CM7)应用于食品时对葡萄糖吸收的影响及其作用机制.
方法: 选用健康成年SD大鼠, 分为对照组(0 mol/L β-CM7), L低剂量组、M中剂量组、H高剂量组(终浓度分别为7.5×10-7, 7.5×10-6, 7.5×10-5 mol/L). 利用翻转离体小肠囊模型进行实验: (1)葡萄糖氧化酶法测定翻转后小肠内液葡萄糖含量; (2)比色法测定小肠黏膜Na+-K+-ATP酶活力; (3)荧光定量PCR法分析小肠黏膜组织中钠葡萄糖共转运载体(SGLT-1)和葡萄糖协助扩散转运载体(GLUT-2)mRNA的表达.
结果: 在离体环境下β-CM7在7.5×10-7-7.5×10-5 mol/L浓度下对葡萄糖的吸收均有一定的抑制作用(1.09 mol/L, 1.24 mol/L, 1.12 mol/L vs 1.74 mol/L, P = 0.01, 0.04, 0.02), 能够降低Na+-K+-ATP酶活力(85.73, 112.06, 109.68 vs114.93, P = 0.004, 0.73, 0.54); 荧光定量PCR结果发现: 与对照组相比, β-CM7能够显著降低SGLT-1及GLUT-2 mRNA水平(0.46, 0.58, 0.77 vs 1.11, P = 0.20, 0.05, 0.02; 0.50, 0.66, 0.85 vs 1.14, P = 0.30, 0.14, 0.03).
结论: β-CM7可以通过降低Na+-K+-ATP酶活力及下调SGLT-1、GLUT-2 mRNA水平, 减少大鼠小肠对葡萄糖的吸收.
引文著录: 宋晓丹, 左伟勇, 范英兰, 张源淑. 乳源β-酪啡肽7对大鼠葡萄糖吸收的影响及其作用机制. 世界华人消化杂志 2009; 17(19): 1947-1951
Revised: March 24, 2009
Accepted: March 30, 2009
Published online: July 8, 2009
AIM: To detect the influence of major peptide β-casomorphin-7 (β-CM7) from milk on the absorption of glucose, and its mechanism in the diet and healthy food.
METHODS: In this study healthy adult SD rats were divided into control group (0 mol/L β-CM7), low-dose group (7.5 × 10-7mol/L β-CM7), middle-dose group (7.5 × 10-6 mol/L β-CM7) and high-dose group (7.5 × 10-5 mol/L β-CM7). Reverted sacs of adult rats in vitro were performed which were dipped into culture sample including β-CM7 and glucose and we designed a few tests: (1) the concentration of glucose in reverted sacs was detected using oxidase method of glucose; (2) the activity of Na+-K+-ATPase in small intestinal mucosa was observed with colorimetric method; (3) the mRNA expressions of sodium-glucose transporter (SGLT-1) and facilitative glucose transporter (GLUT-2) in small intestinal mucosa were analyzed using the Real-time PCR.
RESULTS: Compared with control group, β-CM7 of 7.5 × 10-7-7.5 × 10-5 mol/L significantly induced glucose concentration in vitro(1.09, 1.24, 1.12 vs 1.74, P = 0.01, 0.04, 0.02); the activity of Na+-K+-ATPase was reduced (85.73, 112.06, 109.68 vs 114.93, P = 0.004, 0.73, 0.54); the mRNA expressions of SGLT-1 and GLUT-2 were also significantly reduced (0.77, 0.58, 0.46 vs 1.11, P = 0.20, 0.05, 0.02; 0.50, 0.66, 0.85 vs 1.14, P = 0.30, 0.14, 0.03), compared with control group.
CONCLUSION: The present data demonstrated that β-CM7 was able to reduce the absorption of glucose through inhibiting activity of Na+-K+-ATPase and the mRNA expression level of SGLT-1, GLUT-2 in small intestine of rats.
- Citation: Song XD, Zuo WY, Fan YL, Zhang YS. Effect of β-casomorphin-7 from milk on the absorption of glucose in vitro and its mechanism. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1947-1951
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1947
糖是生命活动中的重要能源, 机体所需能量的70%是食物中的糖所提供的. 人体每日所摄入的淀粉类食物(占食物的大部分), 最终分解为葡萄糖, 然后被吸收进入血液循环. 机体吸收葡萄糖的整个过程由2个家族的跨膜转运载体蛋白-钠葡萄糖共转运载体系统(sodium/glucose cotransporters, SGLTs)和葡萄糖协助扩散转运载体系统(facilitative glucose transporters, GLUTs)来完成[1-2]. 其中起主导作用的是SGLT-1, 该蛋白在细胞膜Na+-K+-ATP酶作用下逆浓度梯度并偶联Na+主动转运葡萄糖, 同时消耗能量[3-4]. SGLT-1载体数量的多少, 是葡萄糖吸收的决定因素. GLUT-2是以易化扩散方式顺葡萄糖的浓度梯度从胞外将葡萄糖运到胞内, 其转运过程不消耗能量[5]. 如此, 肠道葡萄糖的跨膜吸收主要涉及SGLT-1、GLUT-2及Na+-K+-ATP酶3个蛋白.
β-酪啡肽-7(β-casomorphin7, β-CM7)是β-酪蛋白经酶降解释放出的一类最具代表性的乳源活性肽, 1979年由Brantlet al[6]首先从牛乳酪蛋白的酶解产物中分离出, 并证明其产物具有阿片肽活性, 能够被纳洛酮所逆转. Froetsehel et al[7]已证实β-CMs能在动物胃肠道被完整地吸收, 产生与内源性阿片肽类似的生理调节功能如刺激胰岛素、生长抑素释放, 调节肠运动, 提高采食量, 促进肠道水分与电解质的吸收, 此外还影响动物的行为、呼吸、睡眠等[8-9]. 根据其刺激胰岛素分泌的作用, 推测其可能有降血糖作用. 宗亚峰[10]的研究证实β-CM7体外能够抑制小肠对葡萄糖的吸收, 但其作用机制还不明确. 为了探讨主要的乳源活性肽β-CM7应用于饮食和健康保健食品中对葡萄糖吸收的影响及其作用机制, 本研究以大鼠为研究对象, 采用体外翻转的离体小肠囊模型, 观察了β-CM7对小肠葡萄糖吸收的影响, 并从影响葡萄糖转运的主要载体SGLT-1、GLUT-2及Na+-K+-ATP酶3个方面探讨其对葡萄糖吸收影响的机制, 为挖掘酪啡肽等食物源活性肽辅助降血糖的作用提供依据.
β-CM7(Tyr-Pro-Phe-Pro-Gly-Pro-Ile)色谱纯(纯度>97%), 美国凤凰药业有限公司产品; 葡萄糖为上海伯奥公司产品; 葡萄糖检测试剂盒、ATP酶试剂盒购自南京建成生物工程研究所; 荧光酶购自南京博飞有限公司; PCR引物由上海英俊公司合成; MMLV反转录酶, RNA抑制剂, 随机引物为南京生兴生物工程研究所. 实验动物由上海实验动物中心提供. 实验鼠用颗粒饲料购于南京协同医药生物工程有限公司.
1.2.1 翻转离体小肠囊的制作: SD大鼠, 雌雄不拘, 质量200 g左右, 自由采食和饮水, 断颈处死后, 取出小肠, 参照陈其才 et al[11]的实验方法制作翻转离体小肠囊模型.
1.2.2 不同浓度β-CM7对离体小肠葡萄糖吸收的影响: 翻转制作的离体小肠囊, 剪去约10 cm左右的十二指肠, 余下的小肠段用4 ℃预冷的无糖Kreb's液冲洗3次. 取4段长约7 cm的小肠段, 放在干净的滤纸上, 吸取表面液体. 用眼科镊将其黏膜面翻转出, 一端固定于底部膨大的插管上, 另一游离端用手术线扎紧, 向肠囊内注入1 mL无糖Kreb's液. 实验分为对照组(含0 mol/L β-CM7, 15 mmol/L葡萄糖的Kreb's液); 实验组分为3个不同剂量组: L低剂量组、M中剂量组、H高剂量组, 终浓度分别为7.5×10-7 mol/L, 7.5×10-6 mol/L和7.5×10-5 mol/L的15 mmol/L葡萄糖的Kreb's液, 将肠囊放入预热的25 ℃无糖的Kreb's液中温浴10 min后, 转入37 ℃上述实验用的Kreb's液中立即通入氧气, 用100 μL微量进样器每隔10 min吸取肠囊内液体, 再补充同体积的无糖Kreb's液, 总时间为60 min. 按照试剂盒说明检测小肠囊内溶液的葡萄糖浓度.
1.2.3 β-CM7对小肠Na+-K+-ATP酶活力的影响: 将上述肠囊取出, 用干净滤纸吸干水分, 用刀片刮取肠囊上黏膜, 一部分按照试剂盒说明检测其Na+-K+-ATP酶活力; 另一部分于-70 ℃冰箱中保存备用. ATP酶可分解ATP生成ADP及无机磷, 测定无机磷的量可判断ATP酶活力的高低. 本研究规定: 每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位, 即μmol Pi/(mg protein·h).
1.2.4 β-CM7对小肠上皮SGLT-1及GLUT-2 mRNA表达的影响: (1)样品总RNA提取和RNA电泳: 采用TRIzol(北京赛百盛基因技术有限公司)一步抽提法提取小肠黏膜的总RNA, 紫外比色法测定总RNA的浓度和纯度(Eppendorf BioPhotometer 260 nm). (2)反转录: 分别准确量取1 g/L各样品的总RNA 2 μL进行反转录. 建立各样品RNA的cDNA(RT product). 反转录反应体积为25 μL, 其中含Oligo dT(18)5 μmol/L引物, 4 mmol/L dNTP, 加DEPC水至10 μL, 70 ℃变性5 min, 冰上冷却. 再加入8 U RNA酶抑制剂, 100 U反转录酶, 5 μL 5×RT Buffer(含250 mmol/L Tris-HC1 pH 8.3, 150 mmol/L MgCl2, 375 mmol/L KCl, 50 mmol/L DTT), 补充DEPC水至25 μL, 37 ℃反应60 min, 95 ℃变性5 min, 反转录产物(RT Products)-20 ℃保存备用. (3)目的基因引物设计: PCR引物采用Primer 5.0软件设计, 由上海英俊技术有限公司合成, 引物序列及参数见表1. (4)SGLT-1和GLUT-2 mRNA的Real-time PCR分析: 以β-actin管家基因作为内标, 对SGLT-1和GLUT-2进行相对定量分析. PCR反应在Mx3000P Real-time PCR仪(Stratagene, USA)上进行, 使用的荧光酶为SYBR Green Real-time PCR Master Mix(ToYoBo, Japan). PCR反应总体系为25 μL. 其中引物2 μL(浓度5 pmol), SYBR Green 12.5 μL; 三蒸水8.5 μL, cDNA 2 μL; 以最小的Ct值和最高的荧光值(△Rn)及熔解曲线不出现非特异性峰为标准, 分别对退火温度、引物浓度进行优化. 最终扩增反应按94 ℃预变性1 min, 94 ℃变性20 s, 62 ℃退火30 s, 72 ℃延伸30 s, 共45圈进行, SGLT-1、GLUT-2基因反应条件相同.
| 基因 | 引物序列 | 产物(bp) | |
| SGLT-1 | 正义引物 | 5'-CATTGCCATGGGTGGCTTC-3' | 134 |
| 反义引物 | 5'-GCTTGCCTCCAAATCGCTTC-3' | ||
| GLUT-2 | 正义引物 | 5'-CCAGCCTGTGTATGCAACCATC-3' | 156 |
| 反义引物 | 5'-ACCAGTCCCAGCGACATGAAG-3' | ||
| β-actin | 正义引物 | 5'-CCCTGTGCTGCTCACCGA-3' | 170 |
| 反义引物 | 5'-ACAGTGTGGGTGACCCCGTC-3' |
统计学处理 采用SPSS13.0统计软件进行统计, 差异显著性检验采用独立样本t检验和单因子方差分析(One way ANOVA, LSD), 所有数值以mean±SD表示.
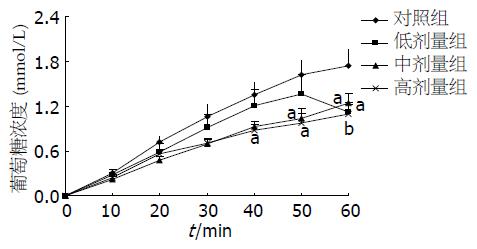
在没有β-CM7存在的情况下, 可以看出小肠囊对葡萄糖的吸收在60 min内一直呈上升趋势, 说明小肠囊对葡萄糖的吸收没有达到饱和. 有β-CM7存在时, 发现小肠囊对葡萄糖的吸收趋于平缓, 即β-CM7对小肠葡萄糖的吸收有一定的抑制作用, 与对照组比较, 不同浓度(7.5×10-7, 7.5×10-6, 7.5×10-5 mol/L)的β-CM7对小肠囊葡萄糖吸收均起到抑制作用(1.09, 1.24, 1.12 vs 1.74, P = 0.01, 0.04, 0.02, 图1).
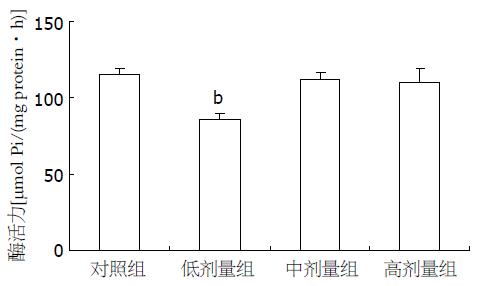
葡萄糖跨膜转运是细胞摄取葡萄糖过程的主要限速步骤之一. 而Na+-K+-ATP酶为钠葡萄糖共转运载体提供能量, 可以反映机体对葡萄糖吸收的能力. 与对照组相比, 不同浓度(7.5×10-7, 7.5×10-6, 7.5×10-5 mol/L)的β-CM7能够降低Na+-K+-ATP酶活力(85.73, 112.06, 109.68 vs 114.93, P = 0.004, 0.73, 0.54, 图2).
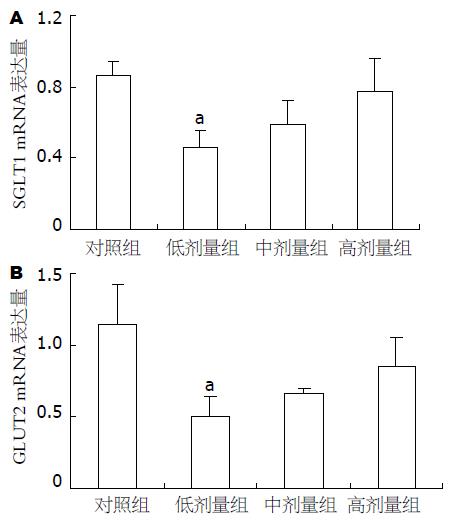
SGLT-1载体在机体葡萄糖吸收中起着主导作用, 其载体数量的多少, 是葡萄糖吸收的决定因素. 与对照组相比, 不同剂量β-CM7实验组均可以降低小肠黏膜SGLT-1 mRNA水平(0.46, 0.58, 0.77 vs 1.11, P = 0.05, 0.17, 0.67). GLUT-2载体在葡萄糖转运过程中可以顺葡萄糖浓度梯度协助转运其进入组织间隙液. 与对照组相比, 不同剂量β-CM7实验组均可以降低小肠黏膜GLUT-2 mRNA水平(0.50, 0.66, 0.85 vs 1.14, P = 0.03, 0.14, 0.30, 图3-4).
随着功能性食物或饲料的开发和研究, 研究食物源性生物活性肽等腔内因子对血糖的影响作用及机制开始受到人们的关注. 乳作为哺乳动物提供优质的蛋白质来源, 主要的钙磷来源、乳源活性肽的重要来源受到优先关注. 有一些相关的研究, 如日本国立健康营养研究所最新研究发现, 同时食用米饭和牛奶可以降低血糖指标, 对防治糖尿病很有帮助, 但作用的有效成分并不明确. Blouet et al[12]研究发现用富含乳清蛋白中主要成分的α-乳白蛋白配制成营养混悬液喂食雄性Wistar大鼠, 其餐后2 h内的血糖明显低于其他蛋白配方饮食组大鼠的血糖. Fird et al[13]对14名Ⅱ型糖尿病患者进行的实验观察中发现, 乳清蛋白能降低其早餐后2 h和午餐后3 h内的血糖升高程度. 但就现有研究看来, 乳清蛋白降低血糖的具体机制还不甚清楚, 有待继续深入研究.
β-CM7是由酪蛋白酶解产生的一类肽, 是乳源活性肽的重要成员之一, 其结构为Tyr-Pro-Phe-Pro-Gly-Pro-Ile. 因其相对分子质量较小, 在小肠内可以以完整肽段的形式被机体吸收, 且不会引起机体的免疫排斥反应, 加之其食物源的安全性, 已越来越多地引起人们的重视[14]. 宗亚峰博士研究发现β-CM7在62.5、125、250 mg/L浓度下, 对小肠囊吸收葡萄糖的量均有一定抑制作用, 其抑制效应呈现一定的剂量关系[10], 有关的机制不详. 在本研究中, 我们发现β-CM7在浓度为7.5×10-7-7.5×10-5 mol/L浓度范围内均能够抑制小肠对葡萄糖的吸收, 这一结果与宗亚峰博士的结果相一致.
葡萄糖在小肠黏膜的吸收机制已基本阐明, 在葡萄糖的吸收转运过程中, 起主导作用的是钠/葡萄糖共转运载体1(sodium/glucose cotransporter 1, SGLT-1). 肠道中的葡萄糖是通过位于肠细胞膜上钠/葡萄糖共转运载体进行主动转运和细胞旁路进行的被动转运的2种方式, 从十二指肠到回肠的肠轴上分布有不同的钠/葡萄糖共转运载体亚型. SGLT-1载体在空肠绒毛细胞膜顶部完全表达, 直接参与D-葡萄糖的转运. 在葡萄糖转运过程中, 首先由位于刷状缘的 SGLT-1与Na+和葡萄糖耦联, 形成Na+载体-葡萄糖复合物, 顺Na+的浓度梯度进入细胞, Na+被Na+-K+-ATPase泵出, 以维持细胞内外Na+的浓度平衡; 随着肠黏膜细胞内葡萄糖的聚集, 由位于基底膜的协助扩散转运载体GLUT-2, 顺葡萄糖浓度梯度协助转运其进入组织间隙液[15-17]. 本研究通过制作离体肠囊, 结果发现β-CM7可以降低 Na+-K+-ATPase活力, 与对照组相比, SGLT-1、GLUT-2 mRNA水平均下降, 特别是低浓度的β-CM7组, 差异极显著. 本研究证实β-CM7可以通过降低Na+-K+-ATPase活力、下调SGLT-1和GLUT-2 mRNA表达, 抑制小肠葡萄糖的转运, 从而降低了小肠对葡萄糖的吸收. 我们的研究结果也提示食用米饭和牛奶降低血糖指标, 乳中产生的β-CM7可能是其有效成分, β-CM7抑制小肠对葡萄糖的吸收可能是其主要机制.
如何对糖尿病患者进行治疗和日常保健, 特别是随着功能性食物的开发和研究, 研究食物源性生物活性肽等腔内因子对血糖的影响作用及机制开始受到人们的关注. 乳蛋白主要有酪蛋白和乳清蛋白, β-酪啡肽-7是β-酪蛋白经酶解释放出的乳源活性肽. 已有研究报道乳清蛋白能够降低血糖, 其机制还不明确, 也有发现β-酪啡肽-7能够降低血糖, 但相关深入研究还未见报道. 本研究探讨了乳中β-酪啡肽-7应用于饮食和健康保健食品中对葡萄糖吸收的影响及其作用机制.
曹志成, 英国生物医学科学研究所院士, 香港伊利沙伯医院临床肿瘤科
富含类降血糖等功能肽的乳及其产品还未有明确的报道, 目前的研究尚处在体外阶段, 进一步的体内研究亟待进行.
Blouet et al研究发现用富含乳清蛋白中主要成分的α-乳白蛋白配制成营养混悬液喂食雄性Wistar大鼠, 其餐后2 h内的血糖明显低于其他蛋白配方饮食组大鼠的血糖.
本研究通过制作翻转离体小肠囊模型研究β-酪啡肽-7对葡萄糖吸收影响, 首次证实乳中β-CM7可以通过影响小肠葡萄糖吸收关键因子, 抑制小肠葡萄糖的转运. 从而减少小肠对葡萄糖的吸收, 可能具有降低血糖的作用.
β-CM7可以通过降低Na+-K+-ATP酶活力及下调SGLT-1、GLUT-2 mRNA水平, 减少大鼠小肠对葡萄糖的吸收.
本文选题较好, 科学性强, 对降低血糖治疗可能有一定的临床意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Gould GW, Holman GD. The glucose transporter family: structure, function and tissue-specific expression. Biochem J. 1993;295:329-341. [PubMed] |
| 2. | Joost HG, Wandel S, Schurmann A. Structure-function relationship of glucose transporters catalyzing facilitated diffusion. Exp Clin Endocrinol. 1994;102:434-438. [PubMed] [DOI] |
| 3. | Dyer J, Daly K, Salmon KS, Arora DK, Kokrashvili Z, Margolskee RF, Shirazi-Beechey SP. Intestinal glucose sensing and regulation of intestinal glucose absorption. Biochem Soc Trans. 2007;35:1191-1194. [PubMed] [DOI] |
| 4. | Zhou L, Cryan EV, D'Andrea MR, Belkowski S, Conway BR, Demarest KT. Human cardiomyocytes express high level of Na+/glucose cotransporter 1 (SGLT1). J Cell Biochem. 2003;90:339-346. [PubMed] [DOI] |
| 5. | Kellett GL, Brot-Laroche E, Mace OJ, Leturque A. Sugar absorption in the intestine: the role of GLUT2. Annu Rev Nutr. 2008;28:35-54. [PubMed] [DOI] |
| 6. | Brantl V, Teschemacher H, Henschen A, Lottspeich F. Novel opioid peptides derived from casein (beta-casomorphins). I. Isolation from bovine casein peptone. Hoppe Seylers Z Physiol Chem. 1979;360:1211-1216. [PubMed] |
| 7. | Froetschel MA. Bioactive peptides in digesta that regulate gastrointestinal function and intake. J Anim Sci. 1996;74:2500-2508. [PubMed] |
| 8. | Ohtani S, Ogawara K, Higaki K, Kimura T. Casein enhances stability of peptides in intestinal lumen: role of digested products of casein. Pharm Res. 2003;20:1746-1751. [PubMed] [DOI] |
| 9. | Zoghbi S, Trompette A, Claustre J, El Homsi M, Garzón J, Jourdan G, Scoazec JY, Plaisancié P. beta-Casomorphin-7 regulates the secretion and expression of gastrointestinal mucins through a mu-opioid pathway. Am J Physiol Gastrointest Liver Physiol. 2006;290:G1105-G1113. [PubMed] [DOI] |
| 10. | 宗 亚峰. β酪啡肽在胃肠道内的释放、吸收和稳定特性及其对胃肠机能的影响. 南京: 南京农业大学 2007; 104-107. |
| 11. | 陈 其才, 严 定友, 吴 政星. 生理学实验. 第1版. 北京: 科学出版社 1995; 110-113. |
| 12. | Blouet C, Mariotti F, Mikogami T, Tome D, Huneau JF. Meal cysteine improves postprandial glucose control in rats fed a high-sucrose meal. J Nutr Biochem. 2007;18:519-524. [PubMed] [DOI] |
| 13. | Frid AH, Nilsson M, Hoist JJ, Björck IM. Effect of whey on blood glucose and insulin responses to composite breakfast and lunch meals in type 2 diabetic subjects. Am J Clin Nutr. 2005;82:69-75. [PubMed] |
| 15. | Rodriguez SM, Guimaraes KC, Matthews JC, McLeod KR, Baldwin RL 4th, Harmon DL. Influence of abomasal carbohydrates on small intestinal sodium-dependent glucose cotransporter activity and abundance in steers. J Anim Sci. 2004;82:3015-3023. [PubMed] |
| 16. | Wright EM. Renal Na(+)-glucose cotransporters. Am J Physiol Renal Physiol. 2001;280:F10-F18. [PubMed] |
| 17. | Reuss L. One-hundred years of inquiry: the mechanism of glucose absorption in the intestine. Annu Rev Physiol. 2000;62:939-946. [PubMed] [DOI] |