修回日期: 2009-06-10
接受日期: 2009-06-18
在线出版日期: 2009-07-08
目的: 观察谷氧还蛋白1(glutaredoxin1, Grx1)在高糖诱导的血管内皮细胞凋亡中的作用及机制.
方法: 在高糖环境中培养人脐静脉内皮细胞, 制备人脐静脉内皮细胞损伤模型. 细胞分为正常对照组、损伤组、Grx1预保护组. 倒置显微镜下观察细胞形态. MTT比色法检测细胞活力以初步观察Grx1对细胞损伤的作用; 采用Annexin V-FITC/PI 双染法, 流式细胞仪检测Grx1对人脐静脉内皮细胞凋亡的影响; 利用Western blot法分析Grx1对Akt、JNK蛋白水平表达的影响.
结果: Grx1预保护组与损伤组比较, 细胞状态明显改善. 与高糖损伤组比较, Grx1预保护组的细胞存活率显著提高(78%±3% vs 59%±2%, P<0.05), 早期凋亡率(0.2360%±0.0156% vs 0.4156%±0.0374%, P<0.05)和晚期凋亡率(0.2433%±0.0278% vs 0.3689%±0.0083%, P<0.05)均明显降低. 与正常对照组相比, 高糖组p-JNK相对含量明显增多(0.64±0.07 vs 0.48±0.03, P<0.05), 而高糖组p-Akt水平较正常对照组显著降低(1.29±0.035 vs 0.69±0.11, P<0.01). 同时, hGrx1保护后p-JNK蛋白水平较高糖组显著降低(0.39±0.05 vs 0.64±0.07, P<0.05); 而p-Akt蛋白水平较高糖组显著增高(0.69±0.11 vs 1.07±0.13, P<0.01).
结论: Grx1可通过抑制JNK激活及激活Akt通路来拮抗高糖诱导的内皮细胞凋亡.
引文著录: 于海涛, 张春晶, 岳丽玲, 于英君. 谷氧还蛋白1在高糖诱导的血管内皮细胞凋亡中的作用及其机制. 世界华人消化杂志 2009; 17(19): 1942-1946
Revised: June 10, 2009
Accepted: June 18, 2009
Published online: July 8, 2009
AIM: To investigate the mechanism underlying the protective effects of glutaredoxin-1 (Grx1) against high glucose-induced apoptosis of umbilical vein endothelial cells.
METHODS: The apoptosis of cultured human umbilical vein endothelial cells (HUVECs) was induced under high glucose conditions. HUVECs were then divided into three groups, namely, control group, high glucose group and Grx1 plus high glucose group. The cells were observed under an inverted light microscope to examine their morphological changes. The proliferation of cells was measured by MTT assay. The influence of Grx1 on the apoptosis of HUVECs was determined by flow cytometry with annexin V-FITC/PI double staining. The expression levels of p-JNK and p-Akt proteins were evaluated by Western blot.
RESULTS: Compared to the high glucose group, cells in the Grx1 plus high glucose group showed a significant improvement in morphology and growth state, a remarkable increase in viability (59% ± 2% vs 78% ± 3%, P < 0.05), as well as an obvious decrease in early (0.4156% ± 0.0374% vs 0.2360% ± 0.0156%, P < 0.05) and late (0.3689% ± 0.0083% vs 0.2433% ± 0.0278%, P < 0.05) apoptotic rates. Compared to the normal control group, the expression level of p-JNK protein in cells in the high glucose group significantly increased (0.48 ± 0.03 vs 0.64 ± 0.07, P < 0.05) while that of p-Akt protein significantly decreased (0.69 ± 0.11 vs 1.29 ± 0.035, P < 0.01). After pretreatment with hGrx1, the expression level of p-JNK protein decreased (0.64 ± 0.07 vs 0.39 ± 0.05, P < 0.05) while that of p-Akt protein increased (0.69 ± 0.11 vs 1.07 ± 0.13, P < 0.01).
CONCLUSION: Grx1 is able to antagonize high glucose-induced apoptosis of human umbilicus vein endothelial cells through inhibition of JNK and activation of the Akt signaling pathway.
- Citation: Yu HT, Zhang CJ, Yue LL, Yu YJ. Mechanism underlying the protective effects of glutaredoxin-1 against high glucose-induced apoptosis of umbilical vein endothelial cells. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1942-1946
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1942.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1942
糖尿病(diabetes mellitus, DM)是一组由遗传和环境因素相互作用而引起的临床综合征, 临床以高血糖为主要标志. 糖尿病的危害主要来自糖尿病并发症如冠心病、脑血管疾病、糖尿病肾病等. 近年来大量研究证实, 高糖环境下自由基产生增多和抗氧化能力减弱二者并存, 是糖尿病血管并发症的重要发病机制. 如何在降血糖的同时调整糖尿病患者体内的氧化应激状态成为糖尿病治疗的新思路[1-2].
在氧化应激引起的损伤中蛋白质的损伤最为重要, 可产生谷胱甘肽化蛋白质(Pr-S-S-G)结构, 细胞中Pr-S-S-G的堆积是引起细胞凋亡损伤及衰老途径的启动因子. 目前已报道了Ⅰ型及Ⅱ型糖尿病等很多疾病与蛋白质的谷胱甘肽化密切相关[3], 因此对谷胱甘肽化的深入研究将为相关疾病的机制研究和治疗提供新的思路. 谷氧还蛋白(glutaredoxin, Grx)是目前发现的能特异而有效地催化Pr-S-S-G还原的酶蛋白, Grx还原体系近几年已成为国内外研究抗氧化防御的热点[4-5]. 目前在糖尿病患者血清中已观察到Grx浓度增高, 并且显微注射重组Grx能加强NADPH对胰岛素颗粒胞吐作用的影响[6], 提示Grx在糖尿病的治疗中可能具有一定的作用. Murata et al[7]研究表明Grx可通过调节Akt的氧化还原状态保护细胞免于凋亡. Daily et al[8]研究表明E. coli Grx2可通过上调Ref-1的表达激活NF-κB的DNA结合活性来抵抗小脑颗粒神经元的凋亡. 进一步分析发现, 重组人Grx1和E. coli Grx2通过同时激活Ras/PI3K/Akt/NF-κB途径和JNK/AP-1途径发挥抗凋亡作用[9]. 基于以上论述, 我们推测如果能够人为增加Grx1的表达水平及含量将有助于提高内皮细胞抗高糖和高游离脂肪酸的氧化损伤能力, 发挥保护内皮细胞的作用, 并且Grx抑制内皮细胞凋亡作用的机制可能是通过调节Akt、JNK表达水平实现的. 但是Grx在高糖诱导的内皮细胞凋亡中的保护作用及其作用机制, 目前国内外均尚未见相关报道. 因此, 本实验以血管内皮细胞为实验对象, 高糖为损伤因素, 研究人Grx1对高糖诱导的血管内皮细胞凋亡抑制作用及机制, 为进一步阐明Grx的生理功用、作用机制及其今后在糖尿病治疗、预防糖尿病血管病变等方面的应用研究奠定基础.
人脐静脉内皮细胞(本室分离培养), 胎牛血清为Hyclone产品、DMEM为Invitrogen产品. 2.5 g/L胰酶-0.02% EDTA为吉诺生物医药技术有限公司产品. MTT(美国Sigma公司), Grx1(本室纯化[10], DP10倒置显微镜(日本Olympus公司), Hoest33258(Sigma分装), 荧光倒置显微镜(德国), 其他试剂均为进口或国产分析纯; Sanyo CO2培养箱, SAFIRE2多功能酶标仪, AnnexinⅤ-PI双染试剂盒(普利莱公司), BD FACS Calibur流式细胞仪(美国BD公司). 兔抗p-Akt抗体(Cell signaling公司)、兔抗p-JNK(Santa Cruz公司)HRP-标记的羊抗兔抗体(北京中杉金桥有限公司).
1.2.1 细胞常规培养及分组: 人脐静脉内皮细胞在含100 mL/L胎牛血清的DMEM培养液中, 于37 ℃、50 mL/L CO2培养箱中培养, 用2.5 g/L胰酶-0.2 g/L EDTA消化、传代. 取增殖旺盛、状态良好的细胞用于实验研究. 细胞分组: 正常对照组(Glu 5 mmol/L), 高糖组(损伤组加入终浓度Glu 25 mmol/L)、Grx1预保护组(高糖+Grx组: Glu 25 mmol/L+hGrx1), hGrx1提前6 h加入至终浓度15 mg/L.
1.2.2 hGrx1对高糖损伤的人脐静脉内皮细胞形态学观察: 人脐静脉内皮细胞接种于25 mL培养瓶中, 每瓶含6.0×105个细胞, 培养24 h后, 细胞分组及给药同上, 每组3瓶, 48 h后倒置显微镜下观察细胞形态.
1.2.3 MTT法检测细胞活力: 将人脐静脉内皮细胞以2×104个/孔的密度接种于96孔培养板中, 用含100 mL/L胎牛血清的 DMEM培养液于37 ℃、含50 mL/L CO2的孵箱中培养24 h, 弃培养液, 换不含血清的新鲜DMEM培养液培养12 h, 使细胞同步化. 分组给药同上, 每组设6个平行孔, 继续培养48 h, 加入50 µL新鲜配制的1 g/L MTT, 37 ℃、50 mL/L CO2培养4 h后, 弃去培养液, 每孔加入100 µL DMSO, 37 ℃轻摇10 min溶解紫色结晶. 30 min内置酶标仪于490 nm波长下测定吸光度(A)值, 以计算细胞活力. 细胞活力百分数 = 实验组吸光度平均值/对照组吸光度平均值×100%.
1.2.4 流式细胞仪检测细胞凋亡率: 收集细胞, 加入500 µL的Binding Buffer悬浮细胞; 加入5 µL Annexin V/FITC混匀后, 加入5 µL Propidium Iodide, 混匀; 室温避光反应15 min; 流式细胞仪上机分析. 流式细胞仪检测: 采用15 mW氩离子激光, 激发光波长为488 nm, 发射波长为530 nm, CELLQuest软件自动获取104个细胞/样品. 流式细胞仪定量分析, 计算annexin V-FITC及PI双染阳性细胞百分含量.
1.2.5 Western blot分析p-JNK、p-Akt表达水平: 收集并裂解细胞, 提取蛋白. 以每泳道40 µg总蛋白上样进行10% SDS-PAGE电泳, 空白孔加入1×SDS上样缓冲液. 电泳结束后转移至NC膜上, 1×TBST洗膜后, 用含TBST配制的50 g/L的脱脂奶粉37 ℃封闭90 min, 1:1000的兔抗p-JNK、抗p-Akt抗体4 ℃过夜孵育. 之后, 1:2000的HRP-标记的羊抗兔抗体室温下孵育1 h, 1×TBST洗膜, ECLplus检测. 同时以β-actin作内参照, 采用YLN2000凝胶成像普通染色分析系统对Western blot结果进行分析.
统计学处理 运用SPSS13.0软件分析数据. 计量资料的数据以mean±SD表示, 组间差异采用t检验进行处理, P<0.05表示差异具有统计学意义.
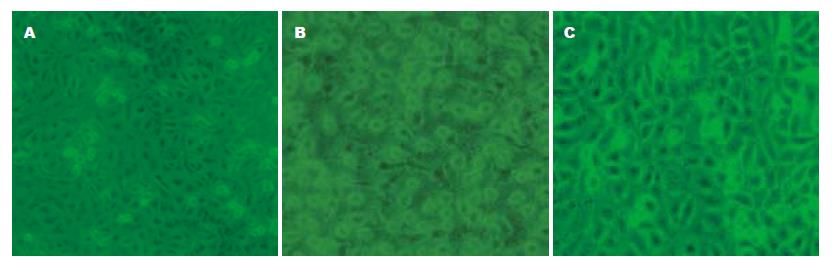
正常对照组细胞贴壁生长并呈鹅卵石样规则排列, 细胞呈短梭形或多角形镶嵌排列, 说明细胞生长状态良好, 增殖旺盛; 损伤组细胞排列紊乱, 细胞间隙增宽, 细胞联结解离、核固缩、部分胞质肿胀、严重者细胞脱落; 在高糖作用下的Grx1保护组细胞形态基本接近于对照组(图1).
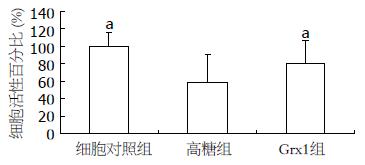
损伤组细胞与正常组进行比较, 差异有统计学意义(t = 0.039, P<0.05); 以高糖损伤组为对照, 在有Grx1预保护的细胞中, 细胞的存活率显著提高, 可由高糖损伤组的59%±2%增加到78%±3%, 差异有统计学意义(P<0.05, 图2).
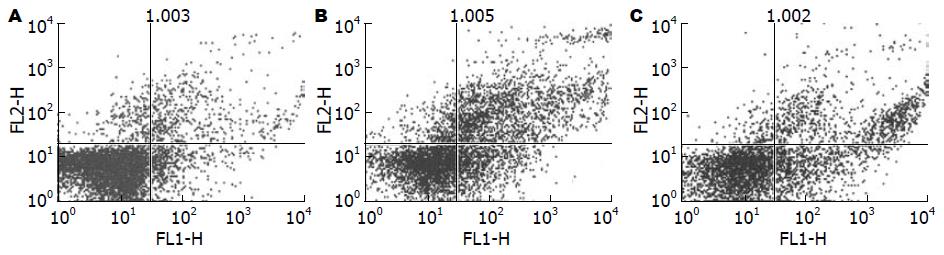
图3中左下象限为活细胞(FITC-/PI-), 右下象限为早期凋亡细胞(FITC+/PI-), 右上象限为晚期凋亡细胞(FITC+/PI+); 流式细胞分析仪检测结果显示, 高糖组可明显使细胞凋亡, 而Grx1预保护组凋亡细胞明显减少. 定量分析结果表明体外培养的血管内皮细胞经高糖模拟损伤后无论是早期还是晚期凋亡率明显高于正常组细胞, 加入Grx1预保护后凋亡率发生相应变化, 其早期和晚期凋亡率均较模型组明显降低(P<0.05), 进一步证实了Grx1具有抗凋亡效应(表1, 图3).
与正常对照组相比, 高糖组p-JNK相对含量明显增多(0.64±0.07 vs 0.48±0.03, P<0.05), 而高糖组p-Akt水平较正常对照组显著降低(0.69±0.11 vs 1.29±0.035, P<0.01). 同时, hGrx1保护后p-JNK蛋白水平较高糖组显著降低(0.39±0.05 vs 0.64±0.07, P<0.05); 而p-Akt蛋白水平较高糖组显著增高(1.07±0.13 vs 0.69±0.11, P<0.01, 图4).
研究表明, 高糖可以抑制内皮细胞生长, 延长细胞周期, 诱导内皮细胞凋亡, 这可能在糖尿病进展中起重要作用. 因此, 抑制高糖诱导的内皮细胞凋亡, 可能是防治糖尿病血管并发症的有效途径. 糖尿病的慢性高血糖和急性高血糖均能促进组织中氧化应激的产生. 动物实验显示, 血管内皮细胞损伤为糖尿病血管病变的原发性因素, 高血糖可引起氧化应激并导致细胞凋亡. 细胞凋亡可从多条途径和多个层面进行调控, 若能阐明高血糖致血管内皮细胞凋亡的机制, 则可进行早期干预, 预防或延缓糖尿病血管并发症的发生发展.
最近的研究表明, 正常生理状态下细胞内蛋白质能发生谷胱甘肽化, 其中这些蛋白质中很多是介导细胞内氧化还原信号转导中的重要蛋白质[2]. MEKK1(MAPK/ERK kinase kinase, MAP3K)是一种重要的蛋白激酶, 参与细胞增殖、分化与凋亡, 在ERK1/2、JNK、p38MAPK途径中均发挥作用. Cross和Templeton发现用甲萘醌作用于细胞, 可以诱导MEKK1激酶结构域中Cys1238发生谷胱甘肽化, 从而抑制他的激活[11].
凋亡信号调节激酶1(apoptosis signal-regulatingkinase 1, ASK1)和Akt(一种丝氨酸/苏氨酸蛋白激酶)均是细胞信号转导途径中的重要激酶. 二者均受磷酸化-去磷酸化调控, 且存在相互作用, Akt通过磷酸化ASK1的Ser83而抑制其活性[12]. 磷酸酶-A(PP-A)可使Akt去磷酸化失活, PP-A可受谷胱甘肽化调节[7]. 因此ASK1和Akt的活性可直接或间接地受谷胱甘肽化的调控.
谷胱甘肽化的逆反应称为去谷胱甘肽化, 这一过程可由体内的巯基-二硫键氧化还原酶催化, 这些酶主要包括Grx, 硫氧还蛋白(Trx)以及蛋白质二硫键异构酶(PDI). 研究表明, 这3种酶中, Grx催化Pr-S-S-G还原的效力及特异性最高. 细胞内氧化还原调控主要是由谷氧还蛋白系统和硫氧还蛋白系统完成. 研究者发现了糖尿病相关的多个氧化应激标志物如血液中的Trx等与血糖升高相关[13-14]. 但研究发现葡萄糖终浓度为5 mmol/L和25 mmol/L的培养基均可导致rMC-1细胞中Grx的选择性上调(与Trx相比), 并且Shelton et al通过向rMC-1细胞中以腺病毒为载体转染Grx1和RNAi技术发现Grx1可促进NF-κB的转位和细胞内黏附分子ICAM-1的表达, 提示Grx可能成为抑制糖尿病视网膜病变的新的治疗靶点[15].
Grx目前被认为是细胞内一种重要的抗凋亡因子, 在调节细胞生长和凋亡的多条信号通路中发挥作用[16-18]. 研究还发现, Grx1通过调节Akt的氧化还原状态可阻止由过氧化氢诱导的细胞凋亡; Grx也可以通过NF-κB途径抑制神经递质多巴胺(DA)对细胞氧化应激损伤所介导的凋亡. 本实验发现Grx1保护组细胞, 其细胞形态较损伤组明显改善; 初步证实Grx1在一定程度上能抵御高糖对细胞的氧化损伤; MTT实验表明, Grx1保护组细胞的存活率较损伤组细胞显著提高, 而与正常对照组比较有所降低, 表明Grx1能有效增加细胞的增殖活力; 即Grx1对高糖所诱导的人脐静脉内皮细胞损伤有明确的保护作用; 流式细胞术检测显示, 凋亡细胞明显减少, 进一步证实了Grx1具有抗凋亡效应. Western blot显示在Grx1存在下, p-Akt表达水平显著升高, p-JNK表达被抑制, 说明Grx1通过调节JNK及Akt磷酸化活性拮抗高糖诱导的内皮细胞凋亡.
Grx1作为细胞中一种重要的抗氧化剂和细胞氧化还原信号传导途径中的重要调控因子, 对其作用机制的阐明将有助于探讨氧化应激和谷胱甘肽化蛋白质在各种相关疾病中的作用, 为今后hGrx1临床应用奠定基础, 这对于人类氧化应激相关疾病的预防和治疗有重要的意义.
血管内皮细胞损伤为糖尿病血管病变的原发性因素, 高血糖可引起氧化应激并导致细胞凋亡. 氧化应激可产生谷胱甘肽化蛋白质(Pr-S-S-G)结构, 细胞中Pr-S-S-G的堆积是引起细胞凋亡损伤及衰老途径的启动因子. 谷氧还蛋白(Grx)催化Pr-S-S-G还原的效力及特异性高, 对其作用机制的阐明将有助于探讨氧化应激和谷胱甘肽化蛋白质在各种相关疾病中的作用.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科
近年来大量研究证实, 高糖环境下自由基产生增多和抗氧化能力减弱二者并存, 是糖尿病血管并发症的重要发病机制. 如何在降血糖的同时调整糖尿病患者体内的氧化应激状态成为糖尿病治疗的新思路.
最近的研究表明, 正常生理状态下细胞内蛋白质能发生谷胱甘肽化, 其中这些蛋白质中很多是介导细胞内氧化还原信号转导中的重要蛋白质.
本文以分离培养的人脐静脉内皮细胞为实验模型, 通过观察细胞生长形态、增殖状况、凋亡反应以及信号转导通路中重要功能蛋白水平等方面的变化, 证明了Grx1蛋白对高糖环境所诱导血管内皮细胞凋亡具有一定保护作用, 并初步探讨了相关作用机制.
Grx1可通过抑制JNK激活及激活Akt通路来拮抗高糖诱导的内皮细胞凋亡.
本研究设计合理, 创新性强, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 2. | Ghezzi P, Bonetto V, Fratelli M. Thiol-disulfide balance: from the concept of oxidative stress to that of redox regulation. Antioxid Redox Signal. 2005;7:964-972. [PubMed] [DOI] |
| 3. | Giustarini D, Rossi R, Milzani A, Colombo R, Dalle-Donne I. S-glutathionylation: from redox regulation of protein functions to human diseases. J Cell Mol Med. 2004;8:201-212. [PubMed] [DOI] |
| 4. | Gul M, Atalay M, Gul HI, Nakao C, Lappalainen J, Hanninen O. The effects of some Mannich bases on heat shock proteins HSC70 and GRP75, and thioredoxin and glutaredoxin levels in Jurkat cells. Toxicol In Vitro. 2005;19:573-580. [PubMed] [DOI] |
| 5. | Xiao R, Lundström-Ljung J, Holmgren A, Gilbert HF. Catalysis of thiol/disulfide exchange. Glutaredoxin 1 and protein-disulfide isomerase use different mechanisms to enhance oxidase and reductase activities. J Biol Chem. 2005;280:21099-21106. [PubMed] [DOI] |
| 6. | Ivarsson R, Quintens R, Dejonghe S, Tsukamoto K, in 't Veld P, Renström E, Schuit FC. Redox control of exocytosis: regulatory role of NADPH, thioredoxin, and glutaredoxin. Diabetes. 2005;54:2132-2142. [PubMed] [DOI] |
| 7. | Murata H, Ihara Y, Nakamura H, Yodoi J, Sumikawa K, Kondo T. Glutaredoxin exerts an antiapoptotic effect by regulating the redox state of Akt. J Biol Chem. 2003;278:50226-50233. [PubMed] [DOI] |
| 8. | Daily D, Vlamis-Gardikas A, Offen D, Mittelman L, Melamed E, Holmgren A, Barzilai A. Glutaredoxin protects cerebellar granule neurons from dopamine-induced apoptosis by activating NF-kappa B via Ref-1. J Biol Chem. 2001;276:1335-1344. [PubMed] [DOI] |
| 11. | Cross JV, Templeton DJ. Oxidative stress inhibits MEKK1 by site-specific glutathionylation in the ATP-binding domain. Biochem J. 2004;381:675-683. [PubMed] [DOI] |
| 12. | Kim AH, Khursigara G, Sun X, Franke TF, Chao MV. Akt phosphorylates and negatively regulates apoptosis signal-regulating kinase 1. Mol Cell Biol. 2001;21:893-901. [PubMed] [DOI] |
| 14. | Thirunavukkarasu M, Penumathsa SV, Koneru S, Juhasz B, Zhan L, Otani H, Bagchi D, Das DK, Maulik N. Resveratrol alleviates cardiac dysfunction in streptozotocin-induced diabetes: Role of nitric oxide, thioredoxin, and heme oxygenase. Free Radic Biol Med. 2007;43:720-729. [PubMed] [DOI] |
| 15. | Shelton MD, Kern TS, Mieyal JJ. Glutaredoxin regulates nuclear factor kappa-B and intercellular adhesion molecule in Müller cells: model of diabetic retinopathy. J Biol Chem. 2007;282:12467-12474. [PubMed] [DOI] |
| 16. | Song JJ, Rhee JG, Suntharalingam M, Walsh SA, Spitz DR, Lee YJ. Role of glutaredoxin in metabolic oxidative stress. Glutaredoxin as a sensor of oxidative stress mediated by H2O2. J Biol Chem. 2002;277:46566-46575. [PubMed] [DOI] |
| 17. | Song JJ, Lee YJ. Effect of glucose concentration on activation of the ASK1-SEK1-JNK1 signal transduction pathway. J Cell Biochem. 2003;89:653-662. [PubMed] [DOI] |
| 18. | Daily D, Vlamis-Gardikas A, Offen D, Mittelman L, Melamed E, Holmgren A, Barzilai A. Glutaredoxin protects cerebellar granule neurons from dopamine-induced apoptosis by dual activation of the ras-phosphoinositide 3-kinase and jun n-terminal kinase pathways. J Biol Chem. 2001;276:21618-21626. [PubMed] [DOI] |