修回日期: 2009-06-18
接受日期: 2009-06-23
在线出版日期: 2009-07-08
目的: 探讨透细胞性PTD-NBD多肽对脂多糖诱导的炎性效应的干预与作用机制.
方法: 以脂多糖刺激大鼠胰腺腺泡细胞AR42J, 构建急性胰腺炎的体外模型. 不同浓度免疫缺陷性病毒PTD多肽蛋白转导功能区与野生型NBD多肽融合成PTD-NBD多肽, 对AR42J细胞进行预处理, 突变型PTD-NBD(MT)多肽、PTD、NBD为对照. RT-PCR法观察ICAM-1及IL-1β mRNA的表达; 定量酶联免疫吸附法检测培养液上清中IL-1β蛋白浓度的改变.
结果: 透细胞性PTD-NBD多肽可以抑制脂多糖诱导的AR42J炎症细胞因子ICAM-1和IL-1β mRNA及蛋白的表达, 且呈剂量依赖方式. PTD-NBD(WT)多肽与单纯NBD多肽、突变型PTD-NBD(MT)多肽及PTD组比较(相对灰度值: 0.449±0.088 vs 1.132±0.069, 1.158±0.095, 1.206±0.078), 能够抑制ICAM-1 mRNA表达. 上述4组的IL-1β mRNA相对灰度值分别为0.526±0.077, 0.993±0.065, 1.143±0.086和1.128±0.117, IL-1β蛋白表达分别为278.82±61.80 ng/L、898.08±74.65 ng/L、945.25±42.49 ng/L和947.86±38.66 ng/L, 结果显示后3组不能抑制IL-1β mRNA及其蛋白的表达.
结论: PTD-NBD(WT)多肽可以呈剂量依赖方式抑制LPS诱导的AR42J促炎细胞因子IL-1β和ICAM-1的表达, 其可直接影响胰腺腺泡细胞炎性反应.
引文著录: 刘学进, 龙友明, 陈垦, 谢文瑞, 王晖. PTD-NBD多肽对大鼠胰腺腺泡细胞炎性反应的抑制作用. 世界华人消化杂志 2009; 17(19): 1931-1935
Revised: June 18, 2009
Accepted: June 23, 2009
Published online: July 8, 2009
AIM: To explore the effects of cell permeable PTD-NBD peptide on rat pancreatic acinus AR42J cell induced by lipopolysaccharide.
METHODS: AR42J cell lines were stimulated by lipopolysaccharide with a dose of 10 mg/L for 24 h. The wild type PTD-NBD peptide was incubated with AR42J cells with different concentrations (10-1-102 mg/L) before the inflammation induced by lipopolysaccharide. At the same time, the mutant type PTD-NBD peptide, PTD and NBD peptide were used as control peptide fragments. The expressions of ICAM-1 and IL-1β mRNA were detected using reverse transcription-polymerase chain reaction (RT-PCR), and IL-1β protein was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The PTD-NBD (WT) peptide inhibited the expression of ICAM-1 and IL-1β mRNA (0.449 ± 0.088, 0.526 ± 0.077), but also decreased the IL-1β protein level (278.82 ± 61.80 ng/L) in a dose-dependent manner. NBD (1.132 ± 0.069), PTD- NBD (MT) (1.158 ± 0.095) and PTD (1.206 ± 0.078) did not inhibit the expression of ICAM-1 mRNA. NBD (0.993 ± 0.065), PTD- NBD (MT) (1.143 ± 0.086) and PTD (1.128 ± 0.117) did not inhibit the expression of IL-1β mRNA. NBD (898.08 ± 74.65 ng/L), PTD-NBD (MT) (945.25 ± 42.49 ng/L) and PTD (947.86 ± 38.66 ng/L) failed to inhibit the expression of IL-1β protein.
CONCLUSION: The wild type PTD-NBD peptide is able to inhibit the expression of ICAM-1and IL-1β induced by LPS on AR42J cell lines in a dose-dependent manner. We confirmed PTD-NBD peptide can take effect on acinus cell directly. The result showed the early event and new therapeutic pathway of acute pancreatitis.
- Citation: Liu XJ, Long YM, Chen K, Xie WR, Wang H. Inhibitory effects of cell-permeable PTD-NBD peptide on lipopolysaccharide-induced inflammation of pancreatic acinar cell line AR42J. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1931-1935
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1931
脂多糖(lipopolysaccharide, LPS)已证实参与了急性胰腺炎(acute pancreatitis, AP)的病理生理过程, LPS可以结合在单核细胞CD14受体上, 从而激活单核巨噬细胞释放多种炎症介质, 同时还可以通过直接影响胰腺腺泡细胞而发挥作用, 包括空泡的形成、核改变以及胰腺炎相关蛋白mRNA、细胞因子如白介素-1(interleukin-1, IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、细胞间黏附分子-1(intercellular adhesion molecule, ICAM-1)等和淀粉酶mRNA表达而发挥作用, 可促使多器官功能不全综合征和系统性炎症反应综合征的发生[1-2]. 我们的实验证实, LPS刺激大鼠胰腺腺泡细胞(AR42J细胞)后, 不仅通过核因子-κB(nuclear factor kappa B, NF-κB)活化介导上调ICAM-1促炎基因的表达, 而且ICAM-1促炎因子的表达反过来又以一种正反馈调节的方式激活NF-κB, 促进细胞因子的进一步释放, 使炎症信号和细胞因子反应得以放大和持续[3]. 一种具有"TTLDWSWLQME"氨基酸序列的小分子肽能阻断NF-κB活化通路上游激酶复合物中的调节亚基(NF-κB essential modulator, NEMO)的N末端α螺旋区[4]. 目前被应用于鼠的AP模型及关节炎动物模型治疗, 具有良好的抗炎效应[5-6]. 该结构的小分肽能否直接影响胰腺腺泡细胞炎性反应目前尚不清楚. 本实验利用人工合成的上述透细胞膜性小分子多肽预处理AR42J细胞, 观察其对LPS诱导的细胞因子炎性反应的影响, 为AP的治疗与研究提供新的途径.
胰腺腺泡AR42J细胞株(ATCC Number: CRL-1492)由武汉大学中国典型培养物保藏中心(CCTCC)从美国典型培养物保藏中心(ATCC)引进. 大鼠IL-1β ELISA定量试剂盒, 广州晶美生物公司; F12培养基, Gibco USA; 胎牛血清, 杭州四季青; 琼脂糖, Promega USA; LPS, Sigma USA; 胰蛋白酶, 广州威佳科技有限公司; DNA Marker, 北京华美生物工程公司; RNase抑制剂, Promega USA; PCR引物, 上海博亚生物技术有限公司; TRIzolTM Reagent, 美国Invitrogen公司; EX Taq酶, 日本TaKaRa公司; M-MLV逆转录酶, Promega USA; NBD多肽, 西安美联生物有限公司合成.
1.2.1 细胞培养: 用含200 mL/L灭活胎牛血清F12培养基(pH 7.2-7.4), 于37 ℃、50 mL/L CO2培养箱中进行培养, 3-4 d换液1次, 用2.5 g/L胰蛋白酶(trypsin)和0.03% EDTA消化, 1:3-1:4传代. 本实验使用第20-26代对数生长期细胞, 以1-2×106细胞/孔(1.8 mL)接种于6孔培养板, 在50 mL/L CO2培养箱中37 ℃孵育12 h, 细胞贴壁后, 分别加入0.2 mL的无血清无双抗的培养基F12及100 mg/L浓度(终浓度10 mg/L)的LPS溶液, 孵育24 h后, 分别收集细胞和培养液上清备用. 每组设3个平行孔.
1.2.2 多肽设计及合成: 具有细胞穿透性的小分子NBD多肽序列根据参考文献[4]设计. 其为蛋白转导多肽PTD与NBD多肽的融合性多肽, 简称为PTD-NBD多肽, 委托西安美联生物公司合成. 其序列为: YGRKKRRQRRR-G-TTLDWSWLQME, 由于此连接的NBD肽和野生型(WT)NBD序列一致, 简称为PTD-NBD(WT). 为分析NBD多肽和NEMO结合的特异性我们设计一条突变型(MT)的PTD-NBD(MT), 其序列为: YGRKKRRQRRR-G-TTLDASALQME融合性多肽. 为了分析PTD对多肽的细胞导入作用, 另外单独合成了PTD和NBD多肽. 使用前用无血清无双抗的培养基分别配制成0.1、1、10、100 mg/L不同浓度的多肽溶液.
1.2.3 RNA的抽提及RT-PCR: 总RNA的提取参照Invitrogen公司的TRIzol试剂说明书进行. 引物的设计与合成: 按照文献公布的GenBank上大鼠β-Actin(Gi: 42475962)、ICAM-1(Gi: 220778)和IL-1β(Gi: 13928691)cDNA序列, 借助于Primer Premier 5.0生物软件设计他们各自特异的引物, 委托上海博亚生物技术有限公司合成. 内参照β-actin扩增片段长度701 bp, 正义为: 5'-gccaaccgtgaaaagatga-3', 反义为: 5'-gccaggatagagccaccaat-3'. ICAM-1扩增片段长度433 bp, 正义为: 5'-aacgacgcttcttttgctc-3', 反义为: 5'-ctctggcggtaataggtgtaa-3'. IL-1β扩增片段长度307 bp, 正义为: 5'-ggatgatgacgacctgctagtgt-3', 反义为: 5'-cttctttgggPTDtgtttggga-3'. RT-PCR采用二步法. Gel 100凝胶成像系统(美国BIO-RAD公司)紫外灯下观察电泳结果和摄影, 并用其自带的Quantity 4.5.1软件进行吸光度分析, 分别计算出ICAM-1、IL-1β与β-actin(内参照)的吸光度积分值比作为ICAM-1、IL-1β表达的相对表达量.
1.2.4 定量ELISA法测定培养液上清细胞因子的浓度: 按照晶美生物公司ELISA试剂盒说明书进行.
统计学处理 计量资料用mean±SD表示, SPSS11.0统计软件进行方差分析, 预先进行正态性检验和方差齐性检验. P<0.05为有统计学意义.
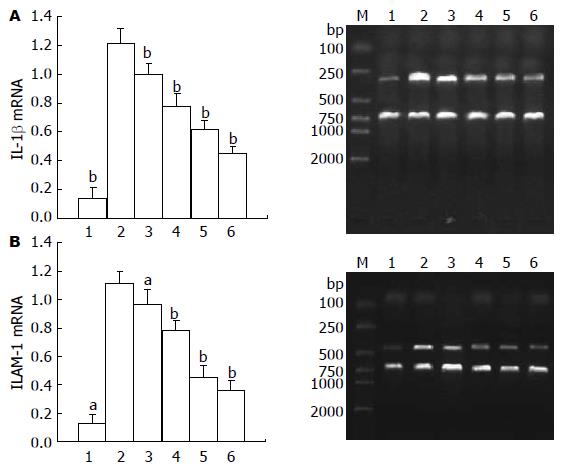
2.1.1 PTD-NBD(WT)多肽对AR42J细胞IL-1β mRNA表达的影响: RT-PCR检测结果表明(表1, 图1), AR42J细胞可表达少量IL-1β mRNA, 10 mg/L的LPS刺激24 h后IL-1β mRNA表达上调(P<0.01). 0.1 mg/L的PTD-NBD(WT)多肽预处量2 h即可以抑制LPS诱导的IL-1β mRNA表达(P<0.05), 且以剂量依赖方式地抑制IL-1β mRNA的表达, 在100 mg/L浓度时达到高峰. 我们进一步分别用10 mg/L的PTD-NBD(WT)、NBD、PTD-NBD(MT)或PTD肽孵育AR42J细胞2 h后, 再用10 mg/L LPS刺激24 h, 观察肽段的作用特异性. 结果表明(表2), NBD、PTD-NBD(MT)或PTD肽都不能抑制LPS诱导的IL-1β mRNA的表达.
2.1.2 PTD-NBD(WT)多肽对AR42J细胞IL-1β蛋白表达的影响: 不同浓度PTD-NBD(WT)多肽孵育AR42J细胞2 h后, 再用10 mg/L刺激24 h, 其变化ELISA检测结果表明(表1), AR42J细胞表达IL-1β蛋白, LPS可刺激IL-1β蛋白的上调(P<0.01), 0.1 mg/L以上的PTD-NBD(WT)多肽以剂量依赖方式抑制LPS诱导的IL-1β蛋白的合成, 并在100 mg/L浓度时达到高峰(P<0.01). 特异性实验: 分别用10 mg/L的PTD-NBD(WT)、NBD、PTD-NBD(MT)或PTD肽孵育AR42J胞2 h后, 再用10 mg/L LPS刺激24 h, 培养液上清中IL-1β蛋白的变化结果表明NBD多肽、PTD-NBD(MT)或PTD肽都不能抑制LPS刺激IL-1β蛋白的合成(表2).
2.2.1 不同浓度PTD-NBD(WT)多肽对AR42J细胞ICAM-1 mRNA表达的影响: RT-PCR检测结果表明(表1, 图1), AR42J细胞表达ICAM-1 mRNA, LPS可刺激ICAM-1 mRNA表达的上调(P<0.01), 0.1 mg/L的PTD-NBD(WT)多肽即可以抑制LPS刺激ICAM-1 mRNA的表达(P<0.05), 且呈剂量依赖方式抑制ICAM-1 mRNA的表达, 并在100 mg/L浓度时达到高峰(P<0.01).
2.2.2 PTD-NBD(WT)多肽与各对照肽段对AR42J细胞ICAM-1 mRNA表达的影响: 分别用10 mg/L的PTD-NBD(WT)、NBD、PTD-NBD(MT)或PTD肽孵育AR42J细胞2 h后, 再用10 mg/L LPS刺激24 h, ICAM-1 mRNA表达的变化. RT-PCR检测结果表明(表2), PTD-NBD(WT)多肽可以抑制LPS诱导ICAM-1 mRNA的表达, 而NBD多肽、PTD-NBD(MT)或PTD肽均不能抑制ICAM-1 mRNA的表达.
LPS是G-细菌细胞壁的主要成分, 已证实参与了AP的病理生理过程. 但AP时细胞的早期事件腺泡细胞损伤的确切机制尚未完全阐明[3]. 目前普遍认为LPS是单核巨噬细胞的强烈激活剂, 诱导促炎细胞因子如IL-1β、IL-6、IL-8和ICAM-1等的分泌. 已有多项研究表明小剂量LPS可以诱导腺泡细胞凋亡增加, 减轻AP的病理过程, 而大剂量LPS可引起腺泡细胞水肿, 出现膜连接性空泡及胞质膜的断裂, 腺细胞和溶酶体的破坏. 但LPS对胰腺腺泡细胞因子表达的影响国内外学者研究较少. AR42J为大鼠胰腺腺泡细胞株, 具有正常胰腺腺泡细胞的大部分功能, 如合成及分泌消化酶; 胞膜受体的表达和信号转导机制也与正常胰腺腺泡细胞相平行, 被较多应用于胰腺体外实验研究. 既往我们的研究显示, 在LPS刺激下, AR42J表达ICAM-1 mRNA及蛋白均明显增高, 呈时间依赖性[3]. 本次实验亦证实, LPS刺激后的IL-1β, ICAM-1增高, 结果与文献报道一致, 提示胰腺腺泡AR42J细胞产生、释放的促炎细胞因子在AP炎症反应的启动、放大和维持方面可能起着重要的作用, 他不但是产生炎症介质的细胞, 同时也是炎症介质的靶细胞[7].
ICAM-1、TNF-α、IL-1β、IL-6及IL-8等多种细胞因子的启动子区域含有NF-κB的特异性结合位点(κB位点), NF-κB调节着包括ICAM-1、TNF-α和IL-1β在内的多种细胞因子和炎症介质基因的转录, 在机体的免疫和炎症反应、凋亡调控等方面发挥重要作用. 上游激酶(inhibition of IκB kinase, IKK)的活化是激活NF-κB信号通路的主要限速步骤, 其复合物中的调节亚基(NF-κB essential modulator, NEMO)的N末端α螺旋区, 被称为NEMO结合区(NBD区, 序列为Leu- Asp-Trp-Ser- Trp-Leu), 是IKKα、IKKβ和NEMO(IKKγ)相互作用从而维持IKK活性的结构基础. 利用外源性氨基酸片竞争结合这一区域是抑制NF-κB通路的新方法. 有研究已经证实, 外源性NBD多肽和NEMO结合后, 封闭了NEMO与IKK催化亚基IKKα和IKKβ的结合位点, 进而下调IKK激酶的活性, 从而选择性抑制NF-κB的DNA结合活性, 为炎症/免疫性疾病的治疗提供了新的途径[8]. May et al设计了一种跨越NBD全长的可通过细胞膜的多肽(称为小分子NBD多肽), 发现在Hela细胞中这种小分子多肽可抑制TNF-α诱导的IKK活性, 抑制NF-κB的核易位和DNA结合活性, 下调依赖NF-κB的炎症细胞因子mRNA转录, 而且, NBD多肽可以轻度上调NF-κB的基础生理功能[8]. Ethridge et al发现这种野生型NBD多肽预处理蛙皮素诱发的急性水肿性胰腺炎后, 可降低胰腺和肺的炎症反应程度, 同时减少致炎细胞细胞因子的表达[5-6].
本研究设计合成了NBD(WT)多肽, 并与具有透膜作用的PTD融合成野生型PTD-NBD多肽(WT), 结果发现0.1 mg/L的PTD-NBD多肽处理时即可显著抑制LPS刺激的IL-1β和ICAM-1 mRNA的表达, 且呈量效关系. 同时亦发现, 伴随着IL-1β mRNA表达的明显下调, 其蛋白的表达亦明显下调, 与PTD-NBD多肽呈量效关系. 证实了PTD-NBD多肽可直接作用胰腺腺泡细胞, 抑制LPS诱导的细胞因子相关的炎性反应. 同时为证实NBD多肽作用是序列特异的, 我们设立一个突变型的NBD多肽并且和PTD进行融合, 突变型的PTD-NBD多肽(MT)是739及741位色基酸被酪氨酸所替代, 从而失去了与NEMO的结合活性. 结果表明PTD-NBD多肽(MT)没有抑制细胞因子IL-1β和ICAM-1的表达. 同时设置了不和PTD融合的NBD多肽组作为对照, 观察PTD多肽是否能促进NBD透膜作用, 结果发现与单纯PTD组或NBD组相比, 单纯无透膜作用NBD多肽不能抑制细胞因子IL-1β和ICAM-1基因的表达. PTD-NBD多肽对胰腺腺泡上述作用, 是否经过NF-κB活化通路起作用, 需要我们作更深入的研究.
总之, 我们的研究结果表明, PTD-NBD(WT)多肽可以呈剂量依赖方式地抑制LPS诱导的AR42J促炎细胞因子IL-1β和ICAM-1的表达, 因而其可直接影响胰腺腺泡细胞炎性反应, 为AP的早期细胞事件及的治疗研究提供理论依据.
目前普遍认为LPS是单核巨噬细胞的强烈激活剂, 诱导促炎细胞因子如IL-1β、IL-6、IL-8和ICAM-1等的分泌. 已有多项研究表明小剂量LPS可以诱导腺泡细胞凋亡增加, 减轻AP的病理过程, 而大剂量LPS可引起腺泡细胞水肿, 出现膜连接性空泡及胞质膜的断裂, 腺细胞和溶酶体的破坏. 但LPS对胰腺腺泡细胞因子表达的影响国内外学者研究较少.
潘秀珍, 教授, 福建省立医院消化内
一种具有"TTLD WSWLQME"氨基酸序列的小分子肽能阻断NF-κB活化通路上游激酶复合物中的调节亚基(NEMO)的N末端α螺旋区. 目前被应用于鼠的AP模型及关节炎动物模型治疗, 具有良好的抗炎效应. 该结构的小分肽能否直接影响胰腺腺泡细胞炎性反应目前尚不清楚.
May et al设计了一种跨越NBD全长的可通过细胞膜的多肽(称为小分子NBD多肽), 发现在Hela细胞中这种小分子多肽可抑制TNF-α诱导的IKK活性, 抑制NF-κB的核易位和DNA结合活性, 下调依赖NF-κB的炎症细胞因子mRNA转录, 而且, NBD多肽可以轻度上调NF-κB的基础生理功能.
本研究通过合成野生型NBD多肽和具有透膜作用的PTD多肽融合, 可以抑制NF-κB的抑制物的激酶活化, 继而抑制NF-κB的活化, 导致细胞因子的下调, 可直接影响胰腺腺泡细胞炎性反应, 为AP的早期细胞事件及其治疗研究提供理论依据.
PTD-NBD(WT)多肽可以呈剂量依赖方式地抑制LPS诱导的AR42J促炎细胞因子IL-1β和ICAM-1的表达, 因而其可直接影响胰腺腺泡细胞炎性反应, 为AP的早期细胞事件及的治疗研究提供理论依据.
本研究立题依据充分, 设计合理, 技术难度较大, 研究重点突出, 结果可靠, 对急性胰腺炎病情加重的炎症因子反应提供了理论依据, 对临床的急性胰腺炎的防治有参考意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Steinle AU, Weidenbach H, Wagner M, Adler G, Schmid RM. NF-kappaB/Rel activation in cerulein pancreatitis. Gastroenterology. 1999;116:420-430. [PubMed] [DOI] |
| 2. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 4. | Dai S, Hirayama T, Abbas S, Abu-Amer Y. The IkappaB kinase (IKK) inhibitor, NEMO-binding domain peptide, blocks osteoclastogenesis and bone erosion in inflammatory arthritis. J Biol Chem. 2004;279:37219-37222. [PubMed] [DOI] |
| 5. | Strickland I, Ghosh S. Use of cell permeable NBD peptides for suppression of inflammation. Ann Rheum Dis. 2006;65 Suppl 3:iii75-iii82. [PubMed] [DOI] |
| 6. | Ethridge RT, Hashimoto K, Chung DH, Ehlers RA, Rajaraman S, Evers BM. Selective inhibition of NF-kappaB attenuates the severity of cerulein-induced acute pancreatitis. J Am Coll Surg. 2002;195:497-505. [PubMed] [DOI] |