修回日期: 2009-06-10
接受日期: 2009-06-15
在线出版日期: 2009-07-08
目的: 观察蛋氨酸胆碱缺乏饮食(MCD)引起的大鼠NASH模型中, 各个时期肝脏中脂联素及其受体2的表达.
方法: 大鼠普通饲料喂养1 wk后随机分为对照组与NASH模型组, 分别给予MCD和胆碱补充饮食(CS). 均在第3、5、8、12周处死. 肝脏切片作染色, 评估NASH模型效果. 取肝脏抽提总RNA, 作RT-PCR测定脂联素及脂联素受体2的mRNA水平, 与标准化的β-actin条带作对比后测定其表达.
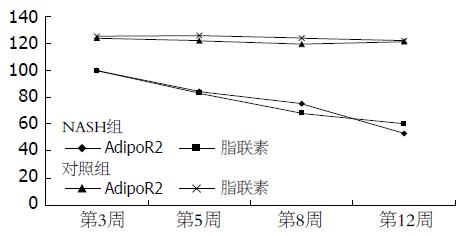
结果: 随着时间的延长, 对照组中, 脂联素及其受体2的表达无明显变化(均P>0.05). 而NASH模型组中, 在3、5、8 wk, 脂联素和脂联素受体2的表达均逐渐下降, 大多有极显著差异(1.004±0.08 vs 1.25±0.09, 0.83±0.06 vs 1.26±0.07, 0.68±0.10 vs 1.24±0.08; 1.00±0.06 vs 1.24±0.07, 0.84±0.0.7 vs 1.22±0.09, 0.75±0.09 vs 1.19±0.05, all P<0.05); 到12 wk发生肝脏纤维化, 脂联素受体2表达较第8周显著减少, 脂联素表达下降, 较第8周水平呈现临界性差异(P = 0.073).
结论: 在NASH发生和发展过程中, 肝脏中脂联素及其受体2表达下降, 进一步研究可加深对NASH发病机制的了解, 可能为治疗提供新的靶点.
引文著录: 钱晓武, 范竹萍, 汪晓红, 盛黎, 奚志峰, 邱德凯. 脂联素及其受体2在非酒精性脂肪性肝炎发病过程中的表达. 世界华人消化杂志 2009; 17(19): 1925-1930
Revised: June 10, 2009
Accepted: June 15, 2009
Published online: July 8, 2009
AIM: To investigate the expression of adiponectin and adiponectin receptor 2 (AdipoR2) in the liver during the development of nonalcoholic steatohepatitis (NASH) resulting from a methionine-choline deficient (MCD) diet.
METHODS: Rats were fed either MCD or CS diets and sacrificed at weeks 3, 5, 8 and 12, respectively, to take liver samples. Liver slices were stained to assess the effects of these diets. After total RNA was extracted from frozen liver tissue, RT-PCR was performed to determine the mRNA expression of adiponectin and AdipoR2 genes. The expression levels of adiponectin and AdipoR2 genes relative to β-actin were then determined.
RESULTS: In rats fed the CS diet, the expression of adiponectin and AdipoR2 genes showed no significant changes with the prolongation of feeding duration (all P > 0.05). In rats fed the MCD diet, the expression of adiponectin and AdipoR2 genes gradually declined at weeks 3, 5 and 8, with a very significant difference (1.004 ± 0.08 vs 1.25 ± 0.09, 0.83 ± 0.06 vs 1.26 ± 0.07, 0.68 ± 0.10 vs 1.24 ± 0.08; 1.00 ± 0.06 vs 1.24 ± 0.07, 0.84 ± 0.0.7 vs 1.22 ± 0.09, 0.75 ± 0.09 vs 1.19 ± 0.05, all P < 0.05). At week 12, liver fibrosis was observed, and the expression of both AdipoR2 and adiponectin genes significantly declined (P = 0.073).
CONCLUSION: The expression of adiponectin and AdipoR2 genes in the liver declines during the development of NASH, suggesting that they may be involved in the pathogenesis of NASH. Further study on adiponectin and AdipoR2 genes will deepen our understanding of the pathogenesis of NASH and may provide new treatments for this disease.
- Citation: Qian XW, Fan ZP, Wang XH, Sheng L, Xi ZF, Qiu DK. Expression of adiponectin and its receptor 2 during the development of nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1925-1930
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1925.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1925
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是包括肝脏单纯脂肪变性、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、脂肪性肝纤维化等一系列疾病总称[1-2]. NASH是进展性疾病[3-6], 其具体机制尚不完全清楚. NASH发病机制的"二重打击"理论认为胰岛素抵抗是第1次打击[7], 导致肝脏对多种损伤因素敏感; 第2次打击如脂质过氧化、炎症、内毒素等损伤因子导致脂肪变的肝脏发生炎症、坏死和纤维化. 很多学者均认为NASH实际上为代谢综合征的肝脏表现[8], 而胰岛素抵抗是其中心环节, 因此胰岛素抵抗在NASH发病中起到重要的作用.
流行病学研究表明肥胖是NASH的独立危险因素[9-11]. 肥胖现被认为是一种慢性炎症状态, 多存在胰岛素抵抗. 肥胖者存在脂肪尤其是腹部内脏脂肪的过度堆积, 脂肪是活性内分泌器官, 可以分泌多种脂肪细胞因子, 而胰岛素抵抗常与脂肪细胞因子的分泌异常引起的继发性改变有关. 这些细胞因子包括瘦素、脂联素、TNF-α、IL-6等. 脂肪细胞因子脂联素(adiponectin)是一种由244个氨基酸组成的蛋白质, 与TNF-α结构相似, 在1995年首次报道[12], 具有胰岛素增敏作用. 血清脂联素水平和BMI指数呈现负相关[13], 低脂联素血症为2型糖尿病[14]、高血压[15]、动脉粥样硬化[16]、NASH[17]等的独立危险因素. 有学者认为[17], 低脂联素血症应该是NASH的特征性标志. 同时脂联素还具有很强的抗炎作用[18]. 2003年, Yamauchi et al发现了脂联素受体(AdipoR)[20]. AdipoR1在体内广泛分布, 但在骨骼肌中最丰富, AdipoR2主要在肝脏中表达[20]. 现认为AdipoR为提高胰岛素敏感性的重要靶位[19-21]. 本文对NASH发病过程中脂联素和AdipoR2在大鼠肝脏中的分泌趋势和表达进行研究, 探讨其在NASH发病过程中的作用.
清洁级SD大鼠52只, ♂, 体质量120-140 g, 由中国科学院上海实验动物中心提供. 大鼠饲养于仁济医院动物房, 保持恒温于20 ℃-22 ℃, 12 h光照和黑夜循环, 水和食物均为随意摄取. TRIzol试剂: Invitrogen公司产品. M-MLV逆转录酶试剂盒: Promega公司产品. Rnase Inhibitor ToYoBo公司产品. Taq DNA Polymerase试剂盒: TaKaRa公司产品. 随机引物Oligo-DT: 上海生工公司合成. PCR引物(P1, P2): 上海生工公司、赛百盛公司合成. 异丙醇、氯仿均为分析纯, 上海维峰化工有限公司产品. Marker赛百盛、天为时代公司产品. Goldview核酸染料: 北京赛百盛生物技术公司产品.
1.2.1 分组: 大鼠普通饲料喂养1 wk后随机分为2组. 第1组(对照组, n = 20)喂养胆碱添加饮食(CS), 分别在第3、5、8、12周随机选择5只处死. 第2组(NASH模型组, n = 32)用蛋氨酸胆碱缺乏饮食(MCD)喂养的NASH模型组, 分别在第3、5、8、12周随机选择8只处死. MCD及CS自行配制.
1.2.2 一般情况观察: 大鼠编号后每周称1次体质量, 每2 wk连续3 d称进食质量. 处死前称体质量, 观察食欲行为、状态、毛发. 处死前大鼠隔夜禁食, 第2天称体质量, 麻醉后固定, 腹部皮肤消毒后切开, 推开内脏后从下腔静脉取血, 迅速切下肝脏, 称湿质量. 肝脏迅速置于液氮中冻存.
1.2.3 NAFLD活动度积分评估: NASH的病理诊断标准采用亚太地区非酒精性脂肪性肝病诊断与治疗共识所推荐的美国国立卫生研究院NASH临床研究网络病理委员会2005年所定指南[22], 根据其制定的NAFLD活动度积分(NAFLD activity score, NAS)进行评估.
1.2.4 RT-PCR抽提: 称取冻干肝脏组织100 mg加TRIzol液后, 按照顺序加入氯仿和异丙醇抽提总RNA. 随机引物Oligo-DT 1 µL和总RNA 2 µg进行RT反应, 扩增cDNA. 比色后取cDNA 1 µg加引物后作PCR反应扩增, 扩增后的mRNA在含goldview显色剂的20 g/L的琼脂糖胶上作电泳. 在FR-200紫外与可见分析装置上拍照, 以SmartView 2000生物电泳图像分析软件(上海复日科技有限公司产品)获取图像, 使用Image J图像分析软件对条带密度进行A定量分析, 对条带密度进行定量分析. 与标准化的β-actin条带A定量值作对比后测定其表达. 引物具体见表1.
| 目的基因 | 引物序列 | 编号 | 大小(bp) | 反应条件 |
| Actin | cccatctatgagggttacgcg | BC063166 | 510 | 94 ℃(5 min)-94 ℃(30 s)- |
| ctggaaggtggacagtgaggc | 62 ℃(30 s)-72 ℃(30 s)- | |||
| 72 ℃(10 min) 32循环 | ||||
| 脂联素 | aggatccatgctactgttgcaagcgctc | NM_144744 | 750 | 94 ℃(5 min)-94 ℃(45 s)- |
| gaagcttgttggtatcatggtagagaagg | 55 ℃(45 s)-68 ℃(45 s)- | |||
| 68 ℃(7 min) 35循环 | ||||
| AdipoR2 | acaaccaccacggagattt | DQ148392 | 456 | 94 ℃(5 min)-94 ℃(45 s)- |
| agaacaacccgaagaccac | 61 ℃(45 s)-72 ℃(45 s)- | |||
| 72 ℃(10 min) 35循环 |
统计学处理 计数资料用mean±SD表示, 两组之间的比较用独立t检验, 多组之间比较用单因素方差分析, 统计学显著性用双侧检验P<0.05检测. 使用SPSS11.5软件包进行统计学分析.
各组大鼠均无死亡, 食欲、习性、毛发均无差异.
对照组大鼠肝脏外观和组织学无异常表现. NASH模型组大鼠随着时间发展逐渐出现脂肪浸润, 并逐渐出现脂肪性肝炎的表现, 到第12周有纤维化表现. NASH模型组根据NAS评分标准, 符合NASH的诊断标准.
在对照组大鼠中, 随着时间的延长, 脂联素、AdipoR2的表达无明显变化(P>0.05). 而在NASH组大鼠中, 可以发现随着时间的延长, 肝脏炎症逐渐加重, 肝脏脂联素和AdipoR2 mRNA表达逐渐减少(图1). 3、5、8 wk脂联素和AdipoR2的表达均逐渐显著下降, 大多有极显著差异(P<0.01); 到12 wk发生肝脏纤维化, AdipoR2表达较第8周显著减少(P<0.01), 脂联素表达下降与第8周水平呈现临界性差异(P = 0.073, 表2, 图2). 表达的趋势见图1, 在NASH组中随着炎症和纤维化的发展, 脂联素和AdipoR2呈现逐渐下降趋势.
脂肪细胞因子脂联素主要来源于脂肪细胞[25], 后发现骨髓[26]、胎儿组织[27]、心肌细胞[28]和肝脏内皮细胞[29-30]也能分泌脂联素. 脂联素在血清中浓度很高(3-30 mg/L), 占总血清蛋白浓度的0.01%, 可以通过激活协调代谢和能量平衡的腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)来促进β氧化并通过减少循环脂肪酸和肝脏肌肉中甘油三酯水平等几个方面来直接增加胰岛素敏感性[25]. 脂联素基因敲除小鼠表现出胰岛素抵抗和糖尿病也证实了脂联素的胰岛素增敏作用. 由于脂联素和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)结构相似, 体内外的实验均表明TNF-α和脂联素能相互抑制对方的产生并在对方的靶组织内拮抗对方的作用, 因此脂联素通过拮抗TNF-α对胰岛素通路信号传导途径的干扰, 增加胰岛素敏感性, 同时还可以拮抗TNF-α诱导的核因子-κB(nuclear factor-κB, NF-κB)途径[31], 起到抗炎症作用, 从两个方面减轻/阻断对肝脏的打击. 近来, 有研究提示脂联素在大脑中也能发挥作用, 增加能量的消耗, 使体质量下降[46], 减轻NASH的发生和发展.
我们主要观察在NASH发病过程中, 肝脏中脂联素的表达. 在本实验中可以发现, CS饮食大鼠的肝脏无脂肪浸润和炎症发生[23], 脂联素和AdipoR2的表达随时间延长无显著改变. 而在MCD饮食组中, 随着时间的延长, 肝脏的脂肪浸润越来越明显, 并逐渐出现肝细胞气球样变和嗜酸小体等, 逐渐形成了NASH, 纤维化亦逐渐加重. 而在此过程中, 肝脏内的脂联素和AdipoR2的表达也逐渐减少. 肝脏脂联素减少和既往报道的血中脂联素的表达逐渐减少是相似的.
肝脏中脂联素主要由肝脏内皮细胞分泌[29], 脂肪细胞分泌的脂肪细胞因子包括脂联素亦可少量通过门静脉进入肝脏发挥作用. 肝内皮细胞层呈筛孔状结构(即肝筛), 在调节肝窦血流与周围组织的物质交换中起中枢性的作用, 同时还有清除变性大分子脂质、向T淋巴细胞递呈抗原的功能, 并在维持肝细胞的代谢及氧供中起着重要作用. 因此在肝脏的脂肪变和炎症过程中, 由于损伤因子导致了肝脏内皮细胞功能的下降, 导致了其在维持代谢、清除脂质、分泌脂联素等的功能下降, 之前有研究表明肝内皮细胞损伤可导致脂肪肝、肝纤维化和肝硬化. 脂联素作为重要的抗炎症介质, 受到肝脏内皮细胞损伤影响, 分泌减少, 进一步加重了肝脏损伤, 形成了恶性循环. 提示肝脏内皮细胞在NASH的发展过程中起重要作用. 因此进一步探讨肝脏内皮细胞和脂联素在NASH发病过程中的具体机制应该是值得关注的.
有研究发现, 在CCl4诱导的肝脏纤维化小鼠中, 在肝细胞外基质存在大量的脂联素积聚和黏附, 这提示脂联素拮抗TNF-α抗炎症作用同时, 可能直接作为一种抗炎症因子参与由CCl4引起肝脏损伤的修复过程[32], 具有直接抗炎症作用. NASH患者中常常存在小肠细菌的过度生长[33], 可产生内毒素, 作为细菌内毒素主要成分的脂多糖参与NASH的发病[34-35]; 最近发现在由脂多糖诱导的急性肝炎小鼠模型中, 脂联素可以通过诱导Kupffer细胞中的抗炎症细胞因子IL-10的表达来抑制脂多糖的作用而减轻肝脏损伤[36]. 近来还有研究通过测定尿中8-异前列腺素F-2α这一反应氧应激(ROS)的指标, 发现当发生低脂联素血症时, 系统氧应激显著升高, 表明脂联素可以抑制氧应激[37-38].
以上证据均表明脂联素可以减轻包括促炎症细胞因子、炎症内毒素、氧应激等多种可导致肝脏损伤的第2次打击作用因子, 我们的实验表明, 肝脏中脂联素表达与外周血中存在的低脂联素血症可能是相互平行的, 而肝脏中的脂联素减少可能在NASH发病过程中起到更重要的作用.
我们的实验同时提示肝脏在向纤维化发展过程中肝内脂联素表达也显著减少. 关于脂联素在肝脏纤维化发展中的作用, 有研究表明脂联素可以减轻由CCl4诱导的肝脏纤维化[32], 现又发现脂联素通过抑制肝星状细胞(hepatic stellate cells, HSCs)中转录因子Smad2的核内迁移来抑制其增殖和活化[39], 同时可以诱导活化HSCs的凋亡, 由于肝星状细胞在肝脏纤维化中起核心作用, 加上脂联素还可以减弱由于转化生长因子β1(transforming growth factor-β1, TGF-β1)对于纤维生成基因的作用[39]. 因此提示脂联素在肝脏纤维化时, 有很强的减轻肝脏纤维化作用. 有临床研究表明, 肝脏纤维化分级和低脂联素血症有密切相关[40]. 也表明脂联素在NASH的进一步发展为肝纤维化时起到保护作用. 流行病学研究表明肝硬化在肥胖人群中的发病率是一般人群中的发病率的6倍, 而且肥胖伴低脂联素血症是包括NASH、酒精性肝病、慢性丙型肝炎等慢性肝病患者发生肝纤维化的独立危险因素[10-11]. 因此人群中脂联素的下降应该在肝脏纤维化和肝硬化的发病过程中起到重要作用. 我们的研究表明不仅在血液中, 在肝脏中同样随着纤维化的发展, 脂联素表达也是显著下降的, 提示其保护作用逐渐减弱.
关于脂联素受体, 现认为脂联素对脂肪细胞的反馈调节作用至少有部分是通过AdipoR来进行的[21], 我们选择了主要在肝脏中表达的AdipoR2进行研究. 有研究表明在肝细胞和肌细胞中, 胰岛素可以通过磷脂酰肌醇3-激酶/叉头(PI3K/FOXO)依赖途径减少AdipoR2的表达[24,41], 因此当发生胰岛素抵抗时, 过多的胰岛素可导致AdipoR2的减少, 这导致了其介导的脂联素作用的下降. 本实验发现随着NASH的发展, 肝脏中AdipoR2的表达和脂联素一样也是逐渐下降的, 在进一步向肝脏纤维化发展时, AdipoR2的表达同样也是逐渐下降的, 这可能和NASH发病过程中逐渐加重的全身和/或局部胰岛素抵抗有关. 有研究显示[10]脂联素主要位于人肝脏门静脉和肝窦的内皮细胞, 而AdipoR2则主要位于肝细胞胞质内, 脂联素和AdipoR2的分布位置的不同, 提示有可能存在旁分泌途径来起作用. 当发生NASH时, 此种途径可能遭到了破坏, 阻断了脂联素的作用而导致NASH的发展. 分布位置的不同, 也可以推断AdipoR2在介导脂联素的作用时候, 可能也存在着直接的肝脏保护作用. 我们的研究证实以上的推论. 但是具体的机制尚需进一步研究.
在本实验中, 我们发现在MCD饮食的NASH模型中, 脂联素和AdipoR2的表达是下降的, 随着他们表达的减少, 肝脏的炎症和纤维化进一步加重, 提示AdipoR2可能存在直接的肝脏保护作用. 对于脂联素和AdipoR2的进一步研究可以进一步加深对于NASH发病机制的了解, 可能为治疗提供新的靶点.
NASH是进展性疾病, 可以发展为肝硬化、肝功能衰竭和肝癌, 与全球的肥胖化趋势同步, NASH的发病率逐渐升高, 对于NASH机制和防治的研究成为近年来的热点. 脂肪细胞因子在NASH发病机制中的作用是目前的热点之一.
迟宝荣, 教授, 吉林大学第一医院消化内科
对于NASH的发病机制, 目前尚不完全清楚, 脂肪细胞因子参与的二次打击学说目前还比较流行, 对于抗炎症细胞因子脂联素和其受体的在NASH发病机制中的作用是目前较受关注的.
有研究发现, 在CCl4诱导的肝脏纤维化小鼠中, 在肝细胞外基质存在大量的脂联素积聚和黏附, 这提示脂联素拮抗TNF-α抗炎症作用同时, 可能直接作为一种抗炎症因子参与由CCl4引起肝脏损伤的修复过程, 具有直接抗炎症作用.
本文对NASH发病过程中脂联素和AdipoR2在大鼠肝脏中的分泌趋势和表达进行研究, 发现在MCD饮食的NASH模型中, 肝脏中脂联素和AdipoR2的表达下降, 随着他们表达的减少, 肝脏的炎症和纤维化进一步加重, 提示AdipoR2可能存在直接的肝脏保护作用.
本研究选题新颖, 设计合理, 结果可靠, 具有一定的研究价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 2. | Mulhall BP, Ong JP, Younossi ZM. Non-alcoholic fatty liver disease: an overview. J Gastroenterol Hepatol. 2002;17:1136-1143. [PubMed] [DOI] |
| 3. | Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980;55:434-438. [PubMed] |
| 4. | Matteoni CA, Younossi ZM, Gramlich T, Boparai N, Liu YC, McCullough AJ. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology. 1999;116:1413-1419. [PubMed] [DOI] |
| 5. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 6. | McCullough AJ. Update on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2002;34:255-262. [PubMed] [DOI] |
| 7. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 8. | Varela-Rey M, Embade N, Ariz U, Lu SC, Mato JM, Martínez-Chantar ML. Non-alcoholic steatohepatitis and animal models: understanding the human disease. Int J Biochem Cell Biol. 2009;41:969-976. [PubMed] [DOI] |
| 9. | Crespo J, Cayón A, Fernández-Gil P, Hernández-Guerra M, Mayorga M, Domínguez-Díez A, Fernández-Escalante JC, Pons-Romero F. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients. Hepatology. 2001;34:1158-1163. [PubMed] [DOI] |
| 10. | Yalniz M, Bahcecioglu IH, Ataseven H, Ustundag B, Ilhan F, Poyrazoglu OK, Erensoy A. Serum adipokine and ghrelin levels in nonalcoholic steatohepatitis. Mediators Inflamm. 2006;2006:34295. [PubMed] |
| 11. | Chitturi S, Farrell G, Frost L, Kriketos A, Lin R, Fung C, Liddle C, Samarasinghe D, George J. Serum leptin in NASH correlates with hepatic steatosis but not fibrosis: a manifestation of lipotoxicity? Hepatology. 2002;36:403-409. [PubMed] [DOI] |
| 12. | Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem. 1995;270:26746-26749. [PubMed] [DOI] |
| 13. | Arita Y, Kihara S, Ouchi N, Takahashi M, Maeda K, Miyagawa J, Hotta K, Shimomura I, Nakamura T, Miyaoka K. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. Biochem Biophys Res Commun. 1999;257:79-83. [PubMed] [DOI] |
| 14. | Hotta K, Funahashi T, Arita Y, Takahashi M, Matsuda M, Okamoto Y, Iwahashi H, Kuriyama H, Ouchi N, Maeda K. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients. Arterioscler Thromb Vasc Biol. 2000;20:1595-1599. [PubMed] |
| 15. | Ouchi N, Ohishi M, Kihara S, Funahashi T, Nakamura T, Nagaretani H, Kumada M, Ohashi K, Okamoto Y, Nishizawa H. Association of hypoadiponectinemia with impaired vasoreactivity. Hypertension. 2003;42:231-234. [PubMed] [DOI] |
| 16. | Ouchi N, Kihara S, Arita Y, Maeda K, Kuriyama H, Okamoto Y, Hotta K, Nishida M, Takahashi M, Nakamura T. Novel modulator for endothelial adhesion molecules: adipocyte-derived plasma protein adiponectin. Circulation. 1999;100:2473-2476. [PubMed] |
| 17. | Hui JM, Hodge A, Farrell GC, Kench JG, Kriketos A, George J. Beyond insulin resistance in NASH: TNF-alpha or adiponectin? Hepatology. 2004;40:46-54. [PubMed] [DOI] |
| 18. | Hu E, Liang P, Spiegelman BM. AdipoQ is a novel adipose-specific gene dysregulated in obesity. J Biol Chem. 1996;271:10697-10703. [PubMed] [DOI] |
| 19. | Civitarese AE, Jenkinson CP, Richardson D, Bajaj M, Cusi K, Kashyap S, Berria R, Belfort R, DeFronzo RA, Mandarino LJ. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of Type 2 diabetes. Diabetologia. 2004;47:816-820. [PubMed] [DOI] |
| 20. | Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature. 2003;423:762-769. [PubMed] [DOI] |
| 21. | English PJ, Coughlin SR, Hayden K, Malik IA, Wilding JP. Plasma adiponectin increases postprandially in obese, but not in lean, subjects. Obes Res. 2003;11:839-844. [PubMed] [DOI] |
| 22. | Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41:1313-1321. [PubMed] [DOI] |
| 23. | 钱 晓武, 范 竹萍, 汪 晓红, 盛 黎, 奚 志峰, 邱 德凯. 建立改良蛋氨酸胆碱缺乏饮食喂养的非酒精性脂肪性肝炎大鼠模型. 世界华人消化杂志. 2007;15:2983-2989. [DOI] |
| 24. | Tsuchida A, Yamauchi T, Ito Y, Hada Y, Maki T, Takekawa S, Kamon J, Kobayashi M, Suzuki R, Hara K. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity. J Biol Chem. 2004;279:30817-30822. [PubMed] [DOI] |
| 25. | Maeda K, Okubo K, Shimomura I, Funahashi T, Matsuzawa Y, Matsubara K. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (AdiPose Most abundant Gene transcript 1). Biochem Biophys Res Commun. 1996;221:286-289. [PubMed] [DOI] |
| 26. | Yokota T, Meka CS, Medina KL, Igarashi H, Comp PC, Takahashi M, Nishida M, Oritani K, Miyagawa J, Funahashi T. Paracrine regulation of fat cell formation in bone marrow cultures via adiponectin and prostaglandins. J Clin Invest. 2002;109:1303-1310. [PubMed] |
| 27. | Corbetta S, Bulfamante G, Cortelazzi D, Barresi V, Cetin I, Mantovani G, Bondioni S, Beck-Peccoz P, Spada A. Adiponectin expression in human fetal tissues during mid- and late gestation. J Clin Endocrinol Metab. 2005;90:2397-2402. [PubMed] [DOI] |
| 28. | Piñeiro R, Iglesias MJ, Gallego R, Raghay K, Eiras S, Rubio J, Diéguez C, Gualillo O, González-Juanatey JR, Lago F. Adiponectin is synthesized and secreted by human and murine cardiomyocytes. FEBS Lett. 2005;579:5163-5169. [PubMed] [DOI] |
| 29. | Wolf AM, Wolf D, Avila MA, Moschen AR, Berasain C, Enrich B, Rumpold H, Tilg H. Up-regulation of the anti-inflammatory adipokine adiponectin in acute liver failure in mice. J Hepatol. 2006;44:537-543. [PubMed] [DOI] |
| 30. | Jonsson JR, Moschen AR, Hickman IJ, Richardson MM, Kaser S, Clouston AD, Powell EE, Tilg H. Adiponectin and its receptors in patients with chronic hepatitis C. J Hepatol. 2005;43:929-936. [PubMed] [DOI] |
| 31. | Ouchi N, Kihara S, Arita Y, Okamoto Y, Maeda K, Kuriyama H, Hotta K, Nishida M, Takahashi M, Muraguchi M. Adiponectin, an adipocyte-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway. Circulation. 2000;102:1296-1301. [PubMed] |
| 32. | Yoda-Murakami M, Taniguchi M, Takahashi K, Kawamata S, Saito K, Choi-Miura NH, Tomita M. Change in expression of GBP28/adiponectin in carbon tetrachloride-administrated mouse liver. Biochem Biophys Res Commun. 2001;285:372-377. [PubMed] [DOI] |
| 33. | Wigg AJ, Roberts-Thomson IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut. 2001;48:206-211. [PubMed] [DOI] |
| 34. | Li Z, Yang S, Lin H, Huang J, Watkins PA, Moser AB, Desimone C, Song XY, Diehl AM. Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease. Hepatology. 2003;37:343-350. [PubMed] [DOI] |
| 35. | Yang SQ, Lin HZ, Lane MD, Clemens M, Diehl AM. Obesity increases sensitivity to endotoxin liver injury: implications for the pathogenesis of steatohepatitis. Proc Natl Acad Sci USA. 1997;94:2557-2562. [PubMed] [DOI] |
| 36. | Matsumoto H, Tamura S, Kamada Y, Kiso S, Fukushima J, Wada A, Maeda N, Kihara S, Funahashi T, Matsuzawa Y. Adiponectin deficiency exacerbates lipopolysaccharide/D-galactosamine-induced liver injury in mice. World J Gastroenterol. 2006;12:3352-3358. [PubMed] |
| 37. | Motoshima H, Wu X, Mahadev K, Goldstein BJ. Adiponectin suppresses proliferation and superoxide generation and enhances eNOS activity in endothelial cells treated with oxidized LDL. Biochem Biophys Res Commun. 2004;315:264-271. [PubMed] [DOI] |
| 38. | Neumeier M, Weigert J, Schäffler A, Weiss TS, Schmidl C, Büttner R, Bollheimer C, Aslanidis C, Schölmerich J, Buechler C. Aldehyde oxidase 1 is highly abundant in hepatic steatosis and is downregulated by adiponectin and fenofibric acid in hepatocytes in vitro. Biochem Biophys Res Commun. 2006;350:731-735. [PubMed] [DOI] |
| 39. | Ding X, Saxena NK, Lin S, Xu A, Srinivasan S, Anania FA. The roles of leptin and adiponectin: a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol. 2005;166:1655-1669. [PubMed] |
| 40. | Musso G, Gambino R, Biroli G, Carello M, Fagà E, Pacini G, De Michieli F, Cassader M, Durazzo M, Rizzetto M. Hypoadiponectinemia predicts the severity of hepatic fibrosis and pancreatic Beta-cell dysfunction in nondiabetic nonobese patients with nonalcoholic steatohepatitis. Am J Gastroenterol. 2005;100:2438-2446. [PubMed] [DOI] |
| 41. | Shimizu A, Takamura T, Matsuzawa N, Nakamura S, Nabemoto S, Takeshita Y, Misu H, Kurita S, Sakurai M, Yokoyama M. Regulation of adiponectin receptor expression in human liver and a hepatocyte cell line. Metabolism. 2007;56:1478-1485. [PubMed] [DOI] |