修回日期: 2009-06-13
接受日期: 2009-06-15
在线出版日期: 2009-07-08
目的: 观察胃黏膜细胞c-Jun氨基末端激酶(JNK)在室旁核(PVN)内微量注射催产素(OT)对大鼠胃缺血-再灌注(GI-R)损伤调控中的作用及机制.
方法: 将SD大鼠随机分为4组: vehicle组, OT组, OT+atosiban组, atosiban组. 采用夹闭大鼠腹腔动脉30 min, 去除动脉夹再灌注1 h的GI-R损伤模型, 于单侧PVN微量注射OT. 运用免疫组织化学及免疫印迹等实验技术, 观察了PVN微量注射OT对GI-R后胃黏膜细胞p-JNK、Bax和Bcl-2蛋白表达的影响.
结果: 与vehicle组相比, PVN内微量注射OT(600 ng)能明显减少GI-R后胃黏膜细胞p-JNK及Bax的表达(均P<0.01), 增加Bcl-2的表达(P<0.01). 侧脑室给予OT受体特异性拮抗剂atosiban后, 可取消OT的效应, 与OT组比较, 差异有统计学意义(F = 56.33, P<0.01; F = 145.2, P<0.01, F = 49.32, P<0.01), 胃黏膜细胞p-JNK及Bax的表达较OT组明显增加, 而Bcl-2的表达减少.
结论: PVN微量注射OT减轻GI-R损伤的调控机制, 在胃黏膜局部是通过抑制胃黏膜细胞p-JNK和Bax的表达, 促进Bcl-2的表达实现的.
引文著录: 张咏梅, 张文文, 张建福. JNK在室旁核内微量注射催产素对大鼠胃缺血-再灌注调控中的作用. 世界华人消化杂志 2009; 17(19): 1919-1924
Revised: June 13, 2009
Accepted: June 15, 2009
Published online: July 8, 2009
AIM: To investigate the molecular mechanism underlying the role of JNK in mediating the effects of oxytocin (OT) microinjected into the paraventricular nucleus (PVN) on gastric ischemia-reperfusion (GI-R) injury.
METHODS: Sprague-Dawley (SD) rats were randomly divided into four groups: vehicle group, OT group, atosiban group and OT plus atosiban group. GI-R injury was induced in rats by clamping the celiac artery for 30 min and then reperfusing for 1 h. A cannula was inserted into the unilateral PVN for microinjection of OT. The expression of p-JNK, Bax and Bcl-2 proteins in rat gastric mucosa was examined by Western blot and immunohistochemistry.
RESULTS: Compared with the vehicle group, microinjection of OT (600 ng) into PVN significantly decreased the expression of p-JNK and Bax proteins but increased the expression of Bcl-2 protein in gastric mucosa following GI-R (all P < 0.01). Pre-administration of atosiban (an OT receptor antagonist) into the lateral cerebral ventricle could prevent the effects of OT (F = 56.33, P < 0.01; F = 145.2, P < 0.01, F = 49.32, P < 0.01), increase the expression of p-JNK and Bax proteins, and decrease the expression of Bcl-2 protein when compared with the OT group.
CONCLUSION: Microinjection of OT into PVN attenuates GI-R injury through down-regulation of p-JNK protein, which in turn leads to a decrease in Bax expression and an increase in Bcl-2 expression.
- Citation: Zhang YM, Zhang WW, Zhang JF. JNK mediates the effects of oxytocin microinjected into the paraventricular nucleus on gastric ischemia-reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(19): 1919-1924
- URL: https://www.wjgnet.com/1009-3079/full/v17/i19/1919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i19.1919
催产素(oxytocin, OT)主要是在下丘脑室旁核(paraventricular nucleus, PVN)和视上核的大细胞神经元中合成的, 与机体的氧化应激反应密切相关. 在下丘脑PVN大细胞区内有丰富的OT能神经元胞体, 并分布有较高密度的OT受体[1-4], 刺激PVN及PVN内微量注射OT能够减少胃酸分泌, 减轻胃溃疡[5]. 我们以前的研究发现电刺激PVN可减轻胃缺血-再灌注(gastric ischemia-reperfusion, GI-R)损伤[6-7], 并进一步发现PVN内微量注射OT可剂量依赖性减轻GI-R损伤[8], 那么, OT减轻GI-R损伤的局部分子机制是什么?近年来, 在研究缺血器官的细胞凋亡及增殖修复的细胞信号转导通路中, 丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号转导通路备受关注. MAPKs是一类丝氨酸/苏氨酸蛋白激酶, 是公认的与细胞增殖分化凋亡调控密切相关的细胞内信号转导酶类[9-10], 其中, c-Jun氨基末端激酶(c-Jun N-terminal protein kinase, JNKs)通路是MAPK中重要的通路之一, 是细胞应激反应诱导细胞凋亡的主要信号转导途径. JNK通路被激活后, 伴有活化蛋白1(activator protein-1, AP-1)与cAMP反应元件结合蛋白(cAMP response element binding protein, CREB)调控凋亡相关基因家族成员的差异性表达, 如Bad、Bax的表达上调与Bcl-2、Bcl-xL的表达下调[11-13]. 近来研究表明心肌、肾脏和脑等重要脏器缺血或缺血-再灌注均可引起p-JNK的活化[14-16], 我们的研究也表明GI-R后30 min、1、3和6 h均可促进p-JNK在胃黏膜的表达, 电刺激PVN后, 通过抑制胃黏膜p-JNK的表达, 从而减轻GI-R损伤[17]. 但有关JNK是否参与了OT对GI-R的调控作用尚未见报道, 因此, 本文通过建立GI-R模型, 应用核团微量注射、免疫组织化学、免疫印迹等方法, 探讨了p-JNK在PVN内微量注射OT对GI-R损伤调控中的作用及其机制.
成年健康的Sprague-Dawley(SD)大鼠(220-240 g), 雌雄不拘, 由徐州医学院实验动物中心(使用许可号: SYXK[su]2002-0038)提供. OT购自上海第一生化药业有限公司; atosiban购自深圳翰宇生物工程有限公司. P-JNK小鼠mAb以及Bax、Bcl-2兔多克隆抗体、PowerVisionTM二步法免疫组织化学检测系统、DAB显色试剂盒、枸橼酸盐缓冲盐溶液、碱性磷酸酶标记的羊抗兔IgG和羊抗鼠IgG、多聚赖氨酸溶液购自北京中杉生物技术有限公司; 碱磷酶底物NBT/BCIP显色浓缩液购自美国Promega Technology. 其他试剂均为市售化学纯.
1.2.1 分组: 实验前禁食24 h, 自由饮水. 将SD大鼠随机分为4组, 每组6只: PVN内微量注射生理盐水0.3 μL后进行GI-R组(vehicle组), PVN内微量注射OT 600 ng/0.3 μL后进行GI-R组(OT组), 侧脑室内微量注射atosiban 1.2 μg/5 μL后再进行PVN内微量注射OT 600 ng/0.3 μL, 然后制备GI-R组(OT+atosiban组), 侧脑室内微量注射atosiban 1.2 μg/5 μL后进行GI-R组(atosiban组).
1.2.2 PVN或侧脑室微量注射: 动物在麻醉下(10%水合氯醛400 mg/kg ip)固定于脑立体定位仪上, 按照Paxinos和Watson脑图谱[18]及我们以前的方法[3]定位PVN(坐标: AP 1.5 mm, R 0.4 mm, H 7.7-7.8 mm, 门齿瓣低于耳间连线3.3 mm)和侧脑室(坐标: AP 1.0 mm, L 1.5 mm, H 4.5 mm.), 在2 min内将OT 600 ng/0.3 μL微量注射到PVN或将atosiban 1.2 μg/5 μL注射到侧脑室. vehicle组注射等体积的生理盐水.
1.2.3 GI-R动物模型的制备: 按Wada et al[19]方法进行. 实验大鼠水合氯醛麻醉后, 仔细分离腹腔动脉与周围组织, 用小动脉夹夹闭腹腔动脉30 min后去除动脉夹恢复血流再灌注60 min. 实验结束后取胃计数胃黏膜损伤指数, 测量完损伤指数后将胃组织在10%中性甲醛溶液内固定, 石蜡包埋切片后用于免疫组织化学染色.
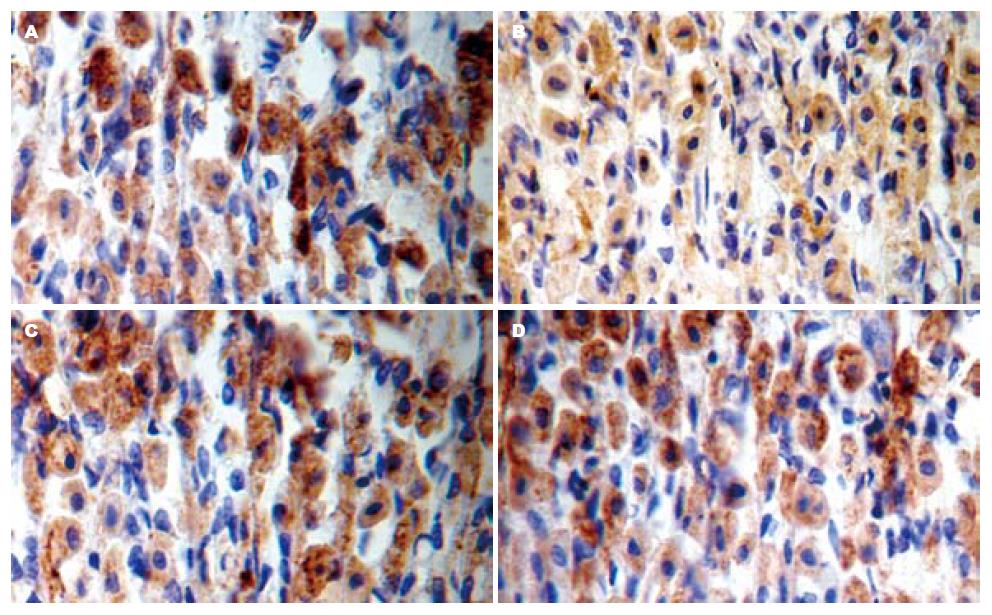
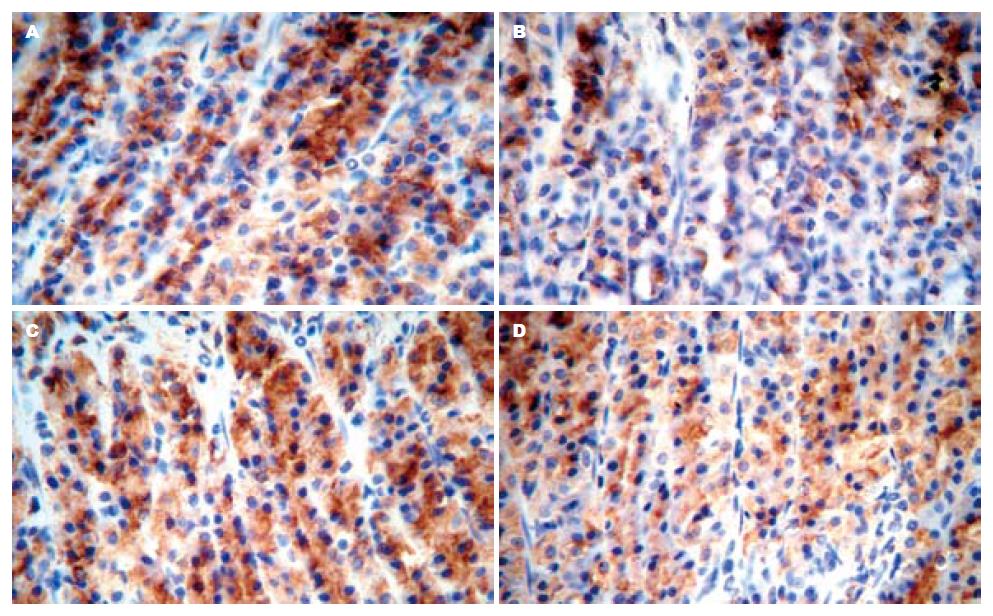
1.2.4 免疫组织化学染色法: 按照北京中杉生物技术有限公司提供的PowerVisionTM二步法免疫组织化学检测系统进行. DAB显色, 苏木精复染, 梯度乙醇脱水, 中性树胶封片. 光镜下观察到胞质内有棕色颗粒者即为阳性细胞. 用Image-Pro Plus图像分析系统对阳性细胞数进行半定量分析. 以高倍视野下累积吸光度(IA)作为分析指标. 对照实验以PBS缓冲液代替一抗. 每例3张间断切片, 每张切片随机选取10个视野, 取平均值.
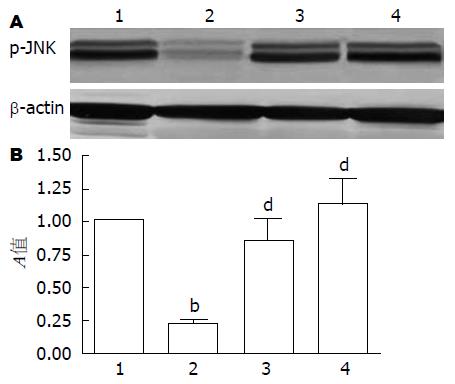
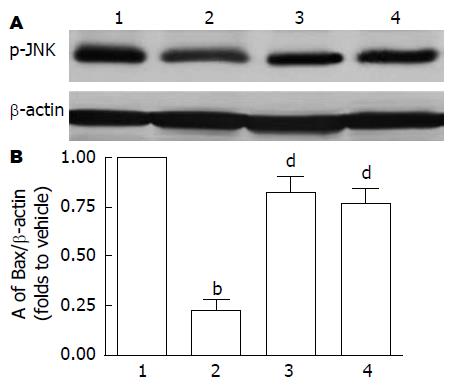
1.2.5 蛋白免疫印迹法测定p-JNK、Bax蛋白表达量: 将已制备的细胞蛋白提取液测其蛋白浓度后, 经100 ℃水浴变性5 min, 按每孔30 μL蛋白上样, 经10% SDS-PAGE分离后, 以湿转移法转至NC膜上, 室温封闭3 h, 加入一抗(p-JNK 1:200、Bax 1:800), 4 ℃过夜, 洗膜后加入相应的碱性磷酸酶标记的二抗, 室温孵育2 h, 洗膜后加入显色剂(NBT/BCIP显色试剂盒), 反应达到要求后流水洗涤终止反应. 条带经图像处理仪行激光扫描后测各条带吸光度(A), 以相应区带的A值相对于对照组的倍数表示.
统计学处理 采用SPSS9.0 for Windows统计软件包, 数据以mean±SD表示, 多组间比较采用完全随机设计方差分析法(One-way ANOVA). P<0.05或P<0.01分别表示两组数据间有显著性差异或有非常显著性差异.
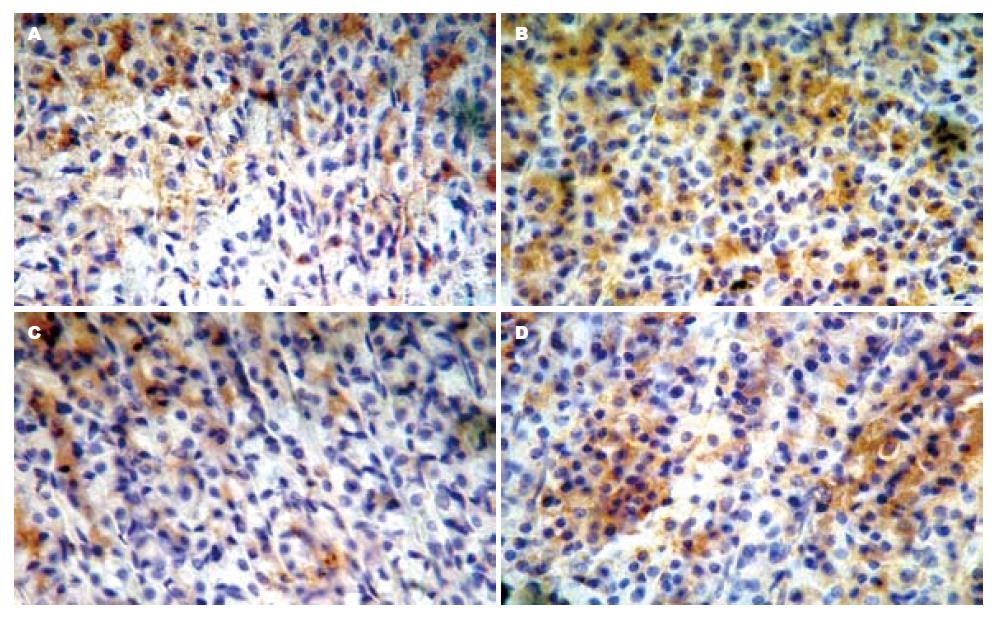
p-JNK阳性细胞主要表达在胃黏膜上层细胞胞质中, PVN微量注射OT(600 ng)可明显减少GI-R 1 h(vehicle组)后p-JNK蛋白的表达水平(P<0.01), 而atosiban可取消OT的这种效应, 与vehicle组无明显差异(F = 56.33, 图1-2).
Bax阳性细胞主要表达在胃黏膜中下层胃底腺细胞胞质中, 在黏膜上皮细胞中表达不明显. GI-R 1 h(vehicle组)后胃黏膜Bax蛋白水平较高, PVN微量注射OT(600 ng)后, Bax蛋白水平较vehicle组明显减少(P<0.01), 而atosiban可阻断OT的这种效应(F = 145.2, P<0.01, 图3-4).
大鼠胃黏膜Bcl-2阳性细胞主要表达在胃黏膜中下层胃底腺细胞胞质中, 在黏膜上皮细胞中表达不明显. GI-R 1 h后(vehicle组)胃黏膜Bcl-2蛋白水平较低, PVN微量注射OT(600 ng, OT组)后, Bcl-2蛋白水平较vehicle组明显升高(P<0.01), 而atosiban可阻断OT的这种效应(F = 49.32, P<0.01, 图5).
我们最近的研究已经发现GI-R 1 h可引起胃黏膜片状、条索状、点状的出血性损伤, 单侧微量注射OT到PVN后, 能明显减轻GI-R损伤, 并且有剂量依赖性. 将OT受体拮抗剂atosiban侧脑室注射后, 可阻断OT对GI-R损伤的保护效应, 胃黏膜损伤明显加重, 表明OT对GI-R损伤的保护作用, 是通过PVN内的OT受体实现的[8]. 但参与这种保护效应的局部因素尚不清楚.
本研究发现PVN内微量注射OT能够明显减少p-JNK在胃黏膜细胞中的表达, 并降低Bax的蛋白水平, 增加Bcl-2的蛋白表达. 脑室内注射OT受体拮抗剂atosiban可取消这些效应. 表明PVN内微量注射OT后, 在胃黏膜局部通过抑制黏膜细胞JNKs信号通路的激活, 从而对GI-R损伤产生保护作用.
GI-R导致的胃黏膜细胞损伤实际上是一种氧化应激反应, 在缺血-缺氧、氧自由基、肿瘤坏死因子-α等胞外刺激信号的作用下, 可激活MAPKs信号蛋白通路. 在哺乳动物细胞内已明确了5条MAPK信号转导通路, 分别为细胞外信号调节激酶(ERK1/ERK2, 也称为p44/42 MAPK)、c-Jun氨基末端激酶(JNK1/JNK2)、p38 MAPK(α、β)、ERK5/BMK1和ERK3/4通路. 在多种脏器如心、脑、肾等缺血-再灌注后均可激活JNK信号转导通路[11,14-15]. Zhou et al[20]发现氧化应激引起小肠上皮细胞凋亡时JNK1/2表达迅速增加, 抑制JNK信号通路的激活可减轻H2O2诱导的细胞凋亡. Mitsuyama et al[21]发现酒精引起胃黏膜损伤形成过程中, JNK可被快速激活后高水平表达, 我们前期的研究也证实p-JNK的激活参与缺血-再灌注后胃黏膜细胞的损伤, 是重要的致损伤因素之一[17]. 在本研究中进一步发现PVN微量注射OT能通过抑制GI-R胃黏膜细胞p-JNK的激活, 从而减轻GI-R损伤.
此外, JNK与细胞凋亡的关系密切, 他参与了多种凋亡相关基因的转录调控. 与细胞凋亡和增殖有关的基因中, Bcl-2和Bax基因是重要的调节因子[22-27]. 现在发现了一系列与Bcl-2基因相关的基因, 统称为Bcl-2家族, 其基因家族产物包括抗凋亡(Bcl-2、Bcl-x)和促凋亡(Bax、Bad、Bak)2类蛋白. Bcl-2和Bax蛋白水平的高低与凋亡调控直接相关, Bax表达增多占优势时, Bax之间同型二聚体增多, 诱导细胞凋亡发生. Bcl-2表达增多时, 将阻止Bax之间形成同型二聚体, 而形成Bcl-2/Bax二聚体, 使细胞凋亡减少、增殖增加. Bcl-2/Bax蛋白之间的比例, 是决定对细胞凋亡抑制作用强弱的关键因素, Bcl-2和Bax协同调节细胞凋亡, 影响胃黏膜损伤过程[28-30]. 本研究发现, PVN微量注射OT后, 使GI-R的胃黏膜细胞中Bcl-2表达升高, 同时抑制了Bax的表达. 表明PVN微量注射OT通过抑制Bax的表达, 促进Bcl-2的表达, 从而减轻GI-R损伤.
总之, PVN内微量注射OT后, 在胃黏膜局部通过抑制胃黏膜细胞p-JNK的激活, 从而促进Bcl-2的表达, 抑制Bax的表达, 进而促进细胞增殖、抑制细胞凋亡, 发挥对GI-R胃黏膜的保护作用.
OT是下丘脑室旁核、视上核神经元产生的一种最早被阐明一级结构, 并能人工合成的肽类激素. OT参与了维持人体心血管和神经内分泌及体液平衡的调节, 同时又是脑内重要的应激激素之一. PVN既是内脏活动的整合中枢, 又是内分泌系统的调控枢纽, 他具有丰富的传入、传出联系, 与脑干和脊髓侧角有直接的纤维投射. PVN大细胞区内有丰富的OT能神经元胞体, 并分布有较高密度的OT受体.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化内科
机体在出血性休克, 颅脑外伤, 重大手术, 严重感染时均可引起不同程度的胃组织缺血而造成胃黏膜的损伤, 如何减轻GI-R损伤已逐渐引起人们的关注. 然而, 目前对GI-R的研究多集中于胃黏膜局部致损伤因素及其治疗上, 而缺乏整体情况下对其调控机制的研究.
Zhou et al发现氧化应激引起小肠上皮细胞凋亡时JNK1/2表达迅速增加, 抑制JNK信号通路的激活可减轻H2O2诱导的细胞凋亡. Mitsuyama et al发现酒精引起胃黏膜损伤形成过程中, JNK可被快速激活后高水平表达.
本研究首次报道PVN内微量注射OT后, 通过抑制胃黏膜细胞p-JNK的激活, 促进Bcl-2的表达, 抑制Bax的表达, 从而减轻GI-R损伤.
本研究对阐明GI-R损伤的中枢及外周机制具有重要价值, 为临床防治GI-R损伤提供了实验基础和理论依据, 并为临床治疗胃黏膜损伤提供了可能的药物作用靶点.
本研究选题新颖, 设计合理, 结果可靠, 对临床具有一定的指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Gimpl G, Fahrenholz F. The oxytocin receptor system: structure, function, and regulation. Physiol Rev. 2001;81:629-683. [PubMed] |
| 2. | Neumann ID. Brain oxytocin: a key regulator of emotional and social behaviours in both females and males. J Neuroendocrinol. 2008;20:858-865. [PubMed] [DOI] |
| 3. | Herman JP, Flak J, Jankord R. Chronic stress plasticity in the hypothalamic paraventricular nucleus. Prog Brain Res. 2008;170:353-364. [PubMed] [DOI] |
| 4. | Yang Z, Han D, Coote JH. Cardiac sympatho-excitatory action of PVN-spinal oxytocin neurones. Auton Neurosci. 2009;147:80-85. [PubMed] [DOI] |
| 5. | Asad M, Shewade DG, Koumaravelou K, Abraham BK, Vasu S, Ramaswamy S. Effect of centrally administered oxytocin on gastric and duodenal ulcers in rats. Acta Pharmacol Sin. 2001;22:488-492. [PubMed] |
| 6. | Zhang YM, Wei EQ, Li L, Qiao WL, Wang L, Zhang JF. Extracellular signal-regulated kinase pathways may mediate the protective effect of electrical stimulation of the paraventricular nucleus against ischaemia-reperfusion injury of the gastric mucosa. Clin Exp Pharmacol Physiol. 2007;34:742-752. [PubMed] [DOI] |
| 7. | Zhang JF, Zhang YM, Yan CD, Zhou XP. Neuroregulative mechanism of hypothalamic paraventricular nucleus on gastric ischemia-reperfusion injury in rats. Life Sci. 2002;71:1501-1510. [PubMed] [DOI] |
| 9. | 王 玉, 孙 黎光, 夏 春辉, 叶 丽平, 张 莹. 在Fas诱导Bel-7402细胞凋亡中p38MAPK调节Bcl-2的表达. 世界华人消化杂志. 2007;15:3184-3189. [DOI] |
| 10. | Davis RJ. The mitogen-activated protein kinase signal transduction pathway. J Biol Chem. 1993;268:14553-14556. [PubMed] |
| 11. | Hu BR, Wieloch T. Tyrosine phosphorylation and activation of mitogen-activated protein kinase in the rat brain following transient cerebral ischemia. J Neurochem. 1994;62:1357-1367. [PubMed] |
| 12. | Bogoyevitch MA, Kobe B. Uses for JNK: the many and varied substrates of the c-Jun N-terminal kinases. Microbiol Mol Biol Rev. 2006;70:1061-1095. [PubMed] [DOI] |
| 13. | Dhanasekaran DN, Reddy EP. JNK signaling in apoptosis. Oncogene. 2008;27:6245-6251. [PubMed] [DOI] |
| 14. | Herdegen T, Claret FX, Kallunki T, Martin-Villalba A, Winter C, Hunter T, Karin M. Lasting N-terminal phosphorylation of c-Jun and activation of c-Jun N-terminal kinases after neuronal injury. J Neurosci. 1998;18:5124-5135. [PubMed] |
| 15. | House SL, Branch K, Newman G, Doetschman T, Schultz Jel J. Cardioprotection induced by cardiac-specific overexpression of fibroblast growth factor-2 is mediated by the MAPK cascade. Am J Physiol Heart Circ Physiol. 2005;289:H2167-H2175. [PubMed] [DOI] |
| 16. | Kunduzova OR, Bianchi P, Pizzinat N, Escourrou G, Seguelas MH, Parini A, Cambon C. Regulation of JNK/ERK activation, cell apoptosis, and tissue regeneration by monoamine oxidases after renal ischemia-reperfusion. FASEB J. 2002;16:1129-1131. [PubMed] |
| 17. | Li L, Zhang YM, Qiao WL, Zhang JF, Wang L. Role of mitogen-activated protein kinases in the regulation of paraventricular nucleus to gastric ischemia-reperfusion injuries. Chin Med J (Engl). 2007;120:1082-1087. [PubMed] |
| 18. | Paxinos G, Watson C. The rat brain in sterotaxic coordinates. 2nd ed. Sydney: Academic Press 1986; F23-F26. |
| 19. | Wada K, Kamisaki Y, Kitano M, Kishimoto Y, Nakamoto K, Itoh T. A new gastric ulcer model induced by ischemia-reperfusion in the rat: role of leukocytes on ulceration in rat stomach. Life Sci. 1996;59:PL295-PL301. [PubMed] [DOI] |
| 20. | Zhou Y, Wang Q, Evers BM, Chung DH. Signal transduction pathways involved in oxidative stress-induced intestinal epithelial cell apoptosis. Pediatr Res. 2005;58:1192-1197. [PubMed] [DOI] |
| 21. | Mitsuyama K, Tsuruta O, Matsui Y, Harada K, Tomiyasu N, Suzuki A, Takaki K, Masuda J, Handa K, Satoh Y. Activation of c-Jun N-terminal kinase (JNK) signalling in experimentally induced gastric lesions in rats. Clin Exp Immunol. 2006;143:24-29. [PubMed] [DOI] |
| 22. | 欧 希龙, 颜 芳, 关 云艳, 孙 为豪, 杨 柳, 陈 国胜, 产 松苗, 陈 宝安. 血管生成素-1对人胃癌细胞Bcl-2和Bax表达的影响. 世界华人消化杂志. 2008;16:3605-3609. [DOI] |
| 24. | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival. Science. 1998;281:1322-1326. [PubMed] [DOI] |
| 25. | Brunelle JK, Letai A. Control of mitochondrial apoptosis by the Bcl-2 family. J Cell Sci. 2009;122:437-441. [PubMed] [DOI] |
| 26. | Susnow N, Zeng L, Margineantu D, Hockenbery DM. Bcl-2 family proteins as regulators of oxidative stress. Semin Cancer Biol. 2009;19:42-49. [PubMed] [DOI] |
| 27. | Knudson CM, Brown NM. Mitochondria potential, bax "activation," and programmed cell death. Methods Mol Biol. 2008;414:95-108. [PubMed] |
| 28. | Adams JM, Cory S. Bcl-2-regulated apoptosis: mechanism and therapeutic potential. Curr Opin Immunol. 2007;19:488-496. [PubMed] [DOI] |
| 29. | Konturek PC, Brzozowski T, Konturek SJ, Pajdo R, Konturek JE, Kwiecień S, Taut A, Hahn EG. Apoptosis in gastric mucosa with stress-induced gastric ulcers. J Physiol Pharmacol. 1999;50:211-225. [PubMed] |
| 30. | Konturek PC, Pierzchalski P, Konturek SJ, Meixner H, Faller G, Kirchner T, Hahn EG. Helicobacter pylori induces apoptosis in gastric mucosa through an upregulation of Bax expression in humans. Scand J Gastroenterol. 1999;34:375-383. [PubMed] [DOI] |