修回日期: 2009-05-14
接受日期: 2009-05-18
在线出版日期: 2009-06-28
目的: 探讨NDRG1在原发性肝细胞癌(HCC)及胎肝组织中的表达及其意义.
方法: 收集2002-01/2008-12广州市第一人民医院手术切除的肝细胞癌标本81例. 所有患者术前未行放疗和化疗; 25例胎肝组织, 取自不同月份流产或引产的胎儿(4、5、6、7、8 mo胎儿各5例); 另选43例癌旁组织, 10例肝硬化组织, 9例正常肝组织(移植肝), 8例原发癌转移灶组织作为对照. 观察肝脏组织病理形态特征, 并用免疫组织化学EnVison法检测NDRG1的表达.
结果: NDRG1在正常肝组织中呈强阳性表达, 平均吸光度值为0.206±0.056, 随着肿瘤的发生, 在癌旁组织中有减弱(0.176±0.083), 在HCC中表达明显减弱(0.128±0.096), 在转移灶中表达最低(0.059±0.051), 而在胎肝组织中表达亦较低(0.059±0.074). 各组总体差异均有统计学意义(F = 33.669, P<0.05). HCC与患者年龄、性别、肝炎病史、肝硬化、肿瘤大小、AFP值、HbsAg、淋巴结转移及有无远处转移、肿瘤分型、Child-Pugh分级、TNM分期、CLIP分期均无关(P>0.05), 但与肿瘤的Edmondson分级有关(F = 2.881, P<0.05).
结论: NDRG1在HCC中低表达, 并且随着肿瘤的发生发展, 表达量逐渐降低. NDRG1可能对HCC起着抑制作用, 提示该基因可望成为早期预测肝癌转移的分子生物学标志物之一.
引文著录: 陈金培, 杨耀湘. NDRG1在原发性肝细胞癌及胎肝中的表达及意义. 世界华人消化杂志 2009; 17(18): 1883-1887
Revised: May 14, 2009
Accepted: May 18, 2009
Published online: June 28, 2009
AIM: To investigate the expression of NDRG1 in primary hepatocellular carcinoma (HCC) and fetal liver and its significance.
METHODS: Eighty one surgical resection specimens of hepatocellular carcinoma were obtained during 2002-01 and 2008-12, and all patients did not undergo pre-operative radiotherapy or chemotherapy. Twenty five fetal liver tissue specimens were taken from fetuses at different months (4, 5, 6, 7, 8 mo of the five cases of fetus). Forty three cases of para-carcinoma tissues, 10 cases of liver cirrhosis tissue, 9 cases of normal liver tissue (liver transplantation), and 8 cases of primary cancer metastasis tissue were taken as the controls. The pathological morphological characteristics of liver tissue were observed, and the expression of NDRG1 was detected using immunohistochemical EnVision.
RESULTS: NDRG1 expression in normal liver tissue was strongly positive, and the average optical density value was 0.206 ± 0.056. With the progress of carcinoma, NDRG1 expression was weakened in para-carcinoma tissues, and the average optical density value was 0.176 ± 0.083. It was decreased significantly in the HCC (0.128 ± 0.096), bottomed in metastasis focus (0.059 ± 0.051), and was also lower in fetal liver tissue (0.059 ± 0.074). The overall differences among the groups were statistically significant (F = 33.669, P < 0.05). HCC was not related to the age, sex, history of hepatitis, with or without cirrhosis, carcinoma size, AFP value, HbsAg, with or without lymph node metastasis, or distant metastasis, carcinoma type, Child-Pugh classification, TNM staging , CLIP stages (P > 0.05), but related to the Edmondson classification of carcinoma (F = 2.881, P < 0.05).
CONCLUSION: Low-expression of NDRG1 in HCC is observed and the expression is further decreased with the tumor development and progression. Therefore, NDRG1 exerts an inhibitory effect on HCC, suggesting that the gene is expected to become a molecular marker for the early prediction of HCC metastasis.
- Citation: Chen JP, Yang YX. Expression of NDRG1 in primary hepatocellular carcinoma and fetal liver and its significance. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1883-1887
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1883.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1883
NDRG1是新近发现的与细胞分化有关的基因, 该基因曾被多个学者相继独立发现和分离, 因此其名称也有多种, 后被人类基因组组织(human geneome organization, HUGO)基因命名委员会正式命名为NDRG1(N-myc downstream regulated gene 1). 最初的研究发现, NDRG1在结肠癌、前列腺癌中呈低表达, 在体外诱导分化的结肠癌细胞系高表达, 因而可能是与细胞分化程正相关的抑癌基因[1-2]. 然而最近报道, NDRG1蛋白在正常组织中低表达, 在乳腺癌、肺癌、肾癌、黑色素瘤等多种癌组织中高表达, 认为可以把NDRG1蛋白作为一种新的检测癌症的标志物[3]. 本文应用免疫组织化学染色, 分析NDRG1基因在原发性肝细胞癌(hepatocellular carcinoma, HCC)中的表达特点及其与临床病理之间的关系.
收集2002-01/2008-12广州市第一人民医院手术切除的肝细胞癌标本81例, 所有患者术前未行放疗和化疗; 25例胎肝组织, 取自不同月份流产或引产的胎儿(4、5、6、7、8 mo胎儿各5例); 另选43例癌旁组织, 10例肝硬化组织, 9例正常肝组织(移植肝), 8例原发癌转移灶组织作为对照. NDRG1为浓缩型羊多克隆抗体, 工作浓度为1:100, 购自Santa Cruz; 二抗为浓缩型兔抗羊多克隆抗体, 稀释比例为1:200; 二抗及EnVision试剂盒等均购自Dako公司. 所有标本均经100 g/L甲醛溶液固定12-24 h, 石蜡包埋切片. 进行EnVision法免疫组织化学染色, 其具体步骤按试剂盒说明进行. 用PBS替代一抗作为阴性对照, 以已知阳性切片作阳性对照. 每次试验均设阳性对照及阴性对照. 严格染色质控条件, 所有染色步骤和时间一致.
1.2.1 收集病例资料: 收集一般性资料, 包括患者性别、年龄、有无肝炎病史、肿瘤大小、AFP值、HbsAg、有无淋巴结转移、有无远处转移、肿瘤的病理学分型、Edmondson分级、Child-Pugh分级、TNM分期、CLIP分期.
1.2.2 免疫组织化学染色结果判定: NDRG1在细胞中的表达呈现棕黄色或黄色颗粒状染色. 在显微镜下观察阳性反应产物的分布, 应用彩色图像分析系统进行定量分析, 以减少人为因素的干扰, 使结果判定更客观. 本实验采用麦克奥迪数码医学图像分析系统, 切片在光镜下按统一放大倍数(×400)进行分析, 每张切片随机摄取10个视野, 输入计算机作为测定视场, 选择平均吸光度(A值), 其代表染色强度, 能较准确地反映阳性产物颜色深浅的平均状况[4].
统计学处理 所有数值均用mean±SD表示, 采用SPSS11.5统计软件包进行分析, 计量资料用方差分析. P<0.05有显著差异.
81例HCC患者中男71例,女10例; 年龄23-77(平均53.8)岁, 中位年龄55岁. 标本均经HE染色证实为HCC, 其中伴肝硬化者52例, 占64.2%; 术前测定血清AFP阳性30例(AFP>400 µg/L为阳性), AFP阴性51例; HBsAg阳性者61例, 阴性者20例; 有肝炎病史者44例, 无肝炎病史者37例; 肿瘤直径小于3 cm者16例, 最大直径小于5 cm者9例, 最大直径大于5 cm者56例; 有淋巴结转移者2例, 无淋巴结转移者79例; 有远处转移者2例, 无远处转移者79例.
HCC的组织学分级以肿瘤中多数癌细胞为依据, 按照Edmondson四级法分级:Ⅰ级2例, Ⅱ级41例, Ⅲ级29例, Ⅳ级9例(其中Ⅰ级为高分化, Ⅱ、Ⅲ级为中分化, Ⅳ级为低分化); 梁索型44例, 腺样型15例, 实体型22例; TNM分期标准, Ⅰ期者43例, Ⅱ期者6例, ⅢA期者10例, ⅢB期者19例, ⅢC期者1例, Ⅳ期者2例; Child-Pugh分级标准(共79例, 1例无PT值, 1例无TBIL值), A级者71例, B级者7例, C级者1例; CLIP分期标准(共79例, 2例无Chlid值): 0分者5例, 1分者3例, 2分者34例, 3分者31例, 4分者6例.
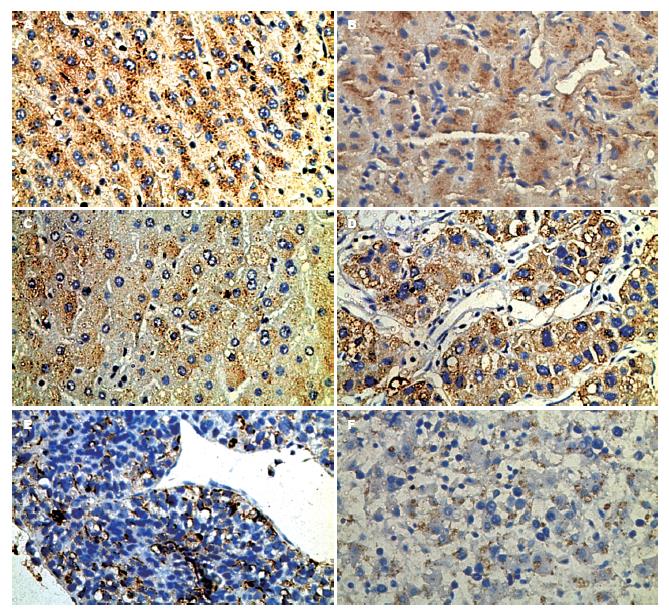
NDRG1阳性染色见于细胞质或细胞膜. NDRG1在正常肝组织(图1A)中呈强阳性表达, 平均A值为0.206±0.056; 肝硬化组织(图1B)中NDRG1表达有所减弱(0.198±0.074); 随着肿瘤的发生, 在癌旁组织(图1C)中该基因表达进一步减弱, 平均A值为0.176±0.083; 在HCC(图1D)中表达明显减弱(0.128±0.096), 而转移灶(图1E)中表达最低(0.059±0.051). 各组总体差异均有统计学意义(F = 33.669; P<0.05).从表1中可见HCC与患者的年龄、性别、肝炎病史、有无肝硬化、肿瘤的大小、AFP值、HbsAg、淋巴结有无转移、有无远处转移、肿瘤的分型、Child-Pugh分级、TNM分期、CLIP分期均无关(P>0.05), 但与肿瘤的Edmondson分级有关(P<0.05).
| 项目 | n | A值 | F值 | P值 |
| 性别 | ||||
| 男 | 71 | 0.125±0.096 | 0.710 | 0.402 |
| 女 | 10 | 0.152±0.093 | ||
| 年龄 | ||||
| ≤40 | 15 | 0.105±0.070 | ||
| 40-60 | 42 | 0.132±0.100 | 0.545 | 0.582 |
| >60 | 24 | 0.135±0.103 | ||
| 肝炎病史 | ||||
| 有 | 44 | 0.127±0.101 | 0.020 | 0.888 |
| 无 | 37 | 0.130±0.091 | ||
| 肝硬化 | ||||
| 有 | 52 | 0.135±0.102 | 0.925 | 0.339 |
| 无 | 29 | 0.113±0.083 | ||
| 直径(cm) | ||||
| <3 | 16 | 0.130±0.096 | ||
| 最大直径≤5 | 9 | 0.130±0.089 | 0.006 | 0.994 |
| 最大直径>5 | 56 | 0.127±0.098 | ||
| AFP(μg/L) | ||||
| <400 | 51 | 0.123±0.087 | 0.337 | 0.563 |
| >400 | 30 | 0.136±0.110 | ||
| HbsAg | ||||
| + | 61 | 0.122±0.942 | 0.997 | 0.321 |
| - | 20 | 0.147±0.100 | ||
| 淋巴结转移 | ||||
| 有 | 2 | 0.043±0.002 | 1.624 | 0.206 |
| 无 | 79 | 0.130±0.096 | ||
| 远处转移 | ||||
| 有 | 2 | 0.180±0.049 | 0.612 | 0.436 |
| 无 | 79 | 0.127±0.096 | ||
| 分型 | ||||
| 梁索型 | 44 | 0.134±0.106 | ||
| 腺样型 | 15 | 0.117±0.100 | 0.204 | 0.816 |
| 实体型 | 22 | 0.124±0.071 | ||
| Edmondson分级 | ||||
| Ⅰ级 | 2 | 0.282±0.237 | ||
| Ⅱ级 | 41 | 0.141±0.100 | 2.881 | 0.041 |
| Ⅲ级 | 29 | 0.110±0.074 | ||
| Ⅳ级 | 9 | 0.095±0.080 | ||
| Child-Pugh分级 | ||||
| A级 | 71 | 0.126±0.096 | ||
| B级 | 7 | 0.158±0.102 | 1.115 | 0.333 |
| C级 | 1 | 0.009 | ||
| TNM分期 | ||||
| Ⅰ期 | 43 | 0.125±0.098 | ||
| Ⅱ期 | 6 | 0.141±0.115 | ||
| ⅢA期 | 10 | 0.142±0.117 | 0.344 | 0.884 |
| ⅢB期 | 19 | 0.122±0.083 | ||
| ⅢC期 | 1 | 0.045 | ||
| Ⅳ期 | 2 | 0.180±0.049 | ||
| CLIP分期 | ||||
| 0分 | 5 | 0.119±0.067 | ||
| 1分 | 3 | 0.070±0.085 | ||
| 2分 | 34 | 0.131±0.086 | 0.281 | 0.889 |
| 3分 | 31 | 0.130±0.114 | ||
| 4分 | 6 | 0.125±0.101 |
NDRG1在不同胎龄胎肝组织中的表达, 平均A值为(0.059±0.074)(图1F), 4-8月份, NDRG1的表达量分别为0.054、0.124、0.244、0.082和0.074. NDRG1的表达量随着胎儿发育即胎龄增大而逐渐增加, 至分化末期又有所减少.
目前, 临床研究领域主要集中在肿瘤的早期发现和寻找新的有效治疗手段. 而新的肿瘤标志物可以为恶性肿瘤的诊断及治疗提供很大的帮助. NDRG1是新近发现的与细胞分化相关的基因, 尽管其确切功能还不是十分清楚, 但他在恶性肿瘤中的异常表达引起了许多学者的关注与研究. NDRG1基因是N-myc下游调节基因家族的一个成员, 因受N-myc的抑制而得名, 该基因定位于人染色体8q24.2, 长约60 kb, 其编码的蛋白质相对分子质量为43000 Da[5], 研究表明, 该基因与细胞的生长发育、分化、肿瘤的发生、转移和预后等[5-6]有关.
NDRG1基因在各种肿瘤组织中的表达争议较大. 一些学者发现, 与正常组织相比, 在多种肿瘤细胞株[7]及肿瘤组织如乳腺癌、前列腺癌、结肠癌中, NDRG1都呈低表达, 故该基因过表达则可抑制肿瘤细胞的生长; Bandyopadhyay et al[8]研究结果显示, NDRG1表达与前列腺癌Gleason分级和患者的总生存率呈负相关, 尤其是与前列腺原发肿瘤相比, 有骨转移和淋巴结转移的病例中NDRG1表达明显下降. Wang et al[9]也发现, NDRG1的表达与乳腺癌的转移呈负相关, 将由此推断该基因表达的下调也许导致了肿瘤的恶性表型. 关于NDRG1抑制肿瘤生长和转移的分子机制有以下2点推测: (1)NDRG1过表达可以诱导E-钙粘连素和其他细胞分化标志物的表达, 这些细胞表面分子的改变可能改变肿瘤细胞之间的黏附特性, 从而抑制体内、外肿瘤细胞的侵袭能力[1]. (2)NDRG1过表达可以显著减少血管生成因子的表达, 如血管内皮生长因子(vascular endothelial growth factor, VEGF)、金属蛋白酶-9(matrix metalloproteinases-9, MMP-9)和白介素-8(interleukin IL-8), 从而抑制血管生成, 而血管生成是肿瘤生长和转移的关键因素. 所以推测NDRG1通过调节肿瘤细胞及其周围组织的血管生成来抑制肿瘤的生长和转移[10].
但Cangul et al[2]的研究结果却对上述结论提出了质疑, 他们在实验中观察到, 在多种肿瘤组织, 如肺癌、脑肿瘤、肝癌、前列腺癌、乳腺癌、肾癌和黑色素瘤中, NDRG1蛋白的表达明显增高. 尤其是在脑和肺中NDRG1蛋白仅在肿瘤组织中表达, 而在正常组织中不表达. NDRG1在肿瘤组织中高表达的分子机制可能与肿瘤细胞缺氧有关. 缺氧是实体肿瘤共有的特征, NDRG1能被缺氧诱导表达, 已经是公认缺氧诱导基因. 目前研究发现, 缺氧诱导NDRG1高表达通过以下2条途径: (1)通过HIF-1α依赖的途径, 缺氧造成HIF-1转录因子的活化及表达, 最后诱导缺氧敏感基因NDRG1的表达; (2)通过非HIF-1依赖的途径[11], 实验证实缺氧条件下细胞内Ca2+内流增加也可以诱导NDRG1表达, 其分子机制主要是Ca2+内流增加诱导c-Jun的表达, 活化激活蛋白1(activator protein 1, AP-1)依赖的转录. 所以, HIF-1与c-Jun/AP-1依赖的途径共同参与调节缺氧诱导基因NDRG1在肿瘤组织中的表达.
在我国, 肝癌的发病率居恶性肿瘤的第3位, 约占全世界肝癌病例的42.5%. 该病病程短、进展快、病死率高, 预后极差. 有研究表明NDRG1可能成为HCC新的标志物, 他是肿瘤侵袭性的一个重要的指标, 并可以此来推断患者的预后[12]. 我们用免疫组织化学EnVision法检测了NDRG1在胎肝组织、正常肝组织、肝硬化组织、癌旁组织、HCC及原发转移灶中的表达, 发现他在肝癌组织中的表达量低于正常肝组织、肝硬化组织、癌旁组织的表达量, 说明在肝癌中NDRG1是低表达的, 提示在肝肿瘤的发生发展中, NDRG1表达受到某种程度抑制. 与原发肿瘤相比NDRG1在转移灶中表达最低, 提示该基因可望成为早期预测肝癌转移的分子生物学标志物之一. 这与Cangul et al结果相反, 考虑其原因有: (1)标本来源不同, 本实验正常肝组织主要是取自移植肝, 其文献中的正常肝组织主要是癌旁肝组织; (2)免疫组织化学方法不同, 本实验采用的是EnVision两步法, 而Cangul et al中采用ABC法. 其原因还有待于进一步的研究.
本文进一步研究了NDRG1在不同胎龄胎肝中的表达, 结果显示NDRG1的表达量随着胎龄的发育而逐渐增加, 至分化末期又有所减少, 这与何静 et al[13]的研究结果一致, 表明NDRG1在肝细胞分化的一定阶段可能发挥重要功能. 综上可知NDRG1在恶性肿瘤中的作用及与细胞分化的关系还需要进一步的深入研究, 本文只是对NDRG1在HCC及胎肝中的蛋白表达做了一些基础性的研究, 还有待于在mRNA和DNA水平上探讨对本研究结果进一步证实.
NDRG1是新近发现的与细胞分化有关的基因, NDRG1与肿瘤的关系引起人们的关注. 最初的研究发现, NDRG1可能是与细胞分化程度正相关的抑癌基因. 然而最近报道, 认为可以把NDRG1作为一种新的检测癌症的标志物.
李瑗, 教授, 广西肿瘤研究所
目前, 临床研究领域主要集中在肿瘤的早期发现和寻找新的有效治疗手段. 而新的肿瘤标志物可以为恶性肿瘤的诊断及治疗提供很大的帮助.
一些学者发现, 与正常组织相比, 在多种肿瘤细胞株及肿瘤组织, 如乳腺癌、前列腺癌、结肠癌中, NDRG1都呈低表达, 故该基因过表达则可抑制肿瘤细胞的生长. 但Cangul et al的研究结果却对上述结论提出了质疑, 他们在实验中观察到, 在多种肿瘤组织, 如肺癌、脑肿瘤、肝癌、前列腺癌、乳腺癌、肾癌和黑色素瘤中, NDRG1蛋白的表达明显增高. 何静 et al通过Northern blot和RT-PCR方法检验发现NDRG1基因功能的表达量随婴鼠肝和人胎肝的发育而增高, 至已达分化的成年肝又有所降低.
本文通过观察NDRG1在胎肝、正常肝组织、肝硬化组织、HCC、癌旁组织、原发癌转移灶组织中的表达,分析肝脏细胞从发育到成熟到癌变过程中NDRG1的表达, 并将HCC按照Edmondson分级、Child-Pugh分级、TNM分期及CLIP分期来研究不同分级、分期的关系.
NDRG1可能对HCC起着抑制作用, 提示该基因可望成为早期预测肝癌转移的分子生物学标志物之一.
本研究设计合理, 条理清楚, 结果有一定的意义.
编辑: 李军亮 电编: 何基才
| 1. | Guan RJ, Ford HL, Fu Y, Li Y, Shaw LM, Pardee AB. Drg-1 as a differentiation-related, putative metastatic suppressor gene in human colon cancer. Cancer Res. 2000;60:749-755. [PubMed] |
| 2. | Cangul H, Salnikow K, Yee H, Zagzag D, Commes T, Costa M. Enhanced expression of a novel protein in human cancer cells: a potential aid to cancer diagnosis. Cell Biol Toxicol. 2002;18:87-96. [PubMed] [DOI] |
| 3. | Wang Z, Wang F, Wang WQ, Gao Q, Wei WL, Yang Y, Wang GY. Correlation of N-myc downstream-regulated gene 1 overexpression with progressive growth of colorectal neoplasm. World J Gastroenterol. 2004;10:550-554. [PubMed] |
| 6. | Li J, Kretzner L. The growth-inhibitory Ndrg1 gene is a Myc negative target in human neuroblastomas and other cell types with overexpressed N- or c-myc. Mol Cell Biochem. 2003;250:91-105. [PubMed] [DOI] |
| 7. | van Belzen N, Dinjens WN, Diesveld MP, Groen NA, van der Made AC, Nozawa Y, Vlietstra R, Trapman J, Bosman FT. A novel gene which is up-regulated during colon epithelial cell differentiation and down-regulated in colorectal neoplasms. Lab Invest. 1997;77:85-92. [PubMed] |
| 8. | Bandyopadhyay S, Pai SK, Gross SC, Hirota S, Hosobe S, Miura K, Saito K, Commes T, Hayashi S, Watabe M. The Drg-1 gene suppresses tumor metastasis in prostate cancer. Cancer Res. 2003;63:1731-1736. [PubMed] |
| 9. | Wang Z, Liu Q, Chen Q, Zhu R, Zhu HG. [Overexpression of NDRG1: relationship with proliferative activity and invasiveness of breast cancer cell line and breast cancer metastasis]. Zhonghua Binglixue Zazhi. 2006;35:333-338. [PubMed] |
| 10. | Salnikow K, Kluz T, Costa M, Piquemal D, Demidenko ZN, Xie K, Blagosklonny MV. The regulation of hypoxic genes by calcium involves c-Jun/AP-1, which cooperates with hypoxia-inducible factor 1 in response to hypoxia. Mol Cell Biol. 2002;22:1734-1741. [PubMed] [DOI] |
| 11. | Maruyama Y, Ono M, Kawahara A, Yokoyama T, Basaki Y, Kage M, Aoyagi S, Kinoshita H, Kuwano M. Tumor growth suppression in pancreatic cancer by a putative metastasis suppressor gene Cap43/NDRG1/Drg-1 through modulation of angiogenesis. Cancer Res. 2006;66:6233-6242. [PubMed] [DOI] |
| 12. | Chua MS, Sun H, Cheung ST, Mason V, Higgins J, Ross DT, Fan ST, So S. Overexpression of NDRG1 is an indicator of poor prognosis in hepatocellular carcinoma. Mod Pathol. 2007;20:76-83. [PubMed] [DOI] |
| 13. | 何 静, 周 柔丽. NDRG1基因与肝组织分化及癌变的相关性. 北京大学学报(医学版). 2003;35:471-475. |