修回日期: 2009-06-02
接受日期: 2009-06-08
在线出版日期: 2009-06-28
目的: 研究NHE-1与肝星状细胞增殖的关系及姜黄素对其的影响, 初步探讨肝纤维化的形成机制.
方法: 选择肝星状细胞系作为体外研究对象, 用不同浓度(1、10、20 μmol/L)的姜黄素处理大鼠肝星状细胞; 以MTT比色法测定肝星状细胞的增殖; 酶联免疫吸附法(ELISA)测定Ⅰ型胶原含量, RT-PCR法检测肝星状细胞Na+/H-泵(NHE-1 mRNA)的表达.
结果: 各浓度姜黄素可明显下调肝星状细胞NHE-1 mRNA表达(0.6401±0.0063, 0.2391±0.0039, 0.1437±0.0044 vs 0.7214±0.0155, P<0.05), 降低培养上清液中Ⅰ型胶原的水平(199.40±16.22, 182.37±14.72, 169.91±15.80 ng/mg pro vs 216.35±17.19 ng/mg pro, P<0.05), 抑制肝星状细胞的增殖, 并呈剂量依赖性.
结论: 姜黄素可能通过调控肝星状细胞NHE-1 mRNA的表达来抑制HSC的增殖及Ⅰ型胶原的合成等机制, 从而抑制肝纤维化的形成.
引文著录: 胡泰洪, 黄利华, 杨玲, 朱清静, 朱锐, 蒋跃明. NHE-1与肝星状细胞增殖的关系及姜黄素对其的影响. 世界华人消化杂志 2009; 17(18): 1860-1863
Revised: June 2, 2009
Accepted: June 8, 2009
Published online: June 28, 2009
AIM: To study the relationship between the mRNA of NHE-1 and the proliferation of hepatic stellate cells (HSCs) and the influence of curcumin on them.
METHODS: Hepatic stellate cell lines (HSC-T6) were incubated with different concentrations (1, 10, 20 μmol/L) of curcumin for 24 h. The proliferation of hepatic stellate cells was measured by MTT. The content of collagen I was measured by ELISA. The mRNA of NHE-1 was examined by RT-PCR.
RESULTS: Curcumine down-regulated the expression of NHE-1 mRNA (0.6401 ± 0.0063, 0.2391 ± 0.0039, 0.1437 ± 0.0044 vs 0.7214 ± 0.0155, all P < 0.05), decreased the levels of collagen I (199.40 ± 16.22, 182.37 ± 14.72, 169.91 ± 15.80 ng/mg pro vs 216.35 ± 17.19 ng/mg pro, all P < 0.05) and lowered the number of proliferating HSCs in a concentration dependent way.
CONCLUSION: These results suggest that curcumine can prevent hepatic fibrosis via inhibiting proliferation and collagen I production of HSCs, which may be partly related to its regulative effect on the expression of NHE mRNA gene.
- Citation: Hu TH, Huang LH, Yang L, Zhu QJ, Zhu R, Jiang YM. Influence of curcumin on NHE-1 mRNA and hepatic stem cell proliferation and their correlations. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1860-1863
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1860
肝星状细胞(hepatic stellate cells, HSCs)是位于Disse间隙的一种间质细胞, 目前认为HSCs的活化、增殖与肝纤维化的发生发展密切相关. HSCs通过自分泌和旁分泌作用产生大量细胞外基质(extracellular matrix, ECM)和活化基质金属蛋白酶抑制剂, 并抑制胶原酶活性, 从而降低ECM降解, 造成ECM过量沉积而形成纤维化. 抑制HSCs活化增殖有助于逆转肝纤维化[1-8].
Na+/H-交换泵(Na+/H- exchanger, NHE)-人们早已熟知的参与细胞内外Na+/H-交换的细胞膜大分子. 已证实有6种形式的NHE, 分别命名为NHE1-6, 其中以NHE-1组织分布最广泛. 新近关于肝纤维化形成机制的研究表明NHE-1在肝纤维化形成中起重要作用, 为抗肝纤维化的研究提供了新靶点. 姜黄素(Curcumin, CUR)是从中药姜黄中提取的一种酚类色素, 具有诱导HSCs凋亡、抑制氧自由基产生、抑制多种蛋白激酶活性、抑制金属蛋白酶分泌等作用, 在体外实中, 姜黄素对CCl4和D-半乳糖胺诱导的肝细胞毒性也有保护作用[9-15].
我们的前期动物实验证实[16-17]: 姜黄素可通过抑制α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达, 抑制ERK-1的促HSCs的增殖作用, 从而产生抗CCl4诱导的大鼠肝纤维化的作用; NHE-1与肝纤维化存在密切关系. 为进一步研究姜黄素对肝纤维化的作用, 本实验应用肝星状细胞细胞系, 拟观察姜黄素对大鼠肝星状细胞增殖、Ⅰ型胶原分泌及NHE mRNA表达的影响, 从体外探索姜黄素抗肝纤维化的作用机制.
肝星状细胞系HSCs-T6(Friedman教授建立)由上海中医药大学徐列明教授惠赠. DMEM为Gibco公司产品. 小牛血清购自杭州四季青公司. 四甲基偶氮唑蓝(MTT)购自华美生物工程公司. Ⅰ型胶原试剂盒(美国BPB公司). Curcumin 购自Sigma公司, 不溶于水, 易溶于二甲亚砜溶液中, 配好的姜黄素二甲亚砜溶液以30 g/L小牛血清的DMEM培养液调整至姜黄素使用浓度, 二甲亚砜的终浓度要低于0.1%. Taq DNA聚合酶、MMLV逆转录酶、Oligo(dT)15、 MgCl2(25 mmol/L)购于美国Promega有限公司, Mix dNTP购于Sangon公司, RNA酶抑制剂购于华美生物工程公司, Tripure购于Roche诊断有限公司, 琼脂糖购于上海东海制药厂, DNA Marker DL2000购于大连宝生物工程有限公司. NHE-1上游引物: 5'-CAAGATCCCATCTGCCGTCTCA-3', NHE-1下游引物: 5'-ACTCCTCATTCACCAGGTCCAC-3'(基因序列查自PubMed, M85299, GI: 1280490). β-actin上游引物: 5'-GAAACTACCTTCAACTCCATC-3', β-actin下游引物: 5'-CGAGGCCAGGATGGAGCCGCC-3'. 引物购于上海生工生物工程技术服务有限公司.
1.2.1 HSCs的培养及传代: HSCs-T6培养于37 ℃、50 mL/L CO2的含100 mL/L胎牛血清、100 kU/L青霉素、100 U/L链霉素、1% L-谷氨酰胺的DMEM培养液中, 在倒置显微镜下观察细胞长到亚单层或细胞密度约80%-90%时, 以EDTA 37 ℃消化2-3 min传代.
1.2.2 细胞增殖试验: 以MTT比色法检测HSCs的增殖. 传一代培养的HSCs以50 g/L小牛血清的DMEM制备为1×108/L细胞悬液, 接种于96孔板, 每孔100 μL, 至细胞长至近单层后, 正常对照组换50 g/L小牛血清的DMEM培养液, 其余各组为含不同浓度姜黄素的5%小牛血清的DMEM培养液, 每组设6个复孔, 分组如下, Ⅰ组: HSCs-T6空白对照; Ⅱ组: 含姜黄素浓度为1 μmol/L, Ⅲ组: 含姜黄素浓度为10 μmol/L, Ⅳ组: 含姜黄素浓度为20 μmol/L. 24 h后每孔加0.5% MTT贮存液20 μL继续孵育4 h后, 弃上清并每孔加100 μL二甲基亚砜溶解细胞内结晶, 酶标仪570 nm波长测定吸光度(A)值. 抑制率 = (对照孔A570-实验孔A570)/对照品A570×100%.
1.2.3 ELISA法测定上清液Ⅰ型胶原含量: 将HSCs以l×108/L培养于96孔板, 培养48 h, 按上述分组方法采用不同浓度姜黄素的培养液继续培养24 h后, 收集培养上清液. 取出酶标板, 分别加入培养上清和标准品, 每组6孔; 每孔加入50 μL的酶标记溶液; 25 ℃孵育反应90 min; 洗液清洗6次; 每孔加入底物A、B液各50 μL; 25 ℃孵育反应15 min; 每孔加入50 μL终止液, 终止反应; 于酶标仪450 nm波长比色.
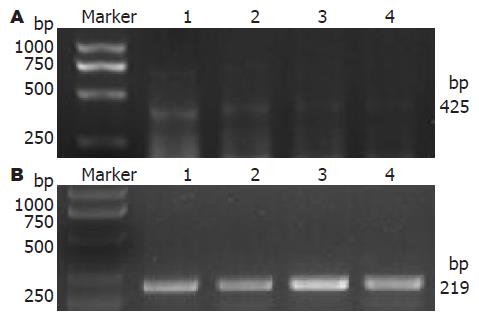
1.2.4 细胞中NHE-1 mRNA的表达量: 细胞总mRNA的提取: 药物作用于细胞24 h后, 倒去上清液, 加TRIzol 500 μL吹打后移入离心管中, 按Tripure试剂盒说明提取总RNA, 合成cDNA. RT-PCR: 在EP管中加ddH2O 8 μL, mRNA 4 μL, 500 mg/L的Oligo(dT)1 μL, 50 U/μL RNsin 0.5 μL, 25 mmol/L dNTP 2 μL, 5×逆转录缓冲液4 μL, 200 U/μL逆转录酶0.5 μL, 置37 ℃ 60 min后, 95 ℃ 5 min; PCR: 在EP管中加ddH2O 13 μL, 10×缓冲液2.5 μL, 25 mmol/L MgCl2 1.5 μL, 上下游引物各0.2 μL, 25 mmol/L dNTP 2 μL, cDNA 1 μL, 石蜡油8 μL, 置95 ℃ 6 min后, 再加ddH2O 5 μL及 Taq酶0.5 μL(总反应体积25 μL). 变性温度94 ℃ 45 s, 退火温度55 ℃ 45 s, 延伸温度72 ℃ 1 min, 扩增25个循环; 最后于72 ℃ 10 min. NHE-1退火温度55 ℃, 产物为425 bp, β-actin退火温度为48 ℃, 产物长度为219 bp. 取4 μL加1 μL的溴酚蓝电泳缓冲液电泳观察, 并用MGIAS-1000多媒体凝胶成像分析系统计算吸光度值. 以目的基因与内参照基因(β-actin mRNA)A值的比值作为该例标本mRNA的相对表达量.
统计学处理 用统计软件SPSS10.0进行数据统计学处理. 计量资料以mean±SD表示, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
MTT法显示, 不同浓度的姜黄素干预HSCs, 实验组A值均低于空白对照组, 10, 20 μmol/L时, 与空白对照组比较有差异(0.087±0.050, 0.051±0.049 vs 0.281±0.063, P<0.05), 并且随浓度的增加姜黄素的抑制增殖作用增强.
空白对照组比较, 姜黄素各剂量组不同程度降低培养上清液中Ⅰ型胶原水平, 呈明显剂量效应关系, 与空白对照组比较差异有统计学意义(199.40±16.22, 182.37±14.72, 169.91±15.80 ng/mg pro vs 216.35±17.19 ng/mg pro, P<0.05).
随着姜黄素作用剂量的增加, NHE-1 mRNA表达逐渐减弱(图1), 与空白对照组比较差异有统计学意义(0.6401±0.0063, 0.2391±0.0039, 0.1437±0.0044 vs 0.7214±0.0155, P<0.05).
HSCs活化是肝纤维化形成的关键, 而增殖是HSCs活化的重要特征之一. 因此, 对HSCs的增殖的抑制是防治肝纤维化的策略之一.
NHE-1与人类疾病的关系是近年才刚刚开始研究的领域, 其与肝纤维化的关系渐渐被人们认识. Benedetti et al[18]最近的研究发现NHE对细胞的增殖、分化及凋亡的作用同样是适用于HSCs. HSCs的激活、细胞内pH值升高和NHE的激活密切相关. 现已证实, NHE不但介导多种细胞因子, 而且也介导脂质过氧化激活HSCs, 而且很可能是激活HSCs途径中的先后环节. Svegliati-Baroni et al[19]的实验表明氧应激可直接刺激NHE, 他们提出NHE在反应过程中起到中介的作用, 介导各种刺激(细胞因子、生长因子和氧应激等)对HSCs的作用, 促进细胞进入S相. 且提示阿米洛利通过抑制NHE而减弱增殖及胶原合成可作为治疗肝纤维化的一个新手段. Di Sario et al[20]利用分离培养的HSCs和肝纤维化大鼠模型评价选择性Na+-H+交换抑制剂卡立泊来德的作用, 结果显示: 选择性Na+-H+交换抑制剂卡立泊来德可作为肝纤维化治疗策略的一个方向, NHE被抑制后, 不但多种细胞因子不能激活HSCs, 而且脂质过氧化也不能激活HSCs.
杨伟峰 et al[21]观察联用NHE抑制剂阿米洛利与抗氧化剂姜黄素对大鼠纤维化形成的影响, 结果预防组可减轻脂质过氧化、抑制细胞外基质的合成和分泌, 二者对肝纤维化均有预防作用. 本实验选择HSCs-T6为研究对象, 通过MTT法评价姜黄素对HSCs的增殖影响, 发现姜黄素能明显抑制HSCs的增殖, 且抑制程度与其药物浓度有关; 通过ELISA法测定细胞上清的Ⅰ型胶原的含量, 姜黄素各剂量组与空白对照组相比差异具有显著性意义, 提示姜黄素能抑制HSCs合成Ⅰ型胶原; 且姜黄素可明显下调肝星状细胞NHE-1 mRNA表达. 本实验结果说明姜黄素不仅能抑制HSCs的增殖, 而且能抑制HSCs合成Ⅰ型胶原的量, 从而提示姜黄素有很好的抗肝纤维化作用, 其机制则可能与其能下调HSCs NHE mRNA的表达有关.
国外有报道, NHE-1介导细胞因子及氧应激激活HSCs, 激活NHE能促进细胞的增殖与分化, 反之抑制NHE则抑制细胞的增殖与分化, 并可诱导细胞的凋亡. HSCs的激活最终造成ECM在肝内过量积聚, 是肝纤维化发生的中心环节. NHE可能成为抗肝纤维化的重要靶点. 姜黄素对四氯化碳、D-氨基半乳糖及卡介苗加脂多糖诱导小鼠急性肝损伤有保护作用, 对四氯化碳诱导的大鼠肝纤维化有治疗作用, 可显著抑制HSCs的增殖和分泌ECM, 并诱导其凋亡.
徐列明, 教授, 上海中医药大学附属曙光医院(东部)肝二科
舒建昌 et al建立CCl4肝纤维化模型及HSCs培养, 通过在体实验和离体实验研究姜黄素对HSCs活化、增值及凋亡的影响, 探讨其抗肝纤维化的机制. 杨伟峰 et al联用Na+/H+交换泵抑制剂阿米洛利与姜黄素对大鼠纤维化形成的影响, 结果预防组可减轻脂质过氧化、抑制细胞外基质的合成和分泌, 二者对肝纤维化均有预防作用.
本实验结果说明姜黄素可明显下调肝星状细胞NHE-1 mRNA表达, 不仅能抑制HSCs的增殖, 而且能抑制HSCs合成Ⅰ型胶原的量, 从而提示姜黄素具有很好的抗肝纤维化作用, 其机制则可能与其能下调HSCs NHE mRNA的表达有关.
本研究选题有一定新意, 设计合理, 具有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 5. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 6. | Gäbele E, Brenner DA, Rippe RA. Liver fibrosis: signals leading to the amplification of the fibrogenic hepatic stellate cell. Front Biosci. 2003;8:d69-d77. [PubMed] [DOI] |
| 11. | Kang HC, Nan JX, Park PH, Kim JY, Lee SH, Woo SW, Zhao YZ, Park EJ, Sohn DH. Curcumin inhibits collagen synthesis and hepatic stellate cell activation in-vivo and in-vitro. J Pharm Pharmacol. 2002;54:119-126. [PubMed] [DOI] |
| 15. | Araújo CC, Leon LL. Biological activities of Curcuma longa L. Mem Inst Oswaldo Cruz. 2001;96:723-728. [PubMed] |
| 16. | 胡 泰洪, 徐 敏, 朱 锐, 刘 建国, 杨 玲. 从细胞外信号调节激酶-1 mRNA在肝纤维化大鼠肝组织中的表达来探讨姜黄素的治疗作用. 中西医结合肝病杂志. 2008;18:289-291. |
| 18. | Benedetti A, Di Sario A, Casini A, Ridolfi F, Bendia E, Pigini P, Tonnini C, D'Ambrosio L, Feliciangeli G, Macarri G. Inhibition of the NA(+)/H(+) exchanger reduces rat hepatic stellate cell activity and liver fibrosis: an in vitro and in vivo study. Gastroenterology. 2001;120:545-556. [PubMed] [DOI] |
| 19. | Svegliati-Baroni G, Di Sario A, Casini A, Ferretti G, D'Ambrosio L, Ridolfi F, Bolognini L, Salzano R, Orlandi F, Benedetti A. The Na+/H+ exchanger modulates the fibrogenic effect of oxidative stress in rat hepatic stellate cells. J Hepatol. 1999;30:868-875. [PubMed] [DOI] |
| 20. | Di Sario A, Bendia E, Taffetani S, Marzioni M, Candelaresi C, Pigini P, Schindler U, Kleemann HW, Trozzi L, Macarri G. Selective Na+/H+ exchange inhibition by cariporide reduces liver fibrosis in the rat. Hepatology. 2003;37:256-266. [PubMed] [DOI] |
| 21. | 杨 伟峰, 陈 厚昌. 联用阿米洛利与姜黄素预防大鼠肝纤维化的实验研究. 胃肠病学和肝病学杂志. 2003;12:424-426. |