修回日期: 2009-06-05
接受日期: 2009-06-08
在线出版日期: 2009-06-28
目的: 探讨白屈菜红碱对四氯化碳诱导肝纤维化大鼠肝脏组织转化生长因β1(TGF-β1)和α-平滑肌肌动蛋白(α-SMA)表达的影响.
方法: 用四氯化碳皮下注射, 同时联合营养控制和饮用100 mL/L乙醇复合法制备SD大鼠肝纤维化模型, 在实验第4周末, 肝纤维化模型建立(2期肝纤维化形成), 然后用低、中、高剂量白屈菜红碱(0.2、0.6、2.0 g/L)治疗, 同时实验设立病理模型组、空白对照和阳性对照(INF-γ)组. 给药8 wk后, 采用免疫组织化学检测各组大鼠肝脏组织TGF-β1和α-SMA的表达.
结果: 各剂量白屈菜红碱组肝脏TGF-β1和α-SMA表达明显低于病理模型组(TGF-β1: 6.08±2.35, 4.31±2.10, 4.7±1.70vs 9.33±3.08; α-SMA: 3.75±1.76, 3.23±1.42, 3.20±1.17 vs 6.67±2.29, 均P<0.01), 而与INF-γ组比较无明显差异(4.23±2.24, 3.38±1.39, 均P>0.05).
结论: 白屈菜红碱能降低四氯化碳诱导的肝纤维化大鼠模型肝脏组织TGF-β1和α-SMA.
引文著录: 李映菊, 汪煜华, 刘映霞. 白屈菜红碱对肝纤维化大鼠肝脏TGF-β1和α-SMA表达的影响. 世界华人消化杂志 2009; 17(18): 1821-1826
Revised: June 5, 2009
Accepted: June 8, 2009
Published online: June 28, 2009
AIM: To study the effects of chelerythine on TGF-β1 and α-SMA expression of CCl4 -induced hepatic fibrosis in rats.
METHODS: Models of hepatic fibrosis were established by hypodermic injection of tetrachloride, in combination with the control of nutrition and the drinking of 100 mL/L alcohol to rats. According to histological sections, hepatic fibrosis in rats emerged at the end of the fourth week. Subsequently different doses of chelerythine were used of hepatic fibrosis in rats. In addition, normal control group, fibrotic model group, γ-interform group in experiment was arranged. At the end of the eighth week, all the rats were executed. Transforming growth factor-β1 (TGF-β1) and α-smooth muscle actin (α-SMA) in liver were examined with the immunohistochemistrical technique.
RESULTS: The expression of TGF-β1 and α-SMA in liver of rats in fibrotic model group induced by CCl4 were ameliorated significantly compared with the model group (TGF-β1: 6.08 ± 2.35, 4.31 ± 2.10, 4.7 ± 1.70 vs 9.33 ± 3.08; α-SMA: 3.75 ± 1.76, 3.23 ± 1.42, 3.20 ± 1.17 vs 6.67 ± 2.29, all P < 0.01). The expression of TGF-β1 and α-SMA in liver was not obviously different between all chelerythine groups and γ-INF group (4.23 ± 2.24, 3.38 ± 1.39, both P > 0.05).
CONCLUSION: Chelerythine can decrease the expression of TGF-β1 as well as α-SMA CCl4 -induced hepatic fibrosis in rats.
- Citation: Li YJ, Wang YH, Liu YX. Effects of chelerythine on hepatic TGF-β1 and α-SMA expression in rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1821-1826
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1821.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1821
白屈菜红碱(chelerythine)是从民间中草药博落回提取的活性生物碱, 为异喹啉衍生物碱. 近年有研究者发现白屈菜红碱可通过下调转化生长因子β1(transforming growth factor-β1, TGF-β1)引起的血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)的表达而抑制腹腔间皮细胞产生的纤维化[1]. 本研究旨在观察白屈菜红碱对大鼠肝纤维化动物模型肝脏表达TGF-β1和α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)表达的影响.
白屈菜红碱购自Alomone公司. 注射用重组人IFN-γ由上海克隆生物高技术有限公司提供, 临用前用1 mL注射用水溶解后作肌肉注射. TGF-β1一抗, 兔抗人、兔、鼠TGF-β1多克隆抗体(1:100稀释, 批号BA0290)为博士德(生物有限)公司产品. 中杉公司EDTA抗原修复液(pH 9.0), 高温修复. 基因公司(DakoCytomation)鼠抗人平滑肌肌动蛋白(SMA) mAb, 批号M0851, 1:200稀释. 迈新公司柠檬酸一盐修复液(pH 7.2), 高温修复. 显微照相系统和IX70倒置显微镜为日本Olympus公司生产.
1.2.1 分组及处理: ♂SD大鼠100只, 体质量200±20 g, 清洁级, 由本校生命科学院动物中心提供. 实验前先适应性喂养2 wk, 大鼠可在半屏蔽系统中自由获取水和食物. 随机分出10只SD大鼠作为正常对照组(A组, n = 10), 余90只用作肝纤维化动物模型的制备. 动物模型制备: 将CCl4与纯花生油以4:6配成400 mL/L油剂, 第1次按0.5 mL/100 g皮下注射, 以后按0.3 mL/100 g皮下注射, 每周2次. 自实验第2周开始, 采取营养控制和加入酒精摄入以加快肝纤维化动物模型的形成(以玉米面为饲料, 加0.5%胆固醇的高脂低蛋白食物, 以100 mL/L乙醇为唯一饮料). 从第2周开始, 每周末处死5只大鼠, 取肝脏组织作肝纤维化病理学检查, 按照2000年西安会议《病毒性肝炎防治方案》肝纤维化分期标准来判断肝纤维化程度[2]. 以后继续应用CCl4与纯花生油油剂联合营养控制和乙醇摄入喂养动物, 直到实验的第12周. 在实验第4周末, 大鼠肝纤维化模型建成(即2期肝纤维化形成), 将剩余75只SD大鼠, 按照随机表编号分为病理模型组模型组(B组, n = 15)、IFN-γ组(C组, n = 15)、白屈菜红碱小、中、大剂量组(D组、E组、F组, n = 15). IFN-γ组10万U/(kg·d), 肌注, 连用8 wk; 后3组分别用浓度为2.0、0.6、0.2 g/L白屈菜红碱按0.1 mL/(100 g·d)腹腔注射, 连用8 wk; 模型对照组、正常对照组以同等剂量的, 生理盐水腹腔注射, 连续治疗8 wk. 治疗期间继续使用CCl4维持大鼠肝纤维化程度直到实验结束. 治疗8 wk后麻醉SD大鼠, 解剖取肝脏, 观察药物肝纤维化大鼠肝脏TGF-β1和α-SMA的表达的影响.
1.2.2 实验结束时取材和处理: 实验第12周末, 麻醉SD大鼠, 解剖取肝脏, 取每只大鼠肝左叶的相同部位, 大小约5 mm×5 mm×5 mm, 40 g/L甲醛溶液固定, 常规石蜡包埋, 连续切片, 厚3 μm, 用免疫组织化学肝脏检查TGF-β1和α-SMA的表达.
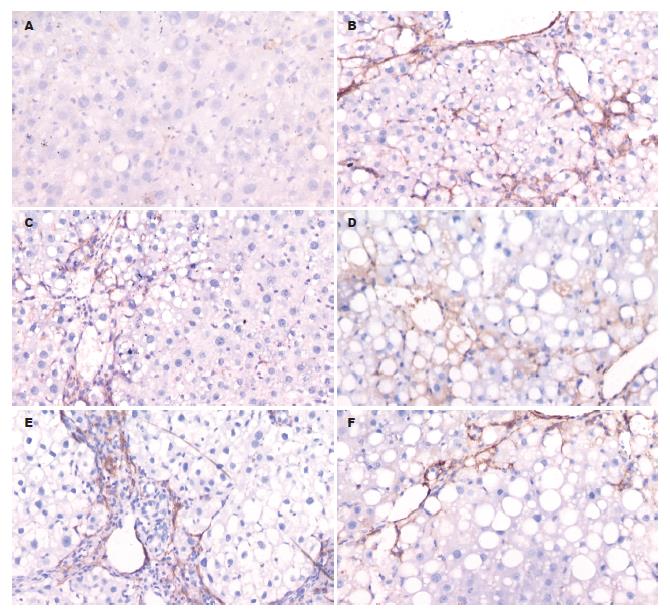
1.2.3 α-SMA免疫组织化学染色: 切片置60 ℃烘箱过夜; 二甲苯脱蜡, 酒精梯度水化; PBS(pH 7.4)冲洗3次, 每次5 min; 入0.01 mol/L柠檬酸修复液10 min, 保持温度92-95 ℃; PBS(pH 7.4)冲洗3次, 每次5 min; 入30 mL/L H2O2 15 min; PBS(pH 7.4)冲洗3次, 每次5 min; 滴加100 mL/L羊血清于37 ℃孵育30 min; 加一抗(l:100), 于4 ℃冰箱过夜; 次日, PBS(pH 7.4)冲洗3次, 每次5 min; 加二抗于37 ℃孵育30 min, PBS(pH 7.4)冲洗3次, 每次5 min; 滴加SABC液37 ℃孵育15 min, PBS(pH 7.4)冲洗3次, 每次5 min; DAB显色2 min; 自来水终止反应5 min; 苏木素复染核, 1%盐酸-乙醇分色, 梯度酒精脱水; 二甲苯透明、中性树胶封片.
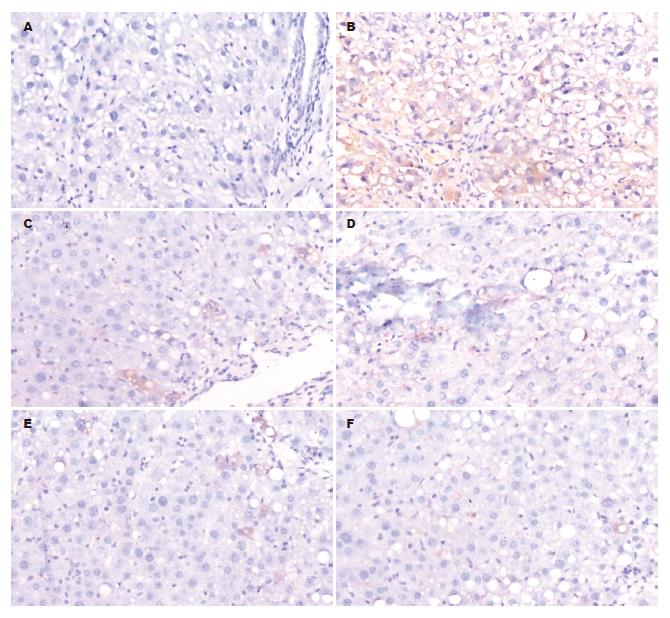
1.2.4 TGF-β1免疫组化染色: (1)脱蜡: 切片常规二甲苯脱蜡3次, 每次10 min; (2)水化: 1000、900、800 mL/L乙醇各5 min; (3)抗原修复: 将切片浸入0.01 mol/L柠檬酸修复液(pH 6.0), 微波炉加热至沸腾后断电, 间隔5 min后, 反复1次; 冷却后0.01 mol/L PBS(pH 7.4)洗涤5 min×3; (4)灭活内源性过氧化物酶: 30 mL/L H2O2室温15 min, 灭活内源性过氧化物酶, PBS洗5 min×3; (5)封闭: 滴加100 g/L山羊血清封闭液, 室温30 min, 甩去多余液体, 不洗; (6)孵育一抗: 滴加兔抗鼠TGF-β1一抗(l:100), 4 ℃过夜, PBS洗5 min×3; (7)孵育二抗: 滴加生物素化羊抗兔IgG, 37 ℃孵育30 min, PBS洗5 min×3; (8)SABC: 滴加试剂SABC, 37 ℃孵育15 min, PBS洗5 min×4; (9)DAB显色, 显微镜观察, 流水漂洗终止反应, 苏木素复染核; (10)1%盐酸-乙醇分色, 梯度酒精脱水、二甲苯透明、中性树胶封片. PBS缓冲液替代一抗作阴性对照, 博士德公司提供切片作阳性组织对照. TGF-β1阳性细胞为细胞质染成棕黄色.
1.2.5 免疫组织化学评定标准: α-SMA、TGF-β1每张切片均由2位病理科主任医师分别观察5个显色较好的高倍镜视野, 分别记录显色程度和显色范围. 显色程度分弱、中、强, 用(+)、(++)、(+++)记录; 显色范围占高倍视野<1/4时记录为(+), -2/4为(++), -3/4为(+++), >3/4为(++++). 然后按以下公式计算, 显色指数 = 显色程度×显色范围(+, ++, +++, ++++分别按1, 2, 3, 4分计算). 2位医师的检查结果取均数为每一种蛋白表达的最终显色指数.
统计学处理 实验数据采用SPSS13.0统计软件处理, 计量资料采用用方差分析和LSD检验. 以P<0.05确定差异有统计学意义.
在实验12 wk结束, 正常对照组10只均存活, 模型组死亡6只, IFN-γ组死亡2只, 白屈菜红碱大、中、小剂量组分别死亡3、2、5只. 大鼠肝组织α-SMA. TGF-β1蛋白表达以细胞胞质为主, 着色为黄色或棕黄色. 病理模型组和各给药组大鼠肝组织α-SMA的表达较正常对照组明显升高(P<0.01), 白屈菜红碱大中小剂量组和IFN-γ组α-SMA计分较模型组显著降低(P<0.01), 白屈菜红碱各剂量组与IFN-γ组无显著性差异(P>0.05), 白屈菜红碱各剂量组之间亦无显著性差异(P>0.05). 各给药组大鼠和病理模型组肝组织TGF-β1的表达较正常对照组明显升高(P<0.01), 白屈菜红碱大中小剂量组和IFN-γ组计分较模型组显著降低(P<0.01), 白屈菜红碱各剂量组与IFN-γ组无显著性差异(P>0.05), 白屈菜红碱各剂量组之间亦无显著性差异(P>0.05, 表1, 图1-2).
肝纤维化其实质是肝内以胶原为主的肝脏细胞外基质(extracellular matrix, ECM)各成分合成增多, 降解相对不足, 致使ECM在肝内过多沉积. 肝纤维化进一步发展可引起肝小叶结构改建、假小叶及结节形成导致肝硬化, 甚至少数还可以发展为肝癌, 严重威胁人类健康. 目前认为ECM累积所形成的肝纤维化通过有效的治疗是可以逆转的, 但若没有得到及时有效的治疗, 则最终发展为不可逆转的肝硬化[3]. 因此, 如何有效地防治肝纤维化, 阻断其进展, 已经成为国内外研究的热点.
随着医学分子生物学技术的运用, 对肝纤维化发生机制进行了广泛探讨, 其形成的细胞和分子机制研究取得了很大进展, 并有了不少新认识[4-12]. 目前已清楚, 肝脏纤维化过程中ECM的聚集不是静止的, 而是一个动态的过程. 目前公认的肝纤维化形成机制是从肝星状细胞(hepatic stellate cells, HSCs)的瀑布样激活效应开始的. "三步激活模式"于1995年由德国Gressner et al[13]提出, 现已被广泛接受并已列入Oxford Text Book of Clinical Hepatology. HSCs是肝纤维化时细胞外基质产生的主要来源细胞, 肝星状细胞活化激活在肝纤维化的发生、发展中起关键的作用, 各种细胞因子通过自分泌和/或旁分泌机制实现对HSCs的调控. 因此, HSCs活化是肝纤维化形成的关键. 任何病因致肝损伤后, HSCs从含VitA丰富的静止状态经过激活过程, 转变成具增生活性的、产生纤维的具收缩特性的肌成纤维细胞, 并表达α-SMA, 合成大量ECM, 因此, α-SMA被认为是HSCs活化的标志[14]. 细胞因子在肝纤维化发展及消退的各个阶段起重要作用. TGF-β被认为是最强的肝纤维化促进剂, TGF-β在肝纤维化的HSC的"早期启动"及"激活的持久化"均起重要作用, 是肝损伤后全面促进肝纤维化中的一个关键细胞因子[15]. 目前一些学者认为抗肝纤维化的治疗主要要针对HSCs和TGF-β[16].
目前, 临床虽然已有一些治疗肝纤维化的中西药物, 但疗效还不够理想, 而且有些药物不良反应较大, 费用较高, 所以国内外的研究者都在努力寻找疗效确切、价格低廉、不良反应小的防治肝纤维化药物, 以便能阻止和逆转肝纤维化的进程, 最终治愈大多数慢性肝病. 我国天然药物资源丰富, 以成为众多药物开发的重要源头. 自植物药中分离提取有活性、低毒的单体药物, 可能会给抗纤维化治疗提供新的希望. 白屈菜红碱(chelerythine)是从民间中草药博落回提取的活性生物碱. 近年有研究者发现白屈菜红碱可通过下调TGF-β引起的VEGF的表达而抑制腹腔间皮细胞产生的纤维化[1]. 但目前白屈菜红碱抗纤维化作用在整体动物的研究尚未见报道. 我们前期实验已证实白屈菜红碱明显减轻CCl4诱导的肝纤维化大鼠模型的纤维化. 本实验通过CCl4联合营养控制和饮用100 mL/L乙醇复合法制备SD大鼠肝纤维化模型[17-18], 在2期肝纤维化形成后, 用白屈菜红碱干预治疗. 实验显示肝脏组织细胞因子TGF-β1和α-SMA表达在白屈菜红碱生物碱大、中、小剂量组中改善非常明显, 与模型组比较有显著差异(P<0.01). 而TGF-β1是肝纤维化最关键的细胞因子, α-SMA是HSCs活化的标志, 肝脏细胞因子TGF-β1和α-SMA在实验中的改变, 提示白屈菜红碱抗CCl4诱导的大鼠肝纤维化, 有可能是通过细胞因子介导或是作用HSCs起作用.
白屈菜红碱是蛋白激酶C的抑制剂[19], 而蛋白激酶C是细胞因子发挥作用的一个重要的信号通路; 白屈菜红碱还可以通过多种途径促进细胞凋亡[20]. 是否白屈菜红碱生物碱是通过下调TGF-β来起到抗肝纤维化作用, 或/和是通过引起HSC凋亡, 或有其他靶点同时存在有待于进一步验证.
慢性肝病, 尤其是肝硬化严重危害人类健康. 我国是慢性肝病的高发区域, 病毒性肝炎、酒精性肝病和血吸虫病是引起我国慢性肝病的三大主要原因, 其发病慢性乙型肝炎排在首位. 肝纤维化是慢性肝病向肝硬化发展的中心环节, 肝纤维化可以逆转, 而肝硬化已不可逆转. 因此, 如何有效地防治肝纤维化, 阻断其进展, 已经成为国内外研究的热点.
党双锁, 教授, 西安交通大学第二医院感染科
目前, 临床虽然已有一些治疗肝纤维化的中西药物, 但疗效还不够理想, 而且有些药物不良反应较大, 费用较高, 所以国内外的研究者都在努力寻找疗效确切、价格低廉、不良反应小的防治肝纤维化药物, 以便能阻止和逆转肝纤维化的进程, 最终治愈大多数慢性肝病.
有研究者发现白屈菜红碱可通过下调TGF-β引起的VEGF的表达而抑制腹腔间皮细胞产生的纤维化, 且本课题组前期实验已证实白屈菜红碱明显减轻CCl4诱导的肝纤维化大鼠模型的纤维化.
白屈菜红碱能降低四氯化碳诱导的肝纤维化大鼠模型肝脏组织TGF-β1和α-SMA.
本实验设计合理, 结果可靠, 研究结果对于了解白屈菜红碱的抗纤维化作用有意义.
编辑: 李军亮 电编: 何基才
| 1. | Szeto CC, Lai KB, Chow KM, Szeto CY, Wong TY, Li PK. Differential effects of transforming growth factor-beta on the synthesis of connective tissue growth factor and vascular endothelial growth factor by peritoneal mesothelial cell. Nephron Exp Nephrol. 2005;99:e95-e104. [PubMed] [DOI] |
| 3. | Okazaki I, Watanabe T, Hozawa S, Niioka M, Arai M, Maruyama K. Reversibility of hepatic fibrosis: from the first report of collagenase in the liver to the possibility of gene therapy for recovery. Keio J Med. 2001;50:58-65. [PubMed] |
| 4. | Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis. Mechanisms and treatment strategies. N Engl J Med. 1993;328:1828-1835. [PubMed] [DOI] |
| 5. | Olaso E, Friedman SL. Molecular regulation of hepatic fibrogenesis. J Hepatol. 1998;29:836-847. [PubMed] [DOI] |
| 6. | Friedman SL, Maher JJ, Bissell DM. Mechanisms and therapy of hepatic fibrosis: report of the AASLD Single Topic Basic Research Conference. Hepatology. 2000;32:1403-1408. [PubMed] [DOI] |
| 7. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 9. | Gressner OA, Weiskirchen R, Gressner AM. Biomarkers of hepatic fibrosis, fibrogenesis and genetic pre-disposition pending between fiction and reality. J Cell Mol Med. 2007;11:1031-1051. [PubMed] [DOI] |
| 10. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 11. | 哈 明昊, 饶 慧瑛, 刘 峰, 潘 孝本, 封 波, 陈 红松, 魏 来. 乙型肝炎病毒促进CTGF和TGF-β1在肝星状细胞中的表达. 世界华人消化杂志. 2008;16:924-928. [DOI] |
| 13. | Gressner AM. Transdifferentiation of hepatic stellate cells (Ito cells) to myofibroblasts: a key event in hepatic fibrogenesis. Kidney Int Suppl. 1996;54:S39-S45. [PubMed] |
| 15. | Inuzuka S, Ueno T, Torimura T, Tamaki S, Sugawara H, Sakata R, Kusaba N, Sata M, Tanikawa K. The significance of colocalization of plasminogen activator inhibitor-1 and vitronectin in hepatic fibrosis. Scand J Gastroenterol. 1997;32:1052-1060. [PubMed] [DOI] |
| 16. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 17. | Pinzani M, Rombouts K, Colagrande S. Fibrosis in chronic liver diseases: diagnosis and management. J Hepatol. 2005;42 Suppl:S22-S36. [PubMed] [DOI] |
| 18. | Goldani HA, Matte US, Ramos AR, Costa TG, Winkelmann LV, Meurer L, Vieira SM, Kieling CO, Silveira TR. The role of food restriction on CCl4-induced cirrhosis model in rats. Exp Toxicol Pathol. 2007;58:331-337. [PubMed] [DOI] |
| 19. | Kim J, Lin J, Adam RM, Lamb C, Shively SB, Freeman MR. An oxidative stress mechanism mediates chelerythrine-induced heparin-binding EGF-like growth factor ectodomain shedding. J Cell Biochem. 2005;94:39-49. [PubMed] [DOI] |
| 20. | Adhami VM, Aziz MH, Reagan-Shaw SR, Nihal M, Mukhtar H, Ahmad N. Sanguinarine causes cell cycle blockade and apoptosis of human prostate carcinoma cells via modulation of cyclin kinase inhibitor-cyclin-cyclin-dependent kinase machinery. Mol Cancer Ther. 2004;3:933-940. [PubMed] |