修回日期: 2009-04-10
接受日期: 2009-04-20
在线出版日期: 2009-06-08
目的: 对比分析肝纤维化患者和健康人血清中差异表达的蛋白质, 筛选与肝纤维化发生密切相关的血清蛋白质.
方法: 肝纤维化患者和健康人空腹血清标本各6例分别等量混合成2个样本, 去除血清中的白蛋白和IgG. 利用双向凝胶电泳(2-DE)分离肝纤维化血清和健康人血清总蛋白质后, 硝酸银染色, 经图像分析筛选差异表达的蛋白点. 应用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)鉴定差异表达的蛋白点, 并用ELISA法对其中部分差异蛋白的表达水平进行验证.
结果: 筛选出2组间的差异蛋白点共517个, 对其中表达量差异3倍以上的24个蛋白点进行MALDI-TOF-MS分析, 鉴定出包括触珠蛋白、载脂蛋白A-Ⅳ、转铁蛋白、T细胞受体β链、血清白蛋白及血清白蛋白前体等8个蛋白质, 其中3个蛋白质在肝纤维化血清中表达上调, 5个蛋白质在肝纤维化血清中表达下调. 与健康人血清比较, ELISA法检测肝纤维化血清中触珠蛋白、载脂蛋白A-Ⅳ表达均下调, 结果与双向凝胶电泳一致.
结论: 肝纤维化血清与健康人血清的蛋白质表达谱表现出一定差异, 这些差异表达的血清蛋白质有望成为肝纤维化诊断与判定预后的血清标志物.
引文著录: 罗新华, 程明亮, 杨勤, 张权. 肝纤维化患者血清差异蛋白质的筛选. 世界华人消化杂志 2009; 17(16): 1672-1675
Revised: April 10, 2009
Accepted: April 20, 2009
Published online: June 8, 2009
AIM: To compare and analyze the expression difference of proteins between hepatic fibrosis serum and normal human serum and to identify potential serum markers for human hepatic fibrosis.
METHODS: Serum samples were collected from 6 healthy subjects and 6 patients with hepatic fibrosis following normal protocols. The serum samples of these two groups were mixed into one respectively of equal volume. Albumin and IgG removal were carried out and serum total proteins were extracted. 2-DE was used to isolate the total proteins using pH 4-7 L, 18 cm IPG strip, and SDS-PAGE. Silver nitrate stain was applied afterwards. ImageMaster 2D Platinum Softwared (Version 5) was employed to analyze the 2-DE results. ELISA was adopted to verify the expression changes of some differential proteins.
RESULTS: The 2-DE matching rate was 89.58% between the two groups. From the two groups, 517 differential protein spots were identified, among which 24 with differential expression above three times were singgled out and MALDI-TOF-MS analysis was carried out on them. Eight proteins were identified, including transferring, apolipoprotein A-IV, T-cell receptor b, haptoglobin, serum albumin and serum albumin precursor. Up-regulated expression was observed in 3 proteins and down-regulated expression in 5 proteins in the hepatic fibrosis serum group. As compared with that in normal serum, haptoglobin and apolipoprotein A-IV expression were down-regulated in hepatic fibrosis serum, which was consistent with the results of 2-DE.
CONCLUSION: Compared with the normal subject group, the serum in the hepatic fibrosis group showed differential expression in protein profile. The proteins of differential expression are expected to be the serum markers for hepatic fibrosis.
- Citation: Luo XH, Cheng ML, Yang Q, Zhang Q. Screening of differential serum proteins in patients with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1672-1675
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1672.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1672
肝纤维化的血清学指标检测由于其无创、易于动态监测疾病发展, 近年日益受到国内外学者的广泛关注并在此领域进行了大量的探索. 但目前肝纤维化的血清相关标志物对肝纤维化诊断的特异性、敏感性、准确性、阳性和阴性预测值尚不尽如人意, 还不能真实反映肝纤维化的实际状况[1-2]. 血清蛋白质组学以血清整体蛋白质成分的变化为研究对象, 从而能获得更加标准化的功能相关的蛋白标志物, 其高通量、高效率的特性为肝纤维化研究带来了新的思维方式. 其可以全面、动态地分析患者血清样品中蛋白质种类及数量的改变, 有助于寻找与疾病诊断及预后相关的标志物及药物治疗的靶点[3]. 为此, 我们以经肝穿刺活检证实的肝纤维化患者为研究对象, 运用血清蛋白质组学技术对比研究其血清与正常人血清蛋白质组表达的差异, 以期筛选出人肝纤维化敏感特异的血清标志物, 为肝纤维化的无创诊断提供新的思路.
6例肝纤维化患者血清来源于2005-10/2007-06贵州省人民医院感染科经肝穿刺活检证实为肝纤维化3-4级的患者, 肝组织病理诊断符合2000年病毒性肝炎防治方案中肝纤维化的诊断标准. 空腹血清采集于肝穿当日清晨, 排除HCV感染、长期大量饮酒史及全身性疾病. 其中男4例, 女2例, 平均年龄41.7±4.8岁. 6例健康人空腹血清来源于贵阳医学院附属医院体检中心健康志愿者, B超提示肝脏形态正常, 排除HBV、HCV感染及长期大量饮酒史, 其中男4例, 女2例, 平均年龄38.8±5.6岁. 所有样本均符合人体实验伦理学标准, 征得患者知情同意并签署知情同意书. 超纯尿素、硫脲、苯甲基磺酰氟、二硫苏糖醇、碘乙酰胺, 固相pH 梯度干胶条(美国Bio-Rad公司), 十二烷基硫酸钠、甲叉双丙烯酰胺、α-氰基-4-羟基肉桂酸、乙腈(美国Sigma公司), 胰蛋白酶(美国Promega公司), Albumin/IgG Removal Kit(德国Merck公司), 人载脂蛋白A-Ⅳ ELISA试剂盒(武汉中美科技有限公司)、人触珠蛋白ELISA试剂盒(上海麦莎生物科技有限公司), 硝酸银、三水乙酸钠、戊二醛为国产试剂. Ettan IPG phor Ⅱ等电聚焦系统、Ettan DALT 12垂直电泳系统(美国GE公司), Autoflex MALDI-TOF质谱仪(德国Bruker公司), Multiskan全自动多功能酶标仪(芬兰Labsystem).
1.2.1 样本处理: 空腹全血2 mL提取血清; 血清中加蛋白酶抑制剂0.1 mol/L PMSF, 使其终浓度达到1 mmol/L; 再加入0.5 mol/L EDTA, 使其终浓度达到2 mmol/L; -80 ℃冰箱保存备用. 同组血清等量混合后, 按Albumin/IgG Removal Kit说明书操作去除白蛋白和IgG, 上清液进行Bradford法蛋白定量.
1.2.2 双向凝胶电泳: 参照IPGphor等电聚焦系统指南和Görg et al[4]的方法加以改进. 选用pH 4-7 L的18 cm线性IPG干胶条, 上样量150 μg进行再水化、等电聚焦, 总电压为72000 V/h. 胶条平衡后, 进行120 g/L SDS-PAGE电泳.
1.2.3 硝酸银染色: 凝胶取出后, 经固定、敏化、硝酸银染色后至蛋白点显示清晰, 中止染色.
1.2.4 图像分析: 透射扫描凝胶获取图像后, 利用图像分析软件对图像蛋白质斑点自动检测, 手工删除、添加斑点, 匹配, 筛选出在两种组织中差异表达的蛋白质.
1.2.5 制备质谱样品及质谱分析: 切取差异蛋白质点, 再脱色、还原、烷基化、酶解、样品回收及脱盐处理. 然后在MALDI-TOF质谱仪上分析, 激光波长337 nm, 加速电压为20 kV, 以基质峰和胰蛋白酶自动降解离子峰作为内部标准校正, 对肽质量指纹图谱进行校正, 获得蛋白质点的准确肽质量指纹数据.
1.2.6 数据库查询: 应用Mascot搜索引擎, 选用NCBlnr数据库进行查询. 搜索条件设置肽片断质量最大误差控制在±1×10-4, 酶切断裂位点允许值为1. 结合蛋白质点的等电点、分子质量、匹配片段的多少以及氨基酸序列进行蛋白质鉴定.
1.2.7 血清载脂蛋白A-Ⅳ、触珠蛋白水平测定: 采用ELISA法进行检测, 操作严格按试剂盒说明书进行.
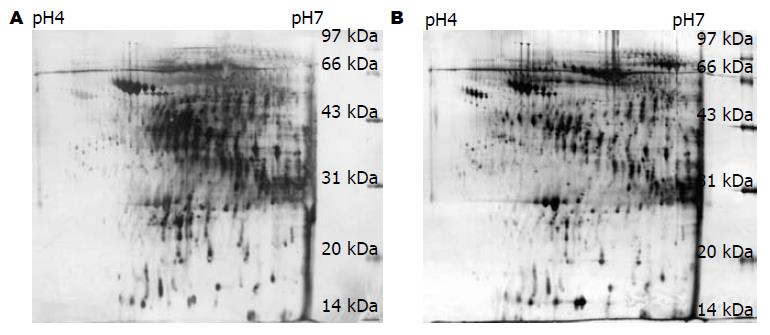
6例同组血清样本等量混合后, 同时进行3次双向凝胶电泳, 分别获得3块分辨率高、重复性好的平行胶. 2组蛋白表达谱类似, 蛋白多集中在pH 5.5-6.5间区域. 肝纤维化血清及正常人血清2-DE平均蛋白点数, 分别为924±16个和962±21个(图1), 两种血清的匹配率为89.58%. 筛选出2组间差异蛋白点517个, 其中表达量差异3倍以上的蛋白点共24个, 包括肝纤维化组表达上调的蛋白点12个, 表达下调的蛋白点12个.
对2组血清差异3倍以上的24个蛋白点进行MALDI-TOF-MS分析, 共鉴定出载脂蛋白A-Ⅳ、触珠蛋白、转铁蛋白、T细胞受体β、白蛋白、白蛋白前体等8个蛋白质, 其中3个在肝纤维化血清中表达上调, 5个在肝纤维化血清中表达下调(表1).
| 编号 | 肽段匹配率 | 序列覆盖率(%) | 相对分子质量 | 等电点 | 蛋白质名称 | 肝纤维化血清中的表达 |
| 173 | 6/40 | 25 | 34 356 | 5.99 | T细胞受体β | 上调 |
| 220 | 7/21 | 37 | 23 884 | 6.59 | 免疫球蛋白A | 上调 |
| 300 | 7/15 | 34 | 27 670 | 6.39 | 白蛋白 | 下调 |
| 319 | 11/17 | 26 | 48 641 | 5.97 | 白蛋白前体 | 下调 |
| 368 | 7/22 | 21 | 48 669 | 6.67 | 转铁蛋白 | 下调 |
| 446 | 12/49 | 33 | 45 307 | 5.23 | 载脂蛋白A-Ⅳ | 下调 |
| 451 | 11/21 | 32 | 38 868 | 6.26 | 触珠蛋白 | 下调 |
| 499 | 25/65 | 46 | 67 988 | 5.69 | 肉豆蔻酸白蛋白复合物 | 上调 |
本研究通过肝纤维化患者与健康人血清2-DE胶图的比较, 寻找出部分差异表达的蛋白, 发现并了解这些蛋白质在肝纤维化患者血清中的变化, 将有助于对肝纤维化早期特异且敏感的生物学标志物的筛选.
触珠蛋白作为一种急性期蛋白, 在宿主抗感染、损伤组织的修复以及内环境稳定的过程中起着重要作用. 此外, 触珠蛋白尚有抗氧化活性、抑制前列腺素合成、抑制细菌、促进血管生成及重要的免疫作用. 触珠蛋白主要在肝脏合成和降解, 当肝实质的广泛受损, 肝脏合成触珠蛋白的功能低下[5-6]. 本实验通过2-DE筛查发现, 触珠蛋白在肝纤维化血清中表达降低, 与ELISA结果检测一致. 推测由于在肝纤维化时, 肝实质受损, 肝脏合成触珠蛋白减少所致. 因此, 血清触珠蛋白的减少可作为临床上诊断肝纤维化的一个标志.
载脂蛋白A-Ⅳ是20世纪70年代后期发现的一种糖蛋白, 主要在空肠、回肠及下丘脑合成, 具有调节摄食、抗动脉粥样硬化、抗氧化、调节胃动力等作用[7-8]. 在硫代乙酰胺诱导的肝纤维化大鼠, 载脂蛋白A-Ⅳ在基因水平出现下调[9]. 近来一些学者运用蛋白质组学技术研究发现, 载脂蛋白A-Ⅳ在丙肝后肝纤维化及实验性肝纤维化血清中表达下降[10-11], 与我们的研究结果一致. 提示载脂蛋白A-Ⅳ可能与肝纤维化的发生有关, 对患者血清载脂蛋白A-Ⅳ表达水平的监测将有助于对肝纤维化的诊断.
血清转铁蛋白(transferrin)是血清中β2球蛋白与铁结合的一种复合体, 主要由肝脏合成. 血清转铁蛋白具有运铁、调节铁的吸收和防止铁的毒性作用, 还能促进肝细胞的再生. 因此, 肝脏发生病变时, 血清转铁蛋白含量会随之产生变化[12]. 我们通过双向凝胶电泳实验也发现肝纤维化血清中转铁蛋白表达下降, 这可能由于肝细胞损伤后, 肝脏合成转铁蛋白能力下降所致.
血清白蛋白具有脂肪酸的结合位点, 可以结合脂肪酸[13]. 有研究证实酒精性肝病时, 血清中的饱和脂肪酸, 尤其是肉豆蔻酸含量显著增加[14]. Eun et al运用血清蛋白质组学方法研究韧带骨化, 发现血清中肉豆蔻酸白蛋白复合物表达上调[15]. 我们在肝纤维化血清中, 也发现肉豆蔻酸与白蛋白结合的复合物表达上调, 可能是由于肝纤维化时脂肪酸代谢紊乱所致. 因此, 我们可考虑将肉豆蔻酸白蛋白复合物作为肝纤维化患者潜在的血清标志物进行后续研究.
本研究利用蛋白质组学研究技术对肝纤维化患者与正常人血清的差异蛋白进行了初步鉴定, 获得了触珠蛋白和载脂蛋白A-Ⅳ等8个差异蛋白质, 进一步评价这些血清差异蛋白作为肝纤维化诊断候选标志物的可靠性, 还需继续扩大样本量、鉴定数据和结合其他方法进行后续研究, 但本次研究结果为寻找肝纤维化患者早期血清敏感特异标志物提供了可靠依据.
肝纤维化是各种慢性肝病的共同病理基础, 其早期诊断仍是临床一大难题. 回顾这一领域的发展, 肝纤维化的诊断从临床诊断到辅助诊断如血液生化、超声、影像学检查, 肝活组织病理检查仍然是目前诊断肝纤维化最可靠的方法. 但因其取材局限, 有创伤, 不便常规随访及动态观察, 临床应用受到极大限制, 迫切需要寻找简单且易推广、特异性、敏感性高的肝纤维化无创伤性诊断指标.
陈红松, 研究员, 北京大学人民医院肝病研究所
White et al利用2-DE和LC-MS技术对比研究丙型肝炎肝纤维化患者和正常人血清, 发现7个差异表达的蛋白质, 其中载脂蛋白A-Ⅳ在丙肝肝纤维化患者血清中表达下降.
本研究运用血清蛋白质组学技术对肝纤维化患者与健康人血清进行检测, 从整体上对两者之间差异表达的蛋白质进行分析, 发现触珠蛋白、载脂蛋白A-Ⅳ可能是肝纤维化早期特异且敏感的生物学标志物.
深入研究这些差异表达的蛋白质在肝纤维化发生发展过程中的作用, 将为肝纤维化的无创性诊断提供新的思路.
本文旨在利用差异蛋白组学技术寻找乙型肝炎肝纤维化的血清标志物, 以期发现肝纤维化的无创诊断标志物, 具有一定的科学价值和临床意义, 但是创新性略显不足.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Pinzani M, Rombouts K, Colagrande S. Fibrosis in chronic liver diseases: diagnosis and management. J Hepatol. 2005;42 Suppl:S22-S36. [PubMed] [DOI] |
| 2. | Cheng ML, Yang CQ. Hepatic Fibrosis. 1st ed. Beijing: People's Medical Publishing House 2007; 221-229. |
| 3. | Petricoin EF, Rajapaske V, Herman EH, Arekani AM, Ross S, Johann D, Knapton A, Zhang J, Hitt BA, Conrads TP. Toxicoproteomics: serum proteomic pattern diagnostics for early detection of drug induced cardiac toxicities and cardioprotection. Toxicol Pathol. 2004;32 Suppl 1:122-130. [PubMed] [DOI] |
| 4. | Görg A, Obermaier C, Boguth G, Harder A, Scheibe B, Wildgruber R, Weiss W. The current state of two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis. 2000;21:1037-1053. [PubMed] [DOI] |
| 5. | Langlois MR, Delanghe JR. Biological and clinical significance of haptoglobin polymorphism in humans. Clin Chem. 1996;42:1589-1600. [PubMed] |
| 6. | Carter K, Worwood M. Haptoglobin: a review of the major allele frequencies worldwide and their association with diseases. Int J Lab Hematol. 2007;29:92-110. [PubMed] [DOI] |
| 7. | Stan S, Delvin E, Lambert M, Seidman E, Levy E. Apo A-IV: an update on regulation and physiologic functions. Biochim Biophys Acta. 2003;1631:177-187. [PubMed] |
| 8. | Tso P, Liu M. Apolipoprotein A-IV, food intake, and obesity. Physiol Behav. 2004;83:631-643. [PubMed] [DOI] |
| 9. | Utsunomiya T, Okamoto M, Hashimoto M, Yoshinaga K, Shiraishi T, Tanaka F, Mimori K, Inoue H, Watanabe G, Barnard GF. A gene-expression signature can quantify the degree of hepatic fibrosis in the rat. J Hepatol. 2004;41:399-406. [PubMed] [DOI] |
| 10. | Liu J, Wang JY, Wei LM, Lu Y, Jin H. [Effects of Fuzheng Huayu Decoction on plasma proteome in cirrhosis: preliminary experimental study with rats]. Zhonghua Yixue Zazhi. 2007;87:1272-1275. [PubMed] |
| 11. | White IR, Patel K, Symonds WT, Dev A, Griffin P, Tsokanas N, Skehel M, Liu C, Zekry A, Cutler P. Serum proteomic analysis focused on fibrosis in patients with hepatitis C virus infection. J Transl Med. 2007;5:33. [PubMed] [DOI] |
| 13. | Fujiwara S, Amisaki T. Molecular dynamics study of conformational changes in human serum albumin by binding of fatty acids. Proteins. 2006;64:730-739. [PubMed] [DOI] |
| 14. | Shiraishi K, Matsuzaki S, Itakura M, Ishida H. Abnormality in membrane fatty acid compositions of cells measured on erythrocyte in alcoholic liver disease. Alcohol Clin Exp Res. 1996;20:56A-59A. [PubMed] [DOI] |