修回日期: 2009-05-08
接受日期: 2009-05-11
在线出版日期: 2009-06-08
目的: 研究幽门螺杆菌(H pylori)cagA、iceA基因及其不同组合对H pylori感染结局的影响, 探讨西安地区H pylori的优势致病基因型.
方法: 用快速尿素酶试验(rapid urease test, RUT)筛选出H pylori阳性胃黏膜标本101例, 细菌基因组DNA提取试剂盒提取DNA, 用聚合酶链反应(PCR)扩增尿素酶C(ureC)基因的方法筛选出H pylori阳性标本91例. 经PCR及琼脂糖凝胶电泳对cagA, iceA的基因亚型进行检测, 用χ2检验以及Fisher精确检验分析各基因及其不同组合与疾病的相关性.
结果: cagA基因的阳性率为79.1%, iceA的总检出率为75.82%, 其中iceA1为50.5%, iceA2为38.5%, cagA+/iceA1+的检出率高于其他组, 单一基因及其不同组合在各疾病组中分布没有显著差异. iceA与cagA存在相关性. iceA2分别发现有229、334、439、549 bp以及229 bp+334 bp的基因片段.
结论: cagA+/iceA1+是西安地区H pylori的优势致病基因型, cagA、iceA1、iceA2各单一基因以及其不同组合与感染的临床结局无关. iceA与cagA基因可能存在协同作用, 该地区iceA2基因有较大的变异性.
引文著录: 张翔, 阎志, 曲凯, 徐纪茹, 韩燕, 乔文, 陈艳炯. 西安地区幽门螺杆菌cagA, iceA基因与其所致疾病的相关性. 世界华人消化杂志 2009; 17(16): 1632-1637
Revised: May 8, 2009
Accepted: May 11, 2009
Published online: June 8, 2009
AIM: To study the impact of cagA, iceA genes and their synergy on the outcome of H pylori infection so as to explore the dominant genotypes of H pylori that induce certain diseases in Xi'an area.
METHODS: One hundred and one H pylori-positive specimens from the patients after gastroscopy were preliminarily selected using the rapid urease test (RUT) and 91 eligible cases were chosen from them using the method of polymerase chain reaction (PCR) to amplify ureC. The subtypes of cagA, iceA genes were detected by PCR and agarose gel electrophoresis. Relationship between different combinations of genotypes and disease was analyzed using χ2 test and Fisher exact test.
RESULTS: The cagA-positive rate was 79.1%, and the overall detection rate of iceA was 75.82%, in which the detection rate oficeA1 was 50.5% and that of iceA2 was 38.5%. The positive rate of cagA+/iceA1+ was higher than that of other groups. Each gene alone or genes in different combinations didn't show any statistical significance in clinical outcomes. The relevance existed in iceA and cagA. 229 bp, 334 bp, 439 bp, 549 bp and 229 bp+334 bp fragments of the genes were found in iceA2.
CONCLUSION: cagA+/iceA1+ is the dominant genotype of H pylori in Xi'an area. Neither a single gene nor the combination of cagA, iceA1, iceA2 are helpful in predicting the clinical outcome of H pylori infection. We may find synergy with the iceA and cagA. iceA2 shows greater variability in Xi'an area.
- Citation: Zhang X, Yan Z, Qu K, Xu JR, Han Y, Qiao W, Chen YJ. Association of cagA and iceA genotypes with Helicobacter pylori related diseases in Xi'an area. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1632-1637
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1632.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1632
幽门螺杆菌(Helicobacter pylori, H pylori)是一类主要定居于人类胃内的革兰氏阴性弯曲菌, 是胃黏膜炎症的明确病因, 是慢性胃炎向胃黏膜不典型增生及胃癌发展的重要启动因子[1], 并与消化性溃疡和黏膜相关性淋巴样组织淋巴瘤(mucosa-associated lymphoid tissue lymphoma, MALT)等疾病的发生发展密切相关[2]. 临床研究发现, H pylori的感染率在发展中国家达80%, 但是近20%-30%的感染者不发病, 50%以上的感染者仅有不同程度的慢性炎症, 10%-15%可发生消化性溃疡, 只有极少数发生胃部恶性肿瘤[3]. 依据染色体DNA和特异性位点的片段长度多态性(RFLP)分析、随机扩增多态性DNA的PCR分析、DNA指纹分析等大量研究显示: H pylori具有高度变异性及基因型别多样性的特点, 越来越多的证据提示这种多样性与临床结局有密切关系[4], 但目前尚未发现明确与胃癌等疾病发生紧密相关的H pylori毒力基因[5]. H pylori所致疾病的种类与所含毒力因子的差异是否有关成为目前争议的热点.
目前, 已知H pylori可能的毒力基因包括cagA、iceA等, 不同毒力基因型及其组合形式与相关胃肠道疾病的关系在不同地区报道存在差异. 普遍认为, H pylori菌株具有较强的地域差异, 欧美地区H pylori的cagA和iceA1与消化性溃疡密切相关. 而在亚太地区, 绝大多数H pylori为cagA阳性菌株, 其在消化性溃疡, 胃癌以及慢性胃炎中的阳性率无显著差别, 单一H pylori毒力基因与胃癌缺乏相关性[5]. 近年来, 国内有报道称iceA1亚型菌株与重度炎症关系密切[6], cagA和iceA1可能存在协同作用[7]. 在西安地区有研究显示iceA1, iceA2单基因型与H pylori感染后的临床结局无明显相关性[8]. 本地区cagA和iceA的不同组合以及其协同作用对临床结局的影响目前尚未见报道.
本研究采用PCR方法对临床获得的西安地区H pylori菌株进行致病基因检测, 以期得到不同基因型与所致疾病的相关性, 为H pylori的致病机制的揭示以及H pylori相关胃肠道疾病的精细诊断、特异性治疗、感染预后判断等提供依据.
选取2007-07/2008-08在西安交通大学医学院第一附属医院消化内科接受胃镜检查的具有上消化道症状患者, 详细记录受检者的服药史, 家族史, 居住地以及生活习惯等. 胃炎的诊断依据悉尼胃炎新分类标准并结合我国2000年全国慢性胃炎研讨会制定的标准进行, 消化性溃疡及胃癌的诊断结合胃镜下所见及病理学诊断结果得出. 于胃窦部取新鲜胃黏膜活组织进行快速尿素酶试验(rapid urease test, RUT). 筛选出RUT试验阳性的胃黏膜活检标本101例, 其中男52例, 女49例, 年龄15-93(平均46.12)岁. 将胃黏膜活检组织迅速置于-80 ℃冰箱中保存. 细菌基因组DNA提取试剂盒、PCR试剂(2×Taq PCR MasterMix、10×Buffer、TaqDNA聚合酶、dNTP)均购自北京天根生物制品有限公司; MarkerⅠ和MarkerⅡ购自北京天为时代科技有限责任公司; 实验所用引物委托北京奥科生物技术有限责任公司合成; 主要仪器Gradient温度梯度扩增仪、基因扩增仪为MJ公司生产; 水平电泳仪为北京六一仪器厂生产; Gene Genius凝胶图像分析仪为美国Sygene公司生产.
1.2.1 胃黏膜组织中H pylori基因组DNA的提取: 将-80 ℃保存的胃黏膜活组织置于细菌提取缓冲液(GA缓冲液)200 µL中, 充分冲洗, 间断震荡5 min. 用细菌基因组DNA提取试剂盒(离心柱型)进行DNA的提取. DNA液于-20 ℃保存, 备用.
1.2.2 H pylori尿素酶C(ureC)及致病基因(cagA、iceA1和iceA2基因)的检测: 实验所用引物序列[9-10]及扩增条件见表1. 聚合酶链反应体系为20 µL, ureC的反应体系包括引物各1 µL, 扩增的dNTP各2 µL, TaqDNA聚合酶1 µL, 10×Buffer 2.5 µL, cagA和iceA1的反应体系包括引物各0.5 µL, 扩增的dNTP各1.6 µL, TaqDNA聚合酶0.2 µL, 10×Buffer 2 µL,iceA2的反应体系包括引物各0.5 µL, 2×Taq PCR MasterMix 15 µL, 热循环结束后, 取PCR扩增产物进行琼脂糖凝胶电泳(ureC: 10 g/L琼脂糖凝胶, 60 mV, 30 min; cagA、iceA1和iceA2: 15 g/L琼脂糖凝胶, 100 mV, 100 min), 在凝胶成像系统下观察照相, 记录结果.
| 基因 | 引物序列(5'→3') | 产物大小(bp) | 扩增条件 |
| ureC | TGGGACTGATGGCGTGAGGG | 820 | 94 ℃ 1 min, 55 ℃ 1 min, |
| AAGGGCGTTTTTAGATTTTT | 72 ℃ 1 min (30 cycles) | ||
| cagA | GATAACAGGCAAGCTTTTGAGG | 349 | 94 ℃ 1 min, 55 ℃ 1 min, |
| CTGCAAAAGATTGTTTGGCAGA | 72 ℃ 40 s (30 cycles) | ||
| iceA1 | GTGTTTTTAACCAAAGTATC | 246 | 94 ℃ 1 min, 50 ℃ 1 min, |
| CTATAGCCAGTCTCTTTGCA | 72 ℃ 40 s (30 cycles) | ||
| iceA2 | GTTGGGTATATCACAATTTAT | 229, 334, | 94 ℃ 1 min, 50 ℃ 1 min, |
| TTGCCCTATTTTCTAGTAGGT | 439, 549 | 72 ℃ 40 s (30 cycles) |
统计学处理 用Excel建立数据库, 使用SPSS13.0统计软件对数据进行χ2检验或者Fisher精确检验, P<0.05差异有统计学意义.
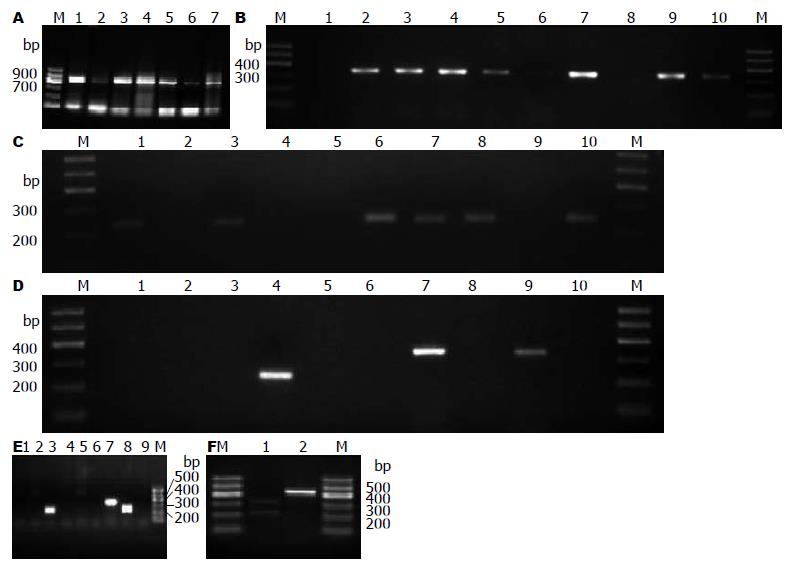
101例RUT试验阳性的胃黏膜标本中有91例得到预期大小的扩增产物(图1A), 阳性率为90.1%. 其中来自慢性浅表性胃炎(CSG)患者39例, 慢性萎缩性胃炎(CAG)患者27例, 消化性溃疡(PU)患者22例, 胃癌(GC)患者3例(表2).
| 分组 | cagA | iceA1 | iceA2 | 合计 |
| CSG | 30(76.9) | 22(56.4) | 17(43.6) | 39(42.9) |
| CAG | 23(85.2) | 15(55.6) | 8(29.6) | 27(29.7) |
| PU | 16(72.7) | 9(40.9) | 9(40.9) | 22(24.2) |
| GC | 3(100) | 0(0.0) | 2(66.7) | 3(3.3) |
| 合计 | 72(79.1) | 46(50.5) | 36(39.6) | 91(100.0) |
cagA、iceA1及iceA2基因扩增片段正确(图1B-F), cagA的阳性率为79.1%, 在各类疾病组中都占有优势. iceA的总检出率为75.82%, 其中iceA1的阳性率为50.5%, iceA2的阳性率为39.6%(表2), cagA+、iceA1+及iceA2+在各疾病组中分布差异没有统计学意义(P>0.05).
cagA+/iceA1+是本地区的优势菌株. cagA+/iceA+组中各疾病的检出率差别没有统计学意义(P>0.05, 表3).
| CSG | CAG | PU | GC | |
| cagA+/iceA1+/iceA2+ | 3(7.69) | 2(7.4) | 3(13.64) | 0(0.00) |
| cagA+/iceA1+/iceA2- | 13(33.3) | 12(44.4) | 6(27.27) | 0(0.00) |
| cagA+/iceA1-/iceA2+ | 9(23.08) | 4(14.81) | 6(27.27) | 2(66.67) |
| cagA+/iceA1-/iceA2- | 5(12.82) | 5(18.52) | 1(4.55) | 1(33.33) |
| cagA-/iceA1+/iceA2+ | 4(10.26) | 0(0.00) | 0(0.00) | 0(0.00) |
| cagA-/iceA1+/iceA2- | 2(5.13) | 1(3.70) | 0(0.00) | 0(0.00) |
| cagA-/iceA1-/iceA2+ | 1(2.56) | 2(7.40) | 0(0.00) | 0(0.00) |
| cagA-/iceA1-/iceA2- | 2(5.13) | 1(3.70) | 6(27.27) | 0(0.00) |
cagA阳性的菌株中iceA的阳性亦较高, cagA阳性82例, iceA阳性70例, iceA与cagA有相关性(r = 0.264), 存在统计学上的差异(χ2 = 6.347, P = 0.012).
本研究显示iceA2有很大的变异性, 分别发现有229、334、439、549、229 bp+334 bp同时具有的基因片段(图1D-F, 表4). iceA1, iceA2同时阳性的有12例(13.19%), 其中CSG7例(58.3%), CAG2例(16.7%), PU3例(25%). 同一疾病iceA亚型分布没有显著性差异(P>0.05).
| 分组 | 229 bp | 334 bp | 439 bp | 549 bp | 229 bp+334 bp |
| CSG | 5(29.4) | 4(23.5) | 1(5.88) | 6(35.3) | 1(5.88) |
| CAG | 6(70.5) | 1(12.5) | 0(0.00) | 1(12.5) | 0(0.00) |
| PU | 4(44.4) | 3(33.3) | 0(0.00) | 2(22.2) | 0(0.00) |
| GC | 1(50.0) | 1(50.0) | 0(0.00) | 0(0.00) | 0(0.00) |
H pylori的高感染率与其感染后的低发病率之间的矛盾提示, 宿主的遗传异质性, 菌株的基因多态性以及环境等因素都可能与临床结局密切相关. 环境方面, 虽然有学者认为H pylori感染与饮食等因素可能存在相关性[11], 但由于感染大多始于儿童时期, 故而其影响相对较小[12]. 在宿主的遗传因素方面, 近年来已有研究证明主要与组织相容性复合体(major histocompatibility complex, MHC), 白介素-1(interleukin 1, IL-1)等遗传多态性相关[13-14]; 而在菌株方面, H pylori基因多态性成为揭开H pylori感染不同结局机制的突破口之一, 相关毒力基因的拥有或缺失、某些位点等位基因分布的差异都可能导致宿主产生不同的临床结局. 然而公认的毒力基因与疾病的临床相关性仍然是一个争议的热点[15]. 因此, 检测H pylori的基因型别、正确评价其多态性对其致病相关因素的揭示以及相关疾病的个体化诊断和治疗具有重要意义. 鉴于H pylori存在较强的地域差异[16], 本研究用PCR方法检测西安地区人群感染的H pylori菌株cagA, iceA 2个毒力基因. 结果显示西安地区感染的优势菌株型别为cagA+/iceA1+型, cagA的检出率为79.1%, iceA的检出率为75.82%, 其中iceA1的阳性率为50.5%, iceA2的阳性率为38.5%, 与亚洲地区的报道[17-18]相似, 而与欧美等国家的报道[19-20]差异较大.
cagA编码的毒素相关蛋白, 是H pylori分泌的一种能引起炎症反应的毒素. iceA是Peek et al[21](1998)根据H pylori与胃黏膜黏附可能诱导毒力相关基因表达这一假说, 通过比较黏附和未黏附于人胃上皮细胞的H pylori溃疡株和胃炎株的mRNA转录发现的. 国内外的诸多报道[22-23]均表明cagA可以增加胃十二指肠疾病的危险性, 但其在消化性溃疡、胃癌以及慢性胃炎中的阳性率无显著差异, 仅有部分研究提示cagA与消化性溃疡密切相关[24-25]. 而关于iceA各基因与疾病的关系, 不同国家不同地区的报道差异很大: van Doorn et al[10]对荷兰地区94例胃黏膜标本的研究以及Caner et al[26]对土耳其46份菌株的研究, 均提示iceA1与消化性溃疡有很强的相关性; 而iceA2则与慢性胃炎的联系紧密. 巴西有报道称iceA2与慢性胃炎的发生密切相关[19]; 另有学者认为iceA2与消化性溃疡密切相关, 而iceA1与消化性溃疡成负相关[27]; 另有研究认为iceA1与慢性胃炎的发生有关[28], 而大多数亚太地区的研究显示iceA与临床结局无相关性[16-17,29].
本研究没有发现cagA, iceA1与iceA2及其不同组合在慢性浅表性胃炎、慢性萎缩性胃炎、消化性溃疡、胃癌中的分布存在差异. 我们分析推测与下列因素有关: (1)cagA基因在不同的H pylori菌株中显示出一定的多态性, 基因中存在较多的DNA重复序列, 从而导致不同CagA蛋白变异体的出现; (2)iceA在大多数H pylori菌株中可能并不是编码一个功能蛋白, 而是在其转录水平调节腺嘌呤甲基转移酶yIM的表达, 通过DNA甲基化水平的改变来调控相关毒素基因的表达, 从而间接参与H pylori的致病作用[30]; iceA的表达与宿主黏膜的应答密切相关, 由宿主因素决定的翻译水平与疾病的发展密切相关[31]; (3)H pylori菌株基因型别存在地域差异; (4)临床结局除与细菌本身有关之外, 还与宿主以及细菌与宿主之间的相互作用等因素有关; (5)存在多种致病基因, 协同或者拮抗细菌的毒力.
目前, 对于cagA、iceA之间的协同作用及其与胃十二指肠疾病之间的关系还不清楚. 各地报道也有差异. Peek et al以及国内部分学者认为cagA和iceA1可能存在协同作用[7,21]. 而van Doorn et al[10]的研究显示相反的结果. 我们的研究显示,iceA基因与cagA基因存在相关性, 西安地区H pylori菌株iceA与cagA可能有协同作用, 基于我们的样本例数较少, 并且本地区iceA基因以及cagA基因的阳性率都较高, 此结果有待于进一步研究与分析.
iceA2基因含有105个核苷酸的重复序列[10], 可以显示不同的类型. 本研究发现, 西安地区iceA2的基因结构具有很大的遗传异质性, 分别发现有229、334、439、549、229 bp+334 bp同时具有的基因片段. 229 bp与334 bp 2个条带的同时存在(占2.86%)提示有可能存在混合感染的情况, 较国内其他地区少见. 我们推测iceA2基因的不同类型的出现与其105个核苷酸的序列重复次数有关, 这也许是iceA2基因多样性地区差异的表现类型. 由于本研究iceA2阳性例数较少, 未发现iceA2基因型变异在不同疾病之间显著性差异. iceA2的变异性机制还有待于进一步研究.
值得一提的是, 本研究中由RUT筛选出的101例患者胃黏膜H pylori阳性标本中, 有10例ureC PCR结果阴性. 提示RUT存在假阳性结果, 可能的原因为碱性胆汁返流入胃, 污染胃活检标本致其表面pH>6.0, 从而引起RUT试验弱阳性, 亦或非H pylori类螺杆菌属细菌感染胃黏膜亦可出现RUT试验阳性.
临床发现不同地区人群中H pylori感染率不同, 而感染后也并非全部发病且表现的疾病类型不同. 诸多研究显示H pylori具有高度变异性及基因型别多样性的特点, 越来越多的证据提示这种多样性与临床结局有密切关系. 因此研究本地区H pylori毒力基因型别对H pylori致病机制的揭示具有重要意义.
郑鹏远, 教授, 郑州大学第二附属医院消化科
H pylori菌株具有较强的地域差异, 其是否致病有赖于H pylori菌株的不同、宿主的差异以及他们之间特异性的联系. 目前已知的H pylori可能的毒力基因包括cagA、iceA等, 然而不同毒力基因型及其组合与相关胃肠道疾病的关系不同地区报道差异较大, H pylori所致疾病的种类与所含毒力因子的差异是否有关成为目前争议的热点.
欧美地区报道H pylori的cagA和iceA1与消化性溃疡密切相关. 而亚太地区的研究显示, 绝大多数H pylori为cagA阳性菌株, 其在消化性溃疡, 胃癌以及慢性胃炎中的阳性率无显著差别, 单一H pylori毒力基因与胃癌缺乏相关性. 这种不同正体现了H pylori感染菌株的地域差异.
本文结果发现西安地区感染的优势菌株型别为cagA+/iceA1+型, cagA、iceA1、iceA2各单一基因以及其不同组合与感染的临床结局无关, 再次证实了亚洲与欧美H pylori的不同. iceA2分别发现有229、334、439、549、229 bp+334 bp同时具有的基因片段. 这提示本地区iceA2基因结构具有很大的变异性.
本研究分析了西安地区H pylori致病基因型的分布, 探讨了致病基因的疾病相关性, 为H pylori的致病机制的揭示以及H pylori相关胃肠道疾病的精细诊断、特异性治疗、感染预后判断等提供依据.
本研究选题较好, 设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编: 何基才
| 2. | De Luca A, Iaquinto G. Helicobacter pylori and gastric diseases: a dangerous association. Cancer Lett. 2004;213:1-10. [PubMed] |
| 4. | Lu H, Hsu PI, Graham DY, Yamaoka Y. Duodenal ulcer promoting gene of Helicobacter pylori. Gastroenterology. 2005;128:833-848. [PubMed] [DOI] |
| 5. | 张 万岱, 萧 树东, 胡 伏莲, 林 三仁, 胡 品津, 刘 文忠, 王 继德, 徐 智民, 成 虹. 对幽门螺杆菌若干问题共识意见. 世界华人消化杂志. 2004;12:2457-2458. [DOI] |
| 7. | 张 彩凤, 林 志辉. 幽门螺杆菌iceA、cagA相关性研究. 胃肠病学和肝病学杂志. 2006;15:584-586. |
| 8. | 庄 坤, 张 军, 张 玲霞, 张 沥, 张 建中. 西安地区幽门螺杆菌iceA1、iceA2和babA2基因型与致病性的研究. 细胞与分子免疫学杂志. 2007;23:520-522. |
| 9. | Fujimoto S, Marshall B, Blaser MJ. PCR-based restriction fragment length polymorphism typing of Helicobacter pylori. J Clin Microbiol. 1994;32:331-334. [PubMed] |
| 10. | van Doorn LJ, Figueiredo C, Sanna R, Plaisier A, Schneeberger P, de Boer W, Quint W. Clinical relevance of the cagA, vacA, and iceA status of Helicobacter pylori. Gastroenterology. 1998;115:58-66. [PubMed] |
| 11. | Ruggiero P, Rossi G, Tombola F, Pancotto L, Lauretti L, Del Giudice G, Zoratti M. Red wine and green tea reduce H pylori- or VacA-induced gastritis in a mouse model. World J Gastroenterol. 2007;13:349-354. [PubMed] |
| 12. | Karhukorpi J, Yan Y, Kolho KL, Rautelin H, Lahti M, Sirviö A, Riipinen K, Lindahl H, Verkasalo M, Fagerholm R. cagA, vacA and iceA virulence genes of Helicobacter pylori isolates of children in Finland. Eur J Clin Microbiol Infect Dis. 2000;19:790-793. [PubMed] [DOI] |
| 13. | Bartchewsky W Jr, Martini MR, Masiero M, Squassoni AC, Alvarez MC, Ladeira MS, Salvatore D, Trevisan M, Pedrazzoli J Jr, Ribeiro ML. Effect of Helicobacter pylori infection on IL-8, IL-1beta and COX-2 expression in patients with chronic gastritis and gastric cancer. Scand J Gastroenterol. 2009;44:153-161. [PubMed] [DOI] |
| 14. | Nguyen TN, Barkun AN, Fallone CA. Host determinants of Helicobacter pylori infection and its clinical outcome. Helicobacter. 1999;4:185-197. [PubMed] [DOI] |
| 15. | 林 孜, 张 曙, 吴 云林. 幽门螺杆菌基因特征与宿主临床结果相关性研究进展. 胃肠病学和肝病学杂志. 2008;17:527-531. |
| 16. | Chomvarin C, Namwat W, Chaicumpar K, Mairiang P, Sangchan A, Sripa B, Tor-Udom S, Vilaichone RK. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA and babA2 genotypes in Thai dyspeptic patients. Int J Infect Dis. 2008;12:30-36. [PubMed] [DOI] |
| 17. | Ko JS, Kim KM, Oh YL, Seo JK. cagA, vacA, and iceA genotypes of Helicobacter pylori in Korean children. Pediatr Int. 2008;50:628-631. [PubMed] [DOI] |
| 18. | Lin YF, Gong ST, Ou WJ, Pan RF, Huang H, He WE, Liu LY, Huo XH, Chen BX. [Genotypic study on the Helicobacter pylori vacA, cagA and iceA genes in the infected children in Guangzhou area]. Zhonghua Erke Zazhi. 2007;45:703-707. [PubMed] |
| 19. | Gatti LL, Módena JL, Payão SL, Smith Mde A, Fukuhara Y, Módena JL, de Oliveira RB, Brocchi M. Prevalence of Helicobacter pylori cagA, iceA and babA2 alleles in Brazilian patients with upper gastrointestinal diseases. Acta Trop. 2006;100:232-240. [PubMed] [DOI] |
| 20. | Yamaoka Y, Kodama T, Gutierrez O, Kim JG, Kashima K, Graham DY. Relationship between Helicobacter pylori iceA, cagA, and vacA status and clinical outcome: studies in four different countries. J Clin Microbiol. 1999;37:2274-2279. [PubMed] |
| 21. | Peek RM Jr, Thompson SA, Donahue JP, Tham KT, Atherton JC, Blaser MJ, Miller GG. Adherence to gastric epithelial cells induces expression of a Helicobacter pylori gene, iceA, that is associated with clinical outcome. Proc Assoc Am Physicians. 1998;110:531-544. [PubMed] |
| 23. | Andreson H, Lõivukene K, Sillakivi T, Maaroos HI, Ustav M, Peetsalu A, Mikelsaar M. Association of cagA and vacA genotypes of Helicobacter pylori with gastric diseases in Estonia. J Clin Microbiol. 2002;40:298-300. [PubMed] [DOI] |
| 24. | Salehi Z, Jelodar MH, Rassa M, Ahaki M, Mollasalehi H, Mashayekhi F. Helicobacter pylori cagA status and peptic ulcer disease in Iran. Dig Dis Sci. 2009;54:608-613. [PubMed] [DOI] |
| 25. | Momenah AM, Tayeb MT. Helicobacter pylori cagA and iceA genotypes status and risk of peptic ulcer in Saudi patients. Saudi Med J. 2007;28:382-385. [PubMed] |
| 26. | Caner V, Yilmaz M, Yonetci N, Zencir S, Karagenc N, Kaleli I, Bagci H. H pylori iceA alleles are disease-specific virulence factors. World J Gastroenterol. 2007;13:2581-2585. [PubMed] |
| 27. | Ashour AA, Collares GB, Mendes EN, de Gusmão VR, Queiroz DM, Magalhães PP, de Carvalho AS, de Oliveira CA, Nogueira AM, Rocha GA. iceA genotypes of Helicobacter pylori strains isolated from Brazilian children and adults. J Clin Microbiol. 2001;39:1746-1750. [PubMed] [DOI] |
| 28. | Wu CC, Chou PY, Hu CT, Liu ZC, Lin CY, Tseng YH, Lin NT. Clinical Relevance of the vacA, iceA, cagA, and flaA genes of Helicobacter pylori strains isolated in Eastern Taiwan. J Clin Microbiol. 2005;43:2913-2915. [PubMed] [DOI] |
| 29. | Wong BC, Yin Y, Berg DE, Xia HH, Zhang JZ, Wang WH, Wong WM, Huang XR, Tang VS, Lam SK. Distribution of distinct vacA, cagA and iceA alleles in Helicobacter pylori in Hong Kong. Helicobacter. 2001;6:317-324. [PubMed] [DOI] |
| 30. | Donahue JP, Peek RM, Van Doorn LJ, Thompson SA, Xu Q, Blaser MJ, Miller GG. Analysis of iceA1 transcription in Helicobacter pylori. Helicobacter. 2000;5:1-12. [PubMed] [DOI] |
| 31. | Peek RM Jr, van Doorn LJ, Donahue JP, Tham KT, Figueiredo C, Blaser MJ, Miller GG. Quantitative detection of Helicobacter pylori gene expression in vivo and relationship to gastric pathology. Infect Immun. 2000;68:5488-5495. [PubMed] [DOI] |