修回日期: 2009-04-20
接受日期: 2009-04-27
在线出版日期: 2009-06-08
目的: 探讨不同来源的光敏剂PpIX在食管癌细胞中的亚细胞分布与光动力学效应的关系.
方法: KYSE-450、KYSE-70和Het-1A细胞分别用ALA和外源性PpIX以及MitoTracker Green处理, 相差荧光显微镜观察不同来源的PpIX在细胞内的定位. 利用JC-1-流式细胞方法检测ALA-PDT和PpIX-PDT后细胞线粒体膜电位(ΔΨm)的改变. 利用电镜观察ALA-PDT和PpIX-PDT后细胞线粒体的超微结构, 观察PpIX的不同细胞分布形式对线粒体损伤的形态学改变. MTS法测定PDT处理后的细胞存活率.
结果: 由ALA产生的内源性光敏剂PpIX荧光主要分布在线粒体, 与MitoTracker Green显示的线粒体荧光分布在相同的区域, 而外源性PpIX荧光信号则弥漫性分布于整个细胞质. KYSE-450、KYSE-70和Het-1A细胞经ALA-PDT 12 h后, 膜电位受损细胞分别达到22%、52%和33%, 而外源性PpIX-PDT别12 h后线粒体受损细胞率仅分别为15%、14%和18%. 电镜观察结果显示, ALA-PDT后仅1 h一些线粒体即已出现受损状态, 可见线粒体内嵴不明显, 出现空泡和膨胀. 但外源性PpIX-PDT后1 h细胞内大部分线粒体仍保持完整结构. ALA-PDT的细胞杀伤效果明显好于外源性PpIX-PDT.
结论: 光敏剂的不同亚细胞定位影响了食管癌细胞PDT的功效, PDT造成的线粒体的损伤在肿瘤细胞杀伤过程中起非常重要的作用, 提示以线粒体为靶点的光敏剂是未来光敏剂研制的重点.
引文著录: 汲振余, 范天黎, 赵立群, 杨小静, 裘一兵, 张聚真, 张亚冰, 孙予, 裘宋良, 杨观瑞. 光敏剂PpIX亚细胞分布方式对食管癌细胞光动力学效应的影响. 世界华人消化杂志 2009; 17(16): 1602-1608
Revised: April 20, 2009
Accepted: April 27, 2009
Published online: June 8, 2009
AIM: To study the effects of subcellular localization pattern of PpIX on photodynamic efficiency in esophageal cancer cell lines.
METHODS: KYSE-450, KYSE-70 and Het-1A cells were treated with ALA, exogenous PpIX and MitoTracker, respectively. The subcellular localization patterns of PpIX were observed using fluorescence microscopy. Mitochondrial transmembrane potential (ΔΨm) after ALA-PDT and PpIX-PDT was measured using JC-1 flow cytometry. The morphological study of mitochondria after ALA-PDT and PpIX-PDT was performed with electron microscopy. MTS was used to examine the cell survival rate.
RESULTS: The granular patterns and distribution of fluorescence in the extranuclear fraction of the cells were similar for both ALA-derived endogenous PpIX and the MitoTracker in all cell lines; however, exogenous PpIX was diffusely distributed in the whole cytoplasm of cells. After 12 h of ALA-based PDT, the percentages were increased to 22%, 52% and 33% in the KYSE-450, KYSE-70 and Het-1A cell lines, respectively; where only 15%, 14% and 18% of the depolarized cell fractions were seen following PDT with exogenous PpIX. As early as 1 h after photodynamic treatment, some of the mitochondria were already damaged by ALA-PDT with unclear cristae, vacuoles and swelling; while the mitochondrial ultrastructure was still well preserved 1 h later following PDT with exogenous PpIX. ALA-mediated PDT was significantly more efficient than PDT with exogenous PpIX in killing cells in all the 3 cell lines.
CONCLUSION: Different subcellular location of photosensitizer may affect the PDT efficacy. Mitochondria are more sensitive and may be important targets for PDT. This finding suggests that new photosensitizers with mitochondrially-localizing property may be designed for improvement of PDT effectiveness in the future.
- Citation: Ji ZY, Fan TL, Zhao LQ, Yang XJ, Qiu YB, Zhang JZ, Zhang YB, Sun Y, Qiu SL, Yang GR. Effects of subcellular localization pattern of PpIX on photodynamic efficiency in esophageal cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1602-1608
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1602
光动力学疗法(photodynamic therapy, PDT)是利用一定波长的光激发光敏剂, 在分子氧存在下产生光化学或光物理学反应, 导致存积光敏剂的病变部位产生不可逆的损伤[1], 因而PDT的细胞毒性效果则依赖于光敏剂在细胞内的选择性累积. 但以往一些研究证实这些选择性累积是不同的, 细胞内线粒体、溶酶体、质膜、内质网、高尔基复合体及肿瘤组织的血管系统都可能成为PDT的结合位点[2]. 光敏剂在肿瘤细胞内的亚细胞分布方式也决定了光动力学效应作用位点[3], 因而有可能影响到PDT细胞毒性的差异. 本研究拟利用氨基酮戊酸(δ-aminolevulinic acid, ALA)以及外源性原卟啉IX(PpIX)作为光敏剂, 研究不同来源的PpIX在人食管鳞癌细胞系KYSE-450、KYSE-70及人食管上皮永生细胞系Het-1A中的分布特征以及与光动力学效应的关系, 为新光敏剂的开发和治疗手段的改善提供依据.
5-ALA和PpIX由PhotoCure ASA(挪威)提供. 避光下称取100 mg PpIX, 加至20 mL二甲亚砜(DMSO)内, 磁力搅拌器搅拌后, 超声波处理2 h以上, 使其充分溶解, 然后用细胞培养液稀释至所需浓度, DMSO终浓度不超过10 g/L. 高分化食管鳞癌细胞KYSE-450和低分化食管鳞癌细胞KYSE-70由美国ATCC提供. 荧光分光光度计为LS-5型(Perkin Elmer). PDT光辐射仪为PCI Biotech公司(挪威)生产. 流式细胞仪为BD FACSDiVa Option(BD Biosciences公司. 美国). 荧光显微镜为Nikon Eclips E800, 附带-60 ℃ 高分辨率CCD成像设备. MTS为Promega产品. JC-1由美国Biotium公司生产. ATP定量测定试剂盒来自Sigma公司. RPMI 1640培养液及其他试剂均购自Sigma.
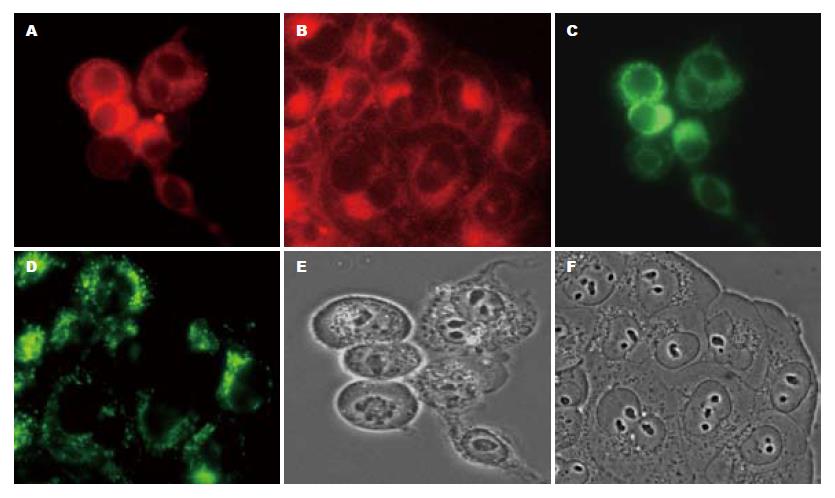
1.2.1 PpIX亚细胞定位的观察: 生长至80%左右融合的KYSE-450、KYSE-70和Het-1A细胞用胰蛋白酶-EDTA消化, 接种4×105个细胞至6孔培养板, 每孔含4 mL RPMI 1640培养基(含100 g/L小牛血清). 37 ℃ 50 mL/L CO2培养箱培养过夜, 使细胞充分贴壁. 次日用无血清RPMI 1640培养基洗涤2次, 分别用含1.5 mmol/L ALA的无血清培养液孵育细胞3.5 h, 用含1 µmol/L PpIX的无血清培养液孵育细胞2 h. 各培养板孔内再加入500 nmol/L MitoTracker Green FM, 37 ℃ CO2培养箱继续孵育细胞30 min. 弃培养液, 细胞用冷PBS洗涤2次, 荧光显微镜观察结果. 激发波长为380-420 nm, 散射波长为630±20 nm. MitoTracker Green FM荧光信号激发波长为465-495 nm, 散射波长为515-555 nm.
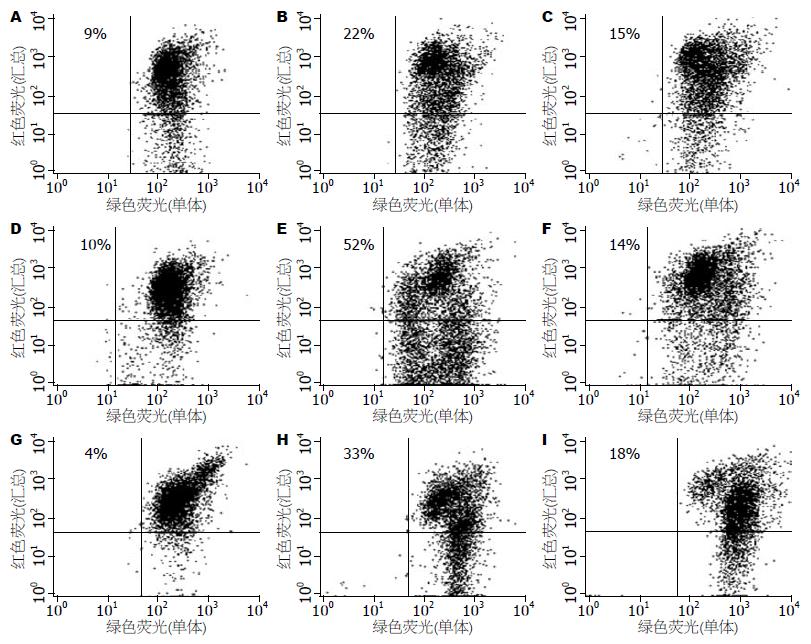
1.2.2 线粒体膜电位(ΔΨm)测定: 细胞接种至6孔培养板. 用1 mmol/L的ALA处理细胞, 方法同上. KYSE-450细胞用0.4 µmol/L的PpIX处理, KYSE-70和Het-1A用0.2 µmol/L的PpIX处理, 以使其能在细胞内产生相同水平的PpIX. 用ALA处理的细胞(红光, 波长>600 nm), KYSE-450的光照射剂量为7.2 J/cm2, KYSE-70和Het-1A的光照射剂量为3.6 J/cm2. 用PpIX处理的3种细胞, 光照射剂量均为14.4 J/cm2. 光处理完毕后弃去原培养液, 加入100 µL含100 g/L小牛血清的新鲜培养液, 暗处37 ℃ CO2培养箱孵育12 h. 刮取细胞, 14000 r/min离心5 min, 弃上清, 细胞沉淀用0.5 mL 1×反应缓冲液重悬, 14000 r/min离心5 min, 弃上清. 加入0.5 mL JC-1工作液使细胞沉淀重悬, 37 ℃温箱内孵育15 min. 用1 mL 1×反应缓冲液洗涤2次, 最后用0.5 mL 1×反应缓冲液重悬细胞, 流式细胞仪测定.
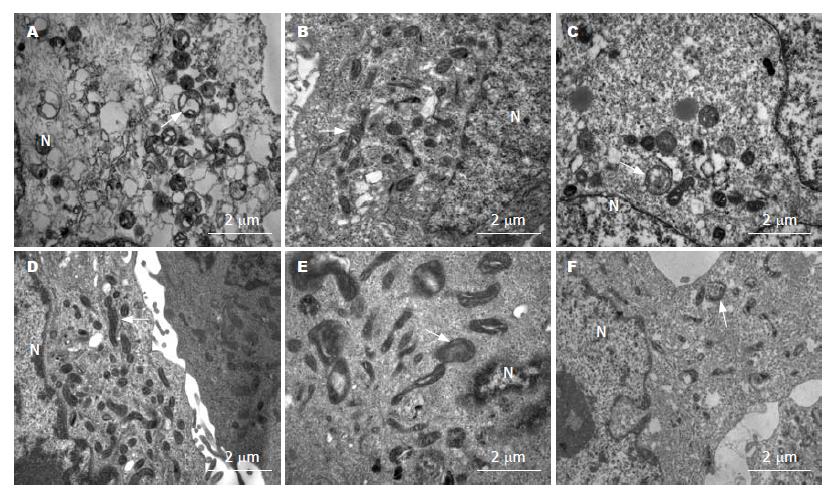
1.2.3 线粒体结构的电镜观察: KYSE-450、 KYSE-70和Het-1A细胞分别用ALA、PpIX处理和光照射, 方法和剂量同1.2.2. 对照组细胞不用ALA或PpIX孵育, PDT处理方法相同. 光处理完毕后加入4 mL含100 g/L小牛血清的新鲜培养液, 暗处37 ℃ CO2培养箱孵育1 h后收获细胞. PBS洗涤, 细胞沉淀用含10 g/L戊二醛和40 g/L甲醛的二甲基砷酸盐(cacodylate)缓冲液悬浮, 固定细胞过夜. 用10 g/L四氧化锇(osmium tetroxide)的二甲基砷酸盐缓冲液再固定细胞1 h. 脱水处理: 分别于700、900、960 mL/L的乙醇浸泡各3次, 每次10 min, 最后浸泡于环氧丙烷(propylene oxide)中. 细胞包埋入环氧树脂(Epon/Araldite), 玻璃刀切片, 于玻片上以甲苯胺蓝(toluidine blue)染色, 普通光镜观察定位. 用钻石刀做超薄切片, 乙酸双氧铀(uranyl acetate)和柠檬酸铅染色, 电镜观察.
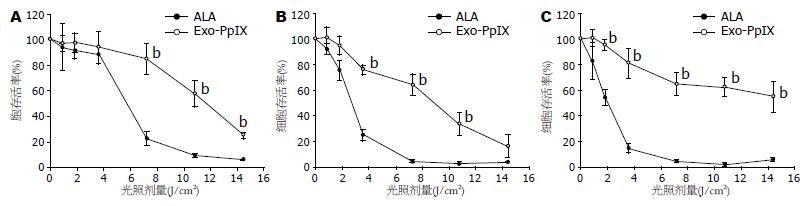
1.2.4 光动力学处理和细胞存活活性的测定(MTS法): 接种1×104个细胞至96孔培养板, 37 ℃ 50 mL/L CO2培养箱培养过夜, 用200 μL无血清RPMI 1640培养基洗涤2次. 加入100 μL含1 mmol/L的ALA或各浓度的PpIX的无血清RPMI 1640培养液, 暗处37 ℃ CO2培养箱孵育4 h. PDT光辐射仪进行光处理, 波长>600 nm, 光流速15 W/m2. 光处理完毕后立即弃去原培养液, 加入100 μL含100 g/L小牛血清的新鲜培养液, 暗处37 ℃ CO2培养箱孵育24 h. 经光动力学处理的细胞, 每孔加入20 μL MTS液(浓度为5 g/L), 37 ℃温箱内孵育1 h后, 取出冷至室温, 酶标仪测定492 nm处的光吸收值. 所有试验均设6个平行孔, 至少重复2次. 以无ALA但用相同光剂量处理的对照孔设置为100%, 其他试验孔以此为对照计算细胞存活率(%).
统计学处理 采用SigmaPlot软件Student's t-test, 所有数据以mean±SD表示, P<0.05为有显著差异.
由于PpIX与蛋白质有很高的亲和能力而造成PpIX外分泌至细胞外介质, 我们使用含ALA或PpIX的无血清培养液处理细胞. 由ALA产生的内源性光敏剂PpIX荧光主要分布在胞质内, 与MitoTracker Green FM显示的线粒体荧光分布在相同的区域, 说明由ALA产生的内源性PpIX主要分布于线粒体. 然而外源性PpIX由于主要是靠渗透作用进入细胞, 其荧光信号弥漫性分布于整个细胞质, 完全区别于MitoTracker Green FM荧光显示的线粒体位置(图1).
对照组细胞无光敏剂孵育, 仅用光处理, 测定结果发现仅有不足10%的细胞线粒体膜电位消失(图2). KYSE-450、KYSE-70和Het-1A细胞经ALA-PDT 12 h后, 线粒体受损的细胞分别达到22%、52%和33%, 而外源性PpIX-PDT12 h后线粒体受损细胞率仅分别为15%、14%和18%, 表明ALA-PDT比外源性PpIX-PDT更趋向于破坏线粒体.
由图3可见, ALA-PDT后仅1 h, 一些线粒体即已出现受损状态, 图中可见线粒体内嵴不明显, 出现空泡和膨胀. 但外源性PpIX-PDT后1 h, 细胞内大部分线粒体仍保持完整结构. 图中显示的应用不同光敏剂而出现的线粒体形态学上的变化差异, 进一步证实ALA-PDT初始的细胞内损伤是源于对线粒体的破坏作用. 3种细胞系均出现相同的实验结果.
KYSE-450用0.4 µmol/L外源性PpIX处理、KYSE-70和Het-1细胞用0.2 µmol/L的外源性PpIX处理, 能与1 mmol/L的ALA处理后产生相同浓度的胞内PpIX, 以比较ALA-PDT和PpIX-PDT之间的光动力效果. 细胞PDT处理后, 随光剂量的增强, PDT后24 h细胞的存活率逐渐下降(图4). 虽然ALA和外源性PpIX在细胞内产生相同水平的胞内PpIX, 但ALA-PDT的细胞杀伤效果明显好于以外源性PpIX作为光敏剂的PDT(P<0.01), 所有3种细胞均有相同的结果. 由于由ALA产生的内源性PpIX主要分布于线粒体, 而外源性PpIX弥漫性分布于整个细胞质, 因而本结果提示线粒体的损伤在细胞杀伤过程中起非常重要的作用, 线粒体是PDT的一个重要靶细胞器.
PDT虽已被广泛应用于一些肿瘤组织及癌前病变组织的治疗[4-6], 然而其确切机制仍不十分清楚. 研究开发更理想的新光敏剂以提高PDT的临床疗效是目前PDT领域研究的重点之一[7], 因此关于光敏剂在肿瘤组织内的不同分布方式和其亚细胞不同分布方式、光敏作用的具体靶细胞器及对光动力学效应的影响, 仍需更多的了解. ALA本身不具备光敏作用, 是内源性光敏剂PpIX前体. 内源性光敏剂PpIX是细胞内血红素(Heme)生物合成的中间产物, 在线粒体内形成[8-9]. 本研究利用能在细胞内产生内源性光敏剂PpIX的ALA和外源性PpIX作为光敏剂处理细胞, 观察PpIX在食管鳞癌细胞(KYSE-450、KYSE-70)和食管上皮永生细胞(Het-1A)内的亚细胞分布形式、PDT作用位点及与PDT细胞杀伤效果之间的关系. 研究发现用ALA和外源性光敏剂作用细胞后, 细胞内PpIX的分布方式明显不同. 由ALA产生的内源性光敏剂PpIX主要分布在线粒体, 少部分结合于胞质膜, 而外源性PpIX由于其脂溶性的特性, 被细胞吸收后主要由渗透和扩散作用, 弥漫性分布于整个细胞质. 因光敏剂受光的激发所产生的对肿瘤细胞起主要毒性作用的单态氧(singlet oxygen, 1O2)的寿命和扩散距离非常短(寿命小于0.05 µs, 扩散半径小于0.02 µm), 因而PDT的作用位点就仅限于光敏剂所处的位置[4,10-11].
线粒体是细胞有氧呼吸的基地和供能的场所, 对维持细胞的生命活动功能至关重要, 而且也对细胞凋亡信号途径的起始起中心作用[12-13], 因此不难理解线粒体应是潜在的PDT重要靶位点. 线粒体具有丰富的内膜, 内膜向内凹陷形成线粒体嵴(crista), 是实现电子传递的支架, 在电子传递过程中将氧化反应的能量转变成ATP的形式为细胞供能. 由于PDT效应对参与氧化磷酸化过程的一些成分作用, 如ATP合成酶复合体的光氧化作用(photooxidation)[10], 导致线粒体内膜膜电位(ΔΨm)消失, 氧化磷酸化解体, 能量合成能力受损, 线粒体膜的通透性增加, 转运复合孔开放释放出一些与凋亡相关的因子, 如凋亡诱导因子(AIF)、caspase和SMAC(second mitochondria-derived activator of caspases)等而启动了细胞凋亡的产生[14]. 除结合于线粒体上的光敏剂对线粒体的直接破坏外, 其他间接途径也可影响线粒体功能, 如溶酶体上的光敏剂受光激发后也能释放出某些蛋白酶, 裂解Bid产生较短的具有促凋亡活性的tBid, 参与了线粒体凋亡途径[15]. 为探讨光敏剂的不同亚细胞分布形式对线粒体的损伤及与PDT的细胞杀伤能力之间的关系, 我们分别用PpIX的前体ALA(PpIX主要产生并定位于线粒体)和造成弥漫性分布的外源性PpIX处理细胞, 结果发现ALA-PDT后出现更多的细胞线粒体膜电位去极化, 表明内源性光敏剂PpIX能更有效地破坏线粒体功能. PDT后线粒体超微结构的形态学变化如线粒体内嵴减少或消失, 出现空泡和肿胀等, 进一步证实线粒体是ALA-PDT的主要靶作用位点. 这些结果与内源性PpIX的亚细胞分布相互印证.
但在3种细胞, ALA-PDT对细胞的杀伤效果均显著高于外源性PpIX-PDT. 由于本实验使用的ALA和外源性PpIX的浓度能产生相同水平的细胞内PpIX, 因而光动力学效果的差异可能与内、外源性PpIX在细胞内的分布方式不同有关, 说明线粒体对PDT刺激更加敏感. 由于脂溶性光敏剂易于被血清中的低密度脂蛋白结合而利于运输和被肿瘤细胞吸收, 因此Barge et al[16]利用脂类取代基如胆固醇基(cholesteryl)和辛氧基(octyloxy)与光敏剂SiPc作用合成新的SiPc衍生物(Chol-O-SiPc和Octo-O-SiPc), 以增强其脂溶性, 发现其PDT效果大大增强. 脂类基团不仅能增强其运输能力和细胞的吸收能力, 而且能结合到与细胞凋亡和/或坏死有关的主要细胞器如线粒体, 内质网和高尔基复合体等, 推测这可能是增强PDT细胞杀伤能力的主要原因. 另外光敏物质在细胞内的定位也决定了是以凋亡为主还是以坏死为主. 因为研究发现, 结合到线粒体上的光敏剂通过释放一些凋亡诱导因子和细胞色素C能结合并活化caspase-9, caspase-9又激活caspase-3, 通过对Caspase活化DNA酶(caspase-activated dnase, CAD)的抑制子(inhibitor of caspase-activated Dnase, ICAD)的蛋白水解作用而激活CAD[17]. 活性形式的CAD从胞质转至胞核, 引起染色质凝集和DNA片断化, 主要诱导凋亡[4,18], 而结合到溶酶体上或胞质膜上的光敏剂, 则在受光激发后破坏细胞膜的完整结构, 造成肿胀和膜泡形成, 并破坏溶酶体膜结构, 释放出组织蛋白酶[19], 主要以引起细胞坏死为主. 由于诱导凋亡是PDT的主要机制之一, 因此我们认为这种光敏剂不同的亚细胞定位造成的不同细胞杀伤效果可能与是否有效诱导细胞凋亡有关.
光敏剂、合适波长的光和分子氧已知是PDT效应的3个必要因素. 然而越来越多的证据表明, PDT的临床治疗效果也依赖于光敏剂在肿瘤组织和肿瘤细胞内的分布形式[2]. 线粒体由于在能量新陈代谢中的重要作用, 使其成为PDT的重要靶位点. 本研究表明光动力学效应对细胞线粒体的损伤与PpIX在细胞内的分布有关, 而且分布于线粒体的PpIX比弥漫分布于细胞质的PpIX具有更强的PDT效应. 结果提示能作用于线粒体的光敏剂是未来新光敏剂研制的重点. 因而一种光敏剂的PDT效果不能单纯靠细胞积聚程度和光激活敏感性来判断, 更重要的是在细胞内的分布位置, 研究这些光化学敏感位点与PDT的关系有助于寻找提高PDT效能的手段.
食管癌是世界范围内常见的消化系恶性肿瘤之一, 提高食管癌治疗效果的关键是早期发现、早期诊断、早期治疗. 但早期癌术后远期死亡原因中复发癌是主要的, 所以早期食管癌的综合治疗对提高生存率非常重要.
沈琳, 主任医师, 北京大学临床肿瘤医院消化内科
目前有关PDT的作用机制和影响PDT疗效因素, 特别是新型光敏剂的研发并了解其在肿瘤组织内的不同分布和亚细胞分布方式、光敏作用的具体靶细胞器及对光动力学效应的影响成为关注热点.
Morgan et al报道ALA-PDT主要诱导线粒体的损伤, 这是由于ALA是细胞内血红素合成途径中的中间产物, 而血红素的合成是在线粒体内进行的. 细胞吸收的光敏剂或内部合成的内源性光敏剂并不总位于光化学敏感位点, 研究这些光化学敏感位点与PDT的关系有助于寻找提高PDT效能的手段.
本研究利用能在细胞内产生内源性光敏剂PpIX的ALA和外源性PpIX作为光敏剂处理细胞, 研究不同来源的PpIX在人食管鳞癌细胞系KYSE-450、KYSE-70及人食管上皮永生细胞系Het-1A中的分布特征以及与光动力学效应的关系, 以期为新光敏剂的开发和治疗手段的改善提供实验依据.
光动力学疗法: 经口服或局部应用的光敏剂能选择性积蓄于肿瘤细胞和组织内, 在分子氧的存在下, 经特定波长的可见光激发能产生单态氧和氧自由基等活性物质, 导致肿瘤细胞凋亡或坏死.
本研究选题较好, 实验过程严谨, 结论可靠, 具有重要的应用价值.
编辑: 李军亮 电编: 何基才
| 2. | Peng Q. Editorial: photodynamic therapy and detection. J Environ Pathol Toxicol Oncol. 2006;25:1-5. [PubMed] |
| 3. | Peng Q, Nesland JM. Effects of photodynamic therapy on tumor stroma. Ultrastruct Pathol. 2004;28:333-340. [PubMed] [DOI] |
| 4. | 汲 振余, 赵 立群, 杨 观瑞, 薛 乐勋, 索 振河, Nesland JM, 彭 迁. 食管鳞癌细胞分化状态对内源性光敏剂PpIX产量的影响及对PDT的应答. 世界华人消化杂志. 2006;14:6-11. [DOI] |
| 5. | Juzeniene A, Peng Q, Moan J. Milestones in the development of photodynamic therapy and fluorescence diagnosis. Photochem Photobiol Sci. 2007;6:1234-1245. [PubMed] [DOI] |
| 6. | Dögnitz N, Salomon D, Zellweger M, Ballini JP, Gabrecht T, Lange N, van den Bergh H, Wagnières G. Comparison of ALA- and ALA hexyl-ester-induced PpIX depth distribution in human skin carcinoma. J Photochem Photobiol B. 2008;93:140-148. [PubMed] [DOI] |
| 7. | Wainwright M. Photodynamic therapy: the development of new photosensitisers. Anticancer Agents Med Chem. 2008;8:280-291. [PubMed] [DOI] |
| 8. | Kinzler I, Haseroth E, Hauser C, Rück A. Role of mitochondria in cell death induced by Photofrin-PDT and ursodeoxycholic acid by means of SLIM. Photochem Photobiol Sci. 2007;6:1332-1340. [PubMed] [DOI] |
| 9. | Juarranz A, Jaén P, Sanz-Rodríguez F, Cuevas J, González S. Photodynamic therapy of cancer. Basic principles and applications. Clin Transl Oncol. 2008;10:148-154. [PubMed] [DOI] |
| 10. | Tsai JC, Wu CL, Chien HF, Chen CT. Reorganization of cytoskeleton induced by 5-aminolevulinic acid-mediated photodynamic therapy and its correlation with mitochondrial dysfunction. Lasers Surg Med. 2005;36:398-408. [PubMed] [DOI] |
| 11. | Ji Z, Yang G, Shahzidi S, Tkacz-Stachowska K, Suo Z, Nesland JM, Peng Q. Induction of hypoxia-inducible factor-1alpha overexpression by cobalt chloride enhances cellular resistance to photodynamic therapy. Cancer Lett. 2006;244:182-189. [PubMed] [DOI] |
| 12. | Hilf R. Mitochondria are targets of photodynamic therapy. J Bioenerg Biomembr. 2007;39:85-89. [PubMed] [DOI] |
| 13. | Lu Y, Jiao R, Chen X, Zhong J, Ji J, Shen P. Methylene blue-mediated photodynamic therapy induces mitochondria-dependent apoptosis in HeLa cell. J Cell Biochem. 2008;105:1451-1460. [PubMed] [DOI] |
| 14. | Furre IE, Møller MT, Shahzidi S, Nesland JM, Peng Q. Involvement of both caspase-dependent and -independent pathways in apoptotic induction by hexaminolevulinate-mediated photodynamic therapy in human lymphoma cells. Apoptosis. 2006;11:2031-2042. [PubMed] [DOI] |
| 15. | Reiners JJ Jr, Caruso JA, Mathieu P, Chelladurai B, Yin XM, Kessel D. Release of cytochrome c and activation of pro-caspase-9 following lysosomal photodamage involves Bid cleavage. Cell Death Differ. 2002;9:934-944. [PubMed] |
| 16. | Barge J, Decréau R, Julliard M, Hubaud JC, Sabatier AS, Grob JJ, Verrando P. Killing efficacy of a new silicon phthalocyanine in human melanoma cells treated with photodynamic therapy by early activation of mitochondrion-mediated apoptosis. Exp Dermatol. 2004;13:33-44. [PubMed] [DOI] |
| 17. | Lechardeur D, Dougaparsad S, Nemes C, Lukacs GL. Oligomerization state of the DNA fragmentation factor in normal and apoptotic cells. J Biol Chem. 2005;280:40216-40225. [PubMed] [DOI] |
| 18. | Kessel D, Luguya R, Vicente MG. Localization and photodynamic efficacy of two cationic porphyrins varying in charge distributions. Photochem Photobiol. 2003;78:431-435. [PubMed] [DOI] |
| 19. | Nagata S, Obana A, Gohto Y, Nakajima S. Necrotic and apoptotic cell death of human malignant melanoma cells following photodynamic therapy using an amphiphilic photosensitizer, ATX-S10(Na). Lasers Surg Med. 2003;33:64-70. [PubMed] [DOI] |