修回日期: 2009-04-09
接受日期: 2009-04-13
在线出版日期: 2009-05-28
目的: 探讨中国人群中IL-6基因启动子中单核苷酸多态性与HBV感染的遗传易感性关联.
方法: 提取160例HBV感染者及212例健康献血者外周血基因组DNA, 用PCR-RFLP方法检测两组人群中G-174C、G-572C和G-597A三个多态性位点的基因型. 性别、吸烟、饮酒以及Hardy-Weinberg等采用Chi-square Test检测, 多态性与HBV感染者风险关联及亚组关联的统计学分析采用非条件Logistic回归并同时校正混杂因素.
结果: PCR-RFLP检测结果显示: IL-6基因启动子中G-174C和G-597A两个位点在中国人群中不存在多态性, 而G-572C处的多态性在人群中普遍存在, 其多态性位点等位基因频率分布符合Hardy-Weinberg平衡定律. 统计分析表明该位点的多态性在两组人群中有明显的差异(G/C vs G/G, OR = 2.65, P<0.05; C/C vs G/G, OR = 3.31, P<0.05); 亚组分析中表明<30岁的年龄组中差异显著(G/G vs G/C或C/C, OR = 16.92, P<0.05).
结论: 在中国汉族人群中, IL-6基因启动子中-572处的多态性对于乙型肝炎的发生有着显著的易患关系, 同时年龄对于这种易感关联有着协同作用.
引文著录: 戴悦, 刘晓琳, 柴庆波, 盖郁慧, 李岩, 刘宝国. 中国部分汉族人群中IL-6基因启动子-572G/C多态性与HBV感染易感性的关系. 世界华人消化杂志 2009; 17(15): 1522-1526
Revised: April 9, 2009
Accepted: April 13, 2009
Published online: May 28, 2009
AIM: To evaluate the association of IL-6 gene promoter polymorphism with the infection of hepatitis B virus (HBV) in Chinese population.
METHODS: The genome DNA was obtained from blood samples and three IL-6 promoter polymorphisms (G-174C, G-572C and G-597A) were evaluated using PCR-RFLP in 160 HBV-infected patients and 212 healthy controls. Frequencies of single-nucleotide polymorphisms (SNPs) in the control group were compared with those of the HBV infection. Furthermore, subgroups of chronic carriers were compared among them. For cases and controls, the distribution of gender, age, smoking, drinking and Hardy-Weinberg equilibrium equation of the IL-6 genotype was determined using Chi-square Test; and the diversity of age using Mann-Whitney U-test. The unconditional Logistic regression model was used to analyze the statistical association of genotypes in two groups adjusted for confused factors.
RESULTS: No polymorphism at position -174 and -597 was detected in all participants, but significant difference was found in the polymorphism at position -572 between the cases and controls (G/C vs G/G, OR = 2.65, P < 0.05; C/C vs G/G, OR = 3.31, P < 0.05). Subgroups analysis, revealed the odds ratio value in the less than thirty years old group (G/G vs G/C or C/C, OR = 16.92, P < 0.05).
CONCLUSION: The data reveal that the polymorphism at position -572 of the IL-6 gene promoter may be associated with the susceptibility to HBV infection; meanwhile, the age is a coordinative risk factor.
- Citation: Dai Y, Liu XL, Chai QB, Gai YH, Li Y, Liu BG. Relationship between the -572G/C polymorphism in IL-6 gene promoter and hepatitis virus B infection in Chinese Han population. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1522-1526
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1522.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1522
乙型肝炎病毒(hepatitis virus B, HBV)感染是世界性的严重公共卫生问题. 全球约3.5-4.0亿人群感染HBV, 占世界总人口的5%. 我国HBsAg阳性者约有1.2亿, 占总人口10%左右[1], 每年新增3000万HBV感染者, 而这一数字目前正呈上升趋势. 据统计, 全球每年约有50-120万人死于HBV感染相关性疾病, 占疾病死亡原因的第9位[2]. 几十年来, 国内外科学工作者们对HBV感染的易感因素进行了广泛的流行病学调查, 目前HBV感染已被认为是由病毒本身(如病毒的基因型甚至亚型)以及宿主自身遗传因素之间的复杂的相互作用引起的[3-4]. 虽然病毒基因组变异及其他常规风险因素, 如: 年龄、性别、其他种类的肝炎病毒共感染等与HBV感染密切相关, 但宿主的遗传因素在其中所起的作用受到越来越多的重视.
近年来, 国内有关宿主免疫相关基因的遗传多态性与HBV感染之间的关联研究已经有所开展[5-10], 并取得了一些较为明确的研究结果. 本研究选择IL-6基因启动子区的3个位点: -174、-572、-597作为研究对象, 利用PCR-RFLP技术检测在中国HBV感染者及与之相匹配的正常人群中的多态性, 以期进一步了解和发现与HBV感染相关联的免疫遗传易感因素.
用严格的流行病学病例对照研究方法. 病例组选自2003-2006年在北京大学血液标本库(第一附属医院输血科)HBV感染者的DNA样本, 其中男88例, 女72例, 平均年龄38.92±14.88岁, 共160例, 均经酶联免疫法(ELISA)确诊, 所有HBV感染者均排除甲、丙、戊型肝炎病毒感染, 诊断均符合2000年西安会议制定的《病毒性肝炎防治方案》中的诊断标准, 并排除合并HIV及其他肝炎病毒感染、排除合并肝硬化、自身免疫性肝病、肝癌等[11]. 对照组为北京大学血液标本库健康人血液DNA样本, 其中男108例, 女104例, 平均年龄40.26±13.21岁, 共212例. 同时, 收集每一例受检者一般资料及临床资料, 每一位受检对象均事先书面签署的知情同意书.
1.2.1 DNA抽提: 采用酚/氯仿抽提、无水乙醇沉淀法分别提取HBV感染者、健康人外周血DNA共372例, 采用玻璃奶沉淀法纯化DNA[12].
1.2.2 多态性位点的选择及引物设: 从文献[13] http://www.ncbi.nlm.nih.gov/SNP/数据库中报道的IL-6基因启动子区多态性位点中选择了-174、-572、-597三个位点(表1). 根据检索到的IL-6基因启动子区位点相对应的基因序列, 利用Primer5.0软件, 分别设计每个位点的PCR扩增引物. 引物由上海申友生物技术有限公司合成, 引物序列见表1.
| 多肽位点 | PCR 引物序列 | 退火温度(℃) | 扩增片段(bp) | 内切酶 | 酶切片段(bp) |
| -174 G→C | 5'-ATGCCAAAGTGCTGAGTC-3' | 59.6 | 212 | NlaⅢ | 125+87 |
| 5'-AATCTTTGTTGGAGGGTGAG-3' | |||||
| -572 G→C | 5'-TGAAGCAGGTGAAGAAAG-3' | 59.8 | 394 | BsrB I | 124+270 |
| 5'-CAAAGAGTAAAGCTGAAGTC-3' | |||||
| -597 G→A | 5'-TGAAGCAGGTGAAGAAAG-3' | 60.5 | 394 | Fok I | 110+284 |
| 5'-CAAAGAGTAAAGCTGAAGTC-3' |
1.2.3 PCR反应体系及反应条件程序: 扩增体系及程序如下: ddH2O 40.5 μL, 10×PCR缓冲液(含1.5 mmol/L Mg2+)5 μL, 10 mmol/L dNTP 1 μL, Taq酶0.5 μL(5 U/μL)Promega Company, USA), 上、下游引物各1 μL(20 μmol/L), DNA模板1 μL(500 ng). 扩增采用程序: 94℃预变性2 min后, 94℃变性40 s→退火40 s(温度参照表1), →72℃延伸40 s, 共30个循环, 然后在72℃条件下延伸10 min. PCR产物采用Millipore公司的Multiscreen-PCR纯化板进行纯化(Millipore Company, USA)
1.2.4 RFLP方法判断三个多态性位点的个体基因型: 所有个体PCR产物经纯化后, 分别采用限制性内切酶NlaⅢ、BsrBⅠ、FokⅠ(New England Biolabs Beverly, Ma, USA)对: -174、-572、-597三个位点进行酶切. 每个反应体系(20 μL反映体系含有DNA约1 μg)加内切酶3 U, 加相应的10×Buffer 2 μL, 最终加ddH2O至20 μL. 均在37℃下水浴2 h, 然后进行琼脂糖(Agarose-1000; Gibco BRL, Rockville, MD, USA)电泳, 根据电泳条带数判断每一个体不同位点的基因型.
统计学处理 以Mann-Whitney U-t检验比较病例组与对照组之间年龄分布的差异, 以χ2检验验证基因型频率是否与Hardy-Weinberg平衡定律. 多态性与HBV感染风险之间的相关性以比值比(OR值)及其95%置信区间(confidence intervals, CI)表示, OR值及其95%CI以非条件Logistic回归模型计算, 均经年龄、性别、吸烟、饮酒等混杂因素校正. 所有的统计检验均为双侧概率检验, P<0.05表示具有统计学意义, 统计学分析使用SPSS11.5软件(SPSS 11.5 for Windows, Chicago, IL).
用Mann-Whitney U方法比较病例组与对照组之间年龄分布有差异(P = 0.135), 结果显示差异没有显著性; 在病例与对照组的研究中, 性别、吸烟、饮酒等均无统计学差异(P>0.05, 表1), 两组人群之间呈现良好的匹配性(表2).
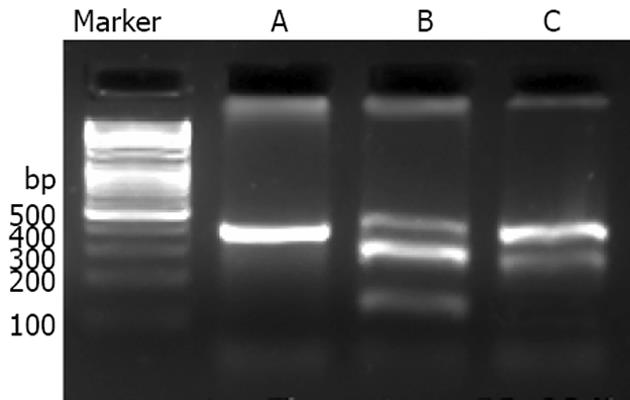
病例组和对照组人群中三个多态性位点经PCR-RFLP检测后结果显示: -174位点在我们检测的总372例样本中没有多态性存在, -597位点只出现4例(1.08%), -572位点多态性出现频率较高(图1), 故而我们对-572位点进行了进一步与HBV感染易感的风险关联分析.
160例HBV病毒感染者与212名健康人的IL-6启动子区-572位点多态性明确后, 进行三种基因型频率统计, 经检验P>0.05, 等位基因的频率分布符合Hardy-Weinberg平衡定律. -572位点多态性在正常人群与HBV病毒感染者两组间, G/C→G/G基因型频率的比较差异有显著性(P = 0.034, OR = 2.65, 95%CI 1.08-6.53), C/C→G/G基因型频率的比较差异同样有显著性(P = 0.011, OR = 3.31, 95%CI 1.32-8.33)(表3).
| 变量 | 病例组 | 对照组 | P值 | OR(95% CI) |
| G/G | 7 | 23 | - | 1.00 |
| G/C | 87 | 116 | 0.034 | 2.65(1.08-6.53) |
| C/C | 66 | 73 | 0.011 | 3.31(1.32-8.33) |
在-572/C位点多态性位点与HBV病毒感染的关联分析中, 我们将年龄、性别、进行了分层分析, 考虑多态性C/C基因型存在频率较低, 我们将杂和基因型G/C与纯合基因型C/C合并为一组进行统计分析. 在年龄的分层比较中结果显示低年龄组中(≤30), 呈现了一个较强的易感性(P = 0.011, OR = 16.92, 95%CI 1.91-149.94), 而高年龄组的分层分析中差异没有显著性; 在性别的分层比较中结果显示男女各组之间差异没有显著性(表4).
| 变量 | 病例 (n) | 对照(n) | P值 | OR(95% CI) | ||
| G/G | G/C和C/C | G/G | G/C和C/C | |||
| 年龄(岁) | ||||||
| ≤30 | 1 | 53 | 13 | 49 | 0.011 | 16.92(1.91-149.94) |
| 31-44 | 3 | 55 | 5 | 70 | 0.688 | 1.36(0.30-6.07) |
| ≥45 | 3 | 45 | 6 | 69 | 0.725 | 1.33(0.27-6.67) |
| 性别 | ||||||
| 男 | 7 | 81 | 10 | 98 | 0.695 | 0.81(0.28-2.34) |
| 女 | 1 | 71 | 13 | 91 | 0.895 | 3.03(0.75-7.19) |
人IL-6基因位于染色体7p21上, 全长5 kb, 含4个内含子、5个外显子, 他编码由184个氨基酸构成的IL-6蛋白. IL-6目前被认为是炎症起始阶段的一个重要的相关因子, 他通过诱导多种细胞合成和分泌多种急性期蛋白, 在病毒感染时促进B淋巴细胞增殖、分化及产生免疫球蛋白, 同时促进T淋巴细胞增殖、分化等, 在病毒感染的炎症反应中扮演着十分重要的角色. 目前的研究发现NF-κB、Fos/Jun及糖皮质激素受体等转录因子与IL-6基因启动子区相应序列结合后, 可在转录水平高度调控IL-6基因的表达[14-17]. 因此IL-6基因启动子区的多态性可能会导致其个体间基因转录与表达的差异, 进而影响到个体对病毒感染疾病的易感性.
在我们的研究中发现, IL-6启动子区三个多态性位点-174位点在检测的总372例样本中没有多态性存在, -597位点只出现4例(1.08%), -572位点多态性出现频率较高, 该3个位点的频率结果与其他国家的研究报道不一致, 体现了多态性种族差异性所在[13,18-19]. IL-6启动子区-572位点多态性3种基因型频率统计结果显示, -572位点多态性在正常人群与HBV病毒感染者间, G/C→G/G基因型频率的比较差异有显著性(OR = 2.65, 95%CI 1.08-6.53); C/C→G/G基因型频率的比较差异同样有显著性(OR = 3.31, 95%CI 1.32-8.33), 因此结果高度提示了该位点与HBV感染的易感风险关联. 另外在分层分析的研究中, -572位点多态性在性别分组中没有明显的易感关联性(P>0.05), 而在年龄分层的统计结果显示在低年龄组中(≤30), -572位点多态性对于HBV感染呈现了一个较强的易感性(OR = 16.92, 95%CI 1.91-149.94), 对于高年龄组的分层分析中差异没有显著性(P>0.05).
总之, IL-6基因启动子区-572位点多态性可以考虑为HBV感染的易感危险因素, 但该位点的多态性在HBV感染患者中的不同血清水平表达水平, 以及如何参与干预HBV病毒复制或者清除以及影响HBV感染的发生和发展的机制, 仍需进一步的研究阐明.
目前HBV感染已被认为是由病毒本身(如病毒的基因型甚至亚型)以及宿主自身遗传因素之间的复杂的相互作用引起的. 虽然病毒基因组变异及其他常规风险因素, 如: 年龄、性别、其他种类的肝炎病毒共感染等与HBV感染密切相关, 但宿主的遗传因素在其中所起的作用受到越来越多的重视. 近年来, 国内有关宿主免疫相关基因的遗传多态性与HBV感染之间的关联研究已经有所开展, 并取得了一些较为明确的研究结果.
魏经国, 教授, 中国人民解放军第四军大学唐都医院放射科.
IL-6基因启动子区-572位点多态性可以考虑为HBV感染的易感危险因素, 但该位点的多态性在HBV感染患者中的不同血清水平表达水平, 以及如何参与干预HBV病毒复制或者清除以及影响HBV感染的发生和发展的机制, 仍需进一步的研究阐明.
目前的研究发现NF-κB、Fos/Jun及糖皮质激素受体等转录因子与IL-6基因启动子区相应序列结合后, 可在转录水平高度调控IL-6基因的表达.
本文就IL-6基因启动子-572G/C多态性与HBV感染易感性进行了探讨, 取材可信, 分组得当, 结论有新意.
编辑: 李军亮 电编:吴鹏朕
| 1. | Ou DP, Yang LY, Huang GW, Tao YM, Ding X, Chang ZG. Clinical analysis of the risk factors for recurrence of HCC and its relationship with HBV. World J Gastroenterol. 2005;11:2061-2066 ]. |
| 2. | Tran TT, Martin P. Hepatitis B: epidemiology and natural history. Clin Liver Dis. 2004;8:255-266. [PubMed] [DOI] |
| 3. | Chu RH, Ma LX, Wang G, Shao LH. Influence of HLA-DRB1 alleles and HBV genotypes on interferon-alpha therapy for chronic hepatitis B. World J Gastroenterol. 2005;11:4753-4757. [PubMed] |
| 4. | Han YN, Yang JL, Zheng SG, Tang Q, Zhu W. Relationship of human leukocyte antigen class II genes with the susceptibility to hepatitis B virus infection and the response to interferon in HBV-infected patients. World J Gastroenterol. 2005;11:5721-5724. [PubMed] |
| 5. | 戴 悦, 宁 涛, 李 坤, 綦 素霞, 蒋 明伟, 柴 庆波, 盖 郁慧, 汪 欣. LMP2/LMP7基因多态性与人群中乙型肝炎病毒感染相关性研究. 北京大学学报医学版. 2005;37:508-512. |
| 6. | 李 坤, 戴 悦, 阴 秀丽, 綦 素霞, 宁 涛, 曹 邦伟, 徐 昌青. 中国华北地区人群TAP1基因多态性与乙肝关联性的研究. 胃肠病学和肝病学杂志. 2005;14:66-70. |
| 7. | Xu C, Qi S, Gao L, Cui H, Liu M, Yang H, Li K, Cao B. Genetic polymorphisms of LMP/TAP gene and hepatitis B virus infection risk in the Chinese population. J Clin Immunol. 2007;27:534-541. [PubMed] [DOI] |
| 8. | Qi S, Cao B, Jiang M, Xu C, Dai Y, Li K, Wang K, Ke Y, Ning T. Association of the -183 polymorphism in the IFN-gamma gene promoter with hepatitis B virus infection in the Chinese population. J Clin Lab Anal. 2005;19:276-281. [PubMed] [DOI] |
| 9. | Cao B, Yang H, Ding H, Qi S, Gao L, Cui H, Dai Y, Xu C. Association analysis of hepatitis virus B infection with haplotypes of the TBX21 gene promoter region in the Chinese population. Clin Chem Lab Med. 2007;45:333-338. [PubMed] [DOI] |
| 10. | Yu H, Zhu QR, Gu SQ, Fei LE. Relationship between IFN-gamma gene polymorphism and susceptibility to intrauterine HBV infection. World J Gastroenterol. 2006;12:2928-2931. [PubMed] |
| 11. | Ke CZ, Chen Y, Gong ZJ, Meng ZJ, Liu L, Ren ZJ, Zhou ZH. Dynamic changes of HBV DNA in serum and peripheral blood mononuclear cells of chronic hepatitis patients after lamivudine treatment. World J Gastroenterol. 2006;12:4061-4063. [PubMed] |
| 13. | Christiansen L, Bathum L, Andersen-Ranberg K, Jeune B, Christensen K. Modest implication of interleukin-6 promoter polymorphisms in longevity. Mech Ageing Dev. 2004;125:391-395. [PubMed] [DOI] |
| 14. | Riedemann NC, Guo RF, Hollmann TJ, Gao H, Neff TA, Reuben JS, Speyer CL, Sarma JV, Wetsel RA, Zetoune FS. Regulatory role of C5a in LPS-induced IL-6 production by neutrophils during sepsis. FASEB J. 2004;18:370-372. [PubMed] |
| 15. | Steensberg A, Fischer CP, Keller C, Muller K, Pedersen BK. IL-6 enhances plasma IL-1ra, IL-10, and cortisol in humans. Am J Physiol Endocrinol Metab. 2003;285:E433-E437. [PubMed] |
| 16. | Suwa T, Hogg JC, Klut ME, Hards J, van Eeden SF. Interleukin-6 changes deformability of neutrophils and induces their sequestration in the lung. Am J Respir Crit Care Med. 2001;163:970-976. [PubMed] |
| 17. | Asensi V, Valle E, Meana A, Fierer J, Celada A, Alvarez V, Paz J, Coto E, Carton JA, Maradona JA. In vivo interleukin-6 protects neutrophils from apoptosis in osteomyelitis. Infect Immun. 2004;72:3823-3828. [PubMed] [DOI] |
| 18. | Bennermo M, Held C, Green F, Strandberg LE, Ericsson CG, Hansson LO, Watkins H, Hamsten A, Tornvall P. Prognostic value of plasma interleukin-6 concentrations and the -174 G > C and -572 G > C promoter polymorphisms of the interleukin-6 gene in patients with acute myocardial infarction treated with thrombolysis. Atherosclerosis. 2004;174:157-163. [PubMed] [DOI] |
| 19. | Ferrari SL, Ahn-Luong L, Garnero P, Humphries SE, Greenspan SL. Two promoter polymorphisms regulating interleukin-6 gene expression are associated with circulating levels of C-reactive protein and markers of bone resorption in postmenopausal women. J Clin Endocrinol Metab. 2003;88:255-259. [PubMed] [DOI] |