修回日期: 2009-04-15
接受日期: 2009-04-20
在线出版日期: 2009-05-28
目的: 观察槐耳清膏对体外培养人结肠癌SW480细胞系VEGF和HIF-1α表达的影响.
方法: 体外培养人结肠癌SW480细胞48 h, 随机分为常氧对照组(NC组)、低氧对照组(HC组)和低氧槐耳组(HH组), HH组RPMI 1640培养基含槐耳清膏(终浓度1 g/L). 半定量RT-PCR检测SW480细胞VEGF和HIF-1α mRNA表达水平, Western blot检测两者蛋白表达水平.
结果: HH组和HC组VEGF、HIF-1α mRNA表达水平均显著高于NC组(4.71±0.07, 4.54±0.02 vs 1.19±0.03; 5.68±0.07, 5.58±0.05 vs 1.21±0.05, 均P<0.05), 但HH组与HC组比较无统计学差异. HC组VEGF、HIF-1α蛋白表达均显著显著高于NC组(0.66±0.03 vs 0.38±0.02; 0.58±0.04 vs 0.31±0.03, 均P<0.05), 与HC组比较, HH组VEGF和HIF-1α蛋白表达均显著下降(0.37±0.03, 0.30±0.05, 均P<0.05).
结论: 槐耳清膏通过下调人结肠癌SW480细胞内HIF-1α和VEGF蛋白表达抑制肿瘤生成.
引文著录: 吕赤, 苏琪, 徐锋, 殷红专. 槐耳清膏对缺氧结肠癌SW480细胞VEGF及HIF-1α表达的影响. 世界华人消化杂志 2009; 17(15): 1504-1507
Revised: April 15, 2009
Accepted: April 20, 2009
Published online: May 28, 2009
AIM: To investigate the effect of Huaier cream on expression of VEGF and HIF-1α in SW480 colon cancer cell in vitro.
METHODS: Human SW480 colon cancer cells were cultured for 48 h in vitro and randomly divided into normoxic control group (NC group), hypoxia control group (HC group) and hypoxia group treated with Huaier at the concentration of 1 g/L (HH group). Levels of mRNA and protein expression of VEGF and HIF-1α in each group were detected using semi-quantitative RT-PCR and Western blot, respectively.
RESULTS: VEGF or HIF-1α mRNA expression levels were found significantly higher in HC group and HH group than in NC group (4.71 ± 0.07, 4.54 ± 0.02 vs 1.19 ± 0.03; 5.68 ± 0.07, 5.58± 0.05 vs 1.21 ± 0.05, all P < 0.05), but not significantly different between HC group and HH group. VEGF or HIF-1α protein were also over expressed in HC group than in NC group (0.66 ± 0.03 vs 0.38 ± 0.02; 0.58 ± 0.04 vs 0.31 ± 0.03, both P < 0.05). In HH group, however, the protein levels of HIF-1α and VEGF were inhibited significantly compared with HC group (0.37 ± 0.03; 0.30 ± 0.05, all P < 0.05).
CONCLUSION: Huaier cream down- regulates the protein expression of HIF-1α and VEGF of SW480 cells which may be one of the mechanisms of anti-tumorigenesis.
- Citation: Lv C, Su Q, Xu F, Yin HZ. Effect of Huaier cream on expression of VEGF and HIF-1α in colon cancer cells SW480 under hypoxia in vitro. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1504-1507
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1504.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1504
在我国大肠癌是发病率及病死率较高的消化系恶性肿瘤, 研究大肠癌的治疗具有重要的临床意义. 中药在恶性肿瘤治疗中发挥着不可忽视的作用, 有研究证明金克槐耳能诱导直肠癌细胞凋亡, 但其作用机制尚不明确[1]. 早在1971年Folkman首次提出"肿瘤的生长和转移依赖于新生血管形成"的观点, 血管内皮生长因子(vascular endothelial growth factor, VEGF)是重要的促进血管生成因子之一. 虽然抑制肿瘤血管新生早已成为当前抗肿瘤治疗热点之一[2], 但金克槐耳是否具有抗结肠癌新生血管生成的作用尚未见文献报道. 本研究以人结肠癌SW480细胞株为对象, 研究缺氧条件下槐耳清膏对血管内皮生长因子(vascular endothelial growth factor, VEGF)及其调节基因缺氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)的抑制作用, 初步探讨槐耳清膏在抑制肿瘤新生血管形成方面的作用机制, 为结肠癌临床治疗提供新的理论和实验依据.
人结肠癌SW480细胞株购于ATCC细胞库. RPMI 1640培养基购于Gibco公司. 小牛血清购于Clarkbio公司. 总RNA提取试剂、反转录试剂盒、Taq聚合酶均购于TaKaRa公司. 上下游引物由Invitrogen公司合成. HIF-1α pAb和VEGF mAb购于Santa Cruz公司. 槐耳清膏由江苏启东盖天力药业有限公司提供.
1.2.1 细胞分组及培养: 人结肠癌细胞SW480培养于含100 g/L小牛血清、1 kU/L青霉素、1 mg/L链霉素的RPMI 1640培养基中, 置于37℃, 50 mL/L CO2, 200 mL/L O2的培养箱, 取对数生长期细胞, 随机分为常氧对照组(NC组)、低氧对照组(HC组)和低氧槐耳组(HH组). NC组继续常氧培养48 h, 其余2组低氧(37℃, 940 mL/L N2、50 mL/L CO2、10 mL/L O2)培养48 h, 其中HC组低氧不给药, HH组为RPMI 1640含终浓度1 g/L槐耳清膏(通过前期预实验证实1 g/L为最佳药效浓度).
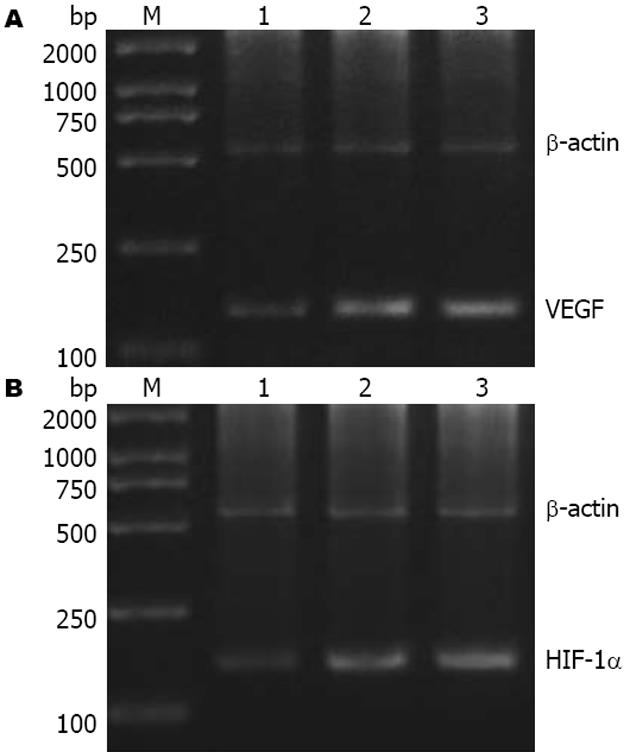
1.2.2 半定量RT-PCR方法检测VEGF mRNA和HIF-1α mRNA: 收集培养细胞, 采用TRIzol两步法提取各组SW480细胞内的总RNA, 测定A260/A280计算总RNA纯度和浓度. 每组取1 µg总RNA, 按试剂盒说明合成cDNA第1链, 以此cDNA为模板进行PCR反应. PCR反应条件如下: 94℃预变性3 min, 94℃变性30 s, 53℃/49℃/55.5℃(VEGF/HIF-1α/β-actin)退火40 s, 72℃延伸40 s, 共35个循环. 72℃延伸7 min, 4℃冷却. 取PCR产物进行琼脂糖电泳. Gene Snap凝胶成像系统照相并进行灰度值分析, 以条带吸光度(A)值代表其目的片段的表达量, 以内参照β-actin的量校正, 取二者A值之比进行分析. 每组实验重复3次. RT-PCR中所引用引物见表1.
| 引物 | 序列 | 大小(bp) | 温度(℃) |
| VEGF | CTTGCCTTGCTGCTCTAC | 150 | 53 |
| GATGTCCACCAGGGTCTC | |||
| HIF-1α | AGTGTACCCTAACTAGCC | 159 | 49 |
| CACAAATCAGCACCAAGC | |||
| β-actin | GTGGGGCGCCCCAGGCACCA | 508 | 55.5 |
| CTCCTTAATGTCACGCACGAT |
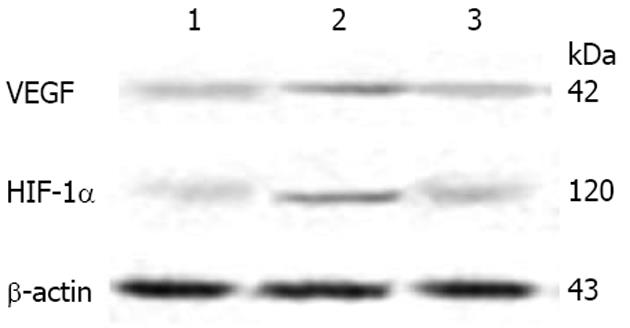
1.2.3 Western blot检测各组细胞内VEGF, HIF-lα蛋白的表达: 取各组细胞, 按试剂盒说明提取蛋白并用BCA法蛋白定量. 各组上样蛋白经SDS-PAGE电泳分离后, 湿转至PVDF膜上. 50 g/L脱脂奶粉37℃封闭2 h. 分别加入鼠抗人VEGF一抗(1∶200稀释), 兔抗人HIF-lα一抗(1∶200稀释)和兔抗人β-actin一抗(1∶1000稀释), 4℃孵育过夜. TBST洗3次, 加入辣根过氧化物酶标记的羊抗兔IgG或羊抗鼠IgG二抗(1∶2000稀释), 37℃孵育2 h. TBST洗3次, 增强化学发光剂(ECL)显色. Gene Snap凝胶成像系统照相. 用β-actin为内对照,以阳性条带与内对照β-actin A值比作为阳性条带的相对表达值. 每组实验重复3次.
统计学处理 采用SPSS 13.0统计软件进行数据分析. 所有数据以mean±SD表示, 数据比较采用两独立样本t检验, Spearman相关分析, P<0.05有统计学差异.
HC组和HH组VEGF及HIF-1α mRNA表达水平均显著高于NC组(P<0.05). 但HH组与HC组比较两者无统计学差异(P>0.05, 表2, 图1).
HC组VEGF及HIF-1α蛋白表达水平较NC组显著增加(P<0.05). HH组VEGF和HIF-1α蛋白表达水平明显低于HC组(P<0.05), 且低于NC组水平, 但无统计学差异(P>0.05, 表2, 图2).
HH组中VEGF mRNA与HIF-1α mRNA表达呈正相关(r = 0.943, P = 0.000); HH组中VEGF与HIF-1α蛋白表达呈正相关(r = 0.919, P = 0.000).
缺氧是恶性肿瘤发生发展过程中的普遍现象. 当实体肿瘤处于生长旺盛时期, 局部的氧供无法满足肿瘤细胞存活和生长需要, 微环境就会缺氧. 缺氧能激活多种血管生成相关因子表达[3-4], 此时新生血管的生成有利于肿瘤细胞的生存并增强其浸润和转移能力, 而新生血管形成和血管通透性增加被认为是血管内皮细胞生长因子相关疾病主要发病因素[5]. 因此对缺氧的适应和新生血管的形成是恶性肿瘤发展过程的关键步骤. VEGF可以通过诱导内皮细胞分裂、增殖、迁移, 促进新生血管的生成和肿瘤细胞的浸润转移, 是目前所知的作用最强的促进VEGF. VEGF表达上调, 能使结肠癌组织血管的生成增加, 为肿瘤的生长提供更多的营养物质, 有利于肿瘤细胞的生长与转移[6]. 另有研究显示: VEGF反义核苷酸够通过降低VEGF基因的表达, 抑制人大肠癌HT-29细胞的体外增殖, 并对其具有一定的凋亡诱导作用[7]. HIF-1是缺氧条件下广泛存在于哺乳动物和人体内的一种异源二聚体转录因子, 主要由HIF-1α和HIF-1β两个亚单位组成, 其中HIF-1α是唯一的氧调节亚单位, 决定HIF-1的活性[8-9]. 实体肿瘤中HIF-1α可以参与调节适应缺氧环境的多种基因转录, 包括VEGF、SDF-1、CXCR4[10]. 缺氧条件下HIF在多个层面调节VEGF表达, 包括增加VEGF mRNA稳定性和增强VEGF的活性[11]. 研究显示抑制HIF-1α表达可以抑制血管生成相关基因表达[12].
槐耳清膏是槐耳菌质发酵后的热水提取物, 含有多种有机成分和10余种矿物质元素, 主要活性成分为多糖蛋白(PS-T). 有研究发现槐耳通过下调患者血清VEGF的表达, 可降低原发性肝癌的转移复发率[13]. 体外研究槐耳清膏对VEGF诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC)增殖和分化成血管能力的影响, 发现槐耳明显抑制VEGF诱导的内皮细胞增殖[14]. 有关槐耳清膏具体通过何种途径调节VEGF从而发挥抑制新生血管的作用, 国内外文献尚未有报道. 本实验研究槐耳清膏抑癌作用是否与其影响血管生成相关基因VEGF及HIF-1α的表达有关.
本实验选用人结肠癌SW480细胞, 体外实验结果表明: 缺氧状态下, 细胞内VEGF及HIF-1α mRNA较常氧状态下显著高表达, 进而导致相应蛋白高表达. 表明肿瘤细胞在氧供不足的情况下, 通过上述基因促进新生血管形成, 适应缺氧环境并满足自身生存需要. 予以槐耳清膏作用后, 与血管生成相关蛋白: VEGF及HIF-1α表达均显著下降, 提示槐耳清膏抗结肠癌的作用可能与其抑制肿瘤细胞VEGF和HIF-1α的表达有关, 即可能通过抑制VEGF和HIF-1α蛋白的表达, 抑制肿瘤细胞的生长; 降低新生血管的生成等环节, 发挥抗癌功效. 值得注意的是, 本文的实验结果证明: 虽然槐耳清膏可引起肿瘤细胞VEGF和HIF-1α蛋白的表达降低, 但用药后VEGF及HIF-1α mRNA表达却无显著降低. 其原因我们认为可能是: (1)槐耳清膏并非在基因水平上调节HIF-1α的表达, 很可能通过抑制HIF-1α的合成或增强HIF-1α的清除系统, 如: 脯氨酸羟化酶活性等途径, 使肿瘤细胞的HIF-1α减少. (2)同样槐耳清膏也可影响VEGF的合成或清除环节而使肿瘤细胞的VEGF表达减少.
此外, 尽管一般认为, HIF-1可以通过调节其靶基因VEGF基因[15], 而影响VEGF mRNA的表达, 但HIF-1的靶基因多达200余种, 被HIF-1激活的众多靶基因之间如何相互作用, 互相调节、控制等是极为复杂和尚须解决的问题. 本研究观察到: 槐耳清膏抑制了肿瘤细胞HIF-1的表达, 同时也抑制了VEGF的表达, 且两者显著相关; 但VEGF mRNA却无显著变化的原因, 是否与同时被激活的其他靶基因之间的调节有关?以及其意义如何等尚待今后深入探讨.
血管内皮生长因子(VEGF)是重要的促血管生成因子, 缺氧诱导因子-1α(HIF-1α)是重要的氧调节转录因子, 二者与肿瘤缺氧状态下血管发生密切相关. 槐耳清膏是槐栓菌质发酵后的热水提取物, 其味苦辛, 性平无毒, 具有"治风"、"破血"、"益力"之功效, 近来发现他能抑制实体肿瘤的血管生成.
曹秀峰, 主任医师, 南京医科大学附属南京第一医院肿瘤中心.
抑制新生血管生成是当今抗肿瘤治疗的重要策略之一. 寻找并研发安全、高效的抗肿瘤新生血管药物是肿瘤防治研究领域亟待解决的关键问题.
有关研究发现槐耳清膏通过下调患者血清VEGF的表达, 降低原发性肝癌的转移复发率. 体外研究发现槐耳清膏能明显抑制VEGF诱导的人脐静脉内皮细胞(HUVEC)增殖和分化成血管能力.
目前国内外关于槐耳清膏对缺氧结肠癌细胞内VEGF和HIF-1α基因表达影响的报道并不多见. 本研究观察人结肠癌细胞SW480在缺氧环境中VEGF和HIF-1α表达的变化, 发现槐耳清膏能通过下调结肠癌细胞中VEGF和HIF-1α蛋白的表达抑制肿瘤新生血管生成.
研究槐耳清膏抑制结肠癌血管生成可能的作用靶分子, 为寻找新的抗癌治疗靶点和研发、筛选新型临床抗肠癌药提供一定的理论依据.
本研究立题新颖, 设计合理, 结果可信, 具有重要的研究价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 程 若川, 汤 礼贵, 兰 丽琴, 贾 伟. 槐耳清膏诱导人直肠癌HR8348细胞凋亡的实验研究. 中国普外基础与临床杂志. 2003;10:568-571. |
| 3. | Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 2003;3:401-410. [PubMed] [DOI] |
| 4. | Vaupel P. The role of hypoxia-induced factors in tumor progression. Oncologist. 2004;9 Suppl 5:10-17. [PubMed] [DOI] |
| 5. | Pourgholami MH, Morris DL. Inhibitors of vascular endothelial growth factor in cancer. Cardiovasc Hematol Agents Med Chem. 2008;6:343-347. [PubMed] [DOI] |
| 8. | Ryan HE, Poloni M, McNulty W, Elson D, Gassmann M, Arbeit JM, Johnson RS. Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth. Cancer Res. 2000;60:4010-4015. [PubMed] |
| 9. | Jeong JW, Bae MK, Ahn MY, Kim SH, Sohn TK, Bae MH, Yoo MA, Song EJ, Lee KJ, Kim KW. Regulation and destabilization of HIF-1alpha by ARD1-mediated acetylation. Cell. 2002;111:709-720. [PubMed] [DOI] |
| 10. | Hoenig MR, Bianchi C, Rosenzweig A, Sellke FW. Decreased vascular repair and neovascularization with ageing: mechanisms and clinical relevance with an emphasis on hypoxia-inducible factor-1. Curr Mol Med. 2008;8:754-767. [PubMed] [DOI] |
| 11. | Pugh CW, Ratcliffe PJ. Regulation of angiogenesis by hypoxia: role of the HIF system. Nat Med. 2003;9:677-684. [PubMed] [DOI] |
| 12. | 侯 伟, 覃 华, 刘 爽, 王 颖, 刘 南植, 赵 秋, 田 德安. 姜黄素对缺氧HepG2细胞中HIF-1α表达的影响及可能机制. 世界华人消化杂志. 2008;16:2354-2358. [DOI] |
| 15. | Rankin EB, Giaccia AJ. The role of hypoxia-inducible factors in tumorigenesis. Cell Death Differ. 2008;15:678-685. [PubMed] [DOI] |