修回日期: 2009-04-15
接受日期: 2009-04-20
在线出版日期: 2009-05-28
目的: 构建人STIM1基因真核表达载体, 并观察其在人肝细胞株(HL-7702)中的表达.
方法: 提取HL-7702细胞总RNA, RT-PCR扩增, 经纯化回收后将片段克隆至pGM-T载体, 酶切琼脂糖凝胶电泳分析鉴定并测序, 最后用重组质粒转染HL-7702细胞, 通过PCR-电泳和Western blot法检测STIM1基因的表达.
结果: PCR扩增的片段长度为342 bp, 测序结果以及重组质粒pGM-T-STIM1的酶切琼脂糖凝胶电泳鉴定结果均证明STIM1基因成功克隆到真核表达载体中. PCR-电泳和Western blot实验结果分别显示转染重组质粒后的HL-7702细胞在基因与蛋白水平表达STIM1均有所增强.
结论: 成功构建了人STIM1基因的真核表达载体pGM-T-STIM1, 并在人肝细胞株HL-7702中稳定表达, 为研究STIM1蛋白在人肝细胞内Ca2+浓度调控方面及其对人肝细胞分泌功能的影响奠定了良好的实验基础.
引文著录: 张振亚, 张宗明, 潘丽洁. 人STIM1基因真核表达载体的构建及其在肝细胞中的表达. 世界华人消化杂志 2009; 17(15): 1489-1492
Revised: April 15, 2009
Accepted: April 20, 2009
Published online: May 28, 2009
AIM: To construct eukaryotic expression vector of human stromal interaction molecular 1 (STIM1) gene and to observe its expression in human liver cell line (HL-7702).
METHODS: Total RNA was extracted from HL-7702 cells and the coding sequence of STIM1 gene was amplified using RT-PCR. After purification, the fragment and eukaryotic expression vector pGM-T plasmid were ligated. The recombinant plasmid was verified by agarose gel electrophoresis and sequencing. Expression of STIM1 gene and growth of transfected HL-7702 cells were evaluated by electrophoresis and Western blot, respectively.
RESULTS: The length of specific fragment amplified by PCR was 342 bp, the recombinant plasmid pGM-T-STIM1 showed two correct bands by digestion using restriction endonuclease EcoR, and sequencing results were as expected, suggesting that STIM1 gene had been cloned into pGM-T vector. Results of agarose gel electrophoresis and Western blot revealed that with the transfection, the expression level of STIM1 gene and protein were all elevated in HL-7702 cells.
CONCLUSION: The recombinant eukaryotic expression vector pGM-T-STIM1 was successfully constructed and stably expressed in HL-7702 cells. It is meaningful for the research of cytoplasm calcium concentration regulation and secretion function in human liver cells.
- Citation: Zhang ZY, Zhang ZM, Pan LJ. Construction of human STIM1 eukaryotic expression vector and its expression in HL-7702 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1489-1492
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1489.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1489
钙池操纵的Ca2+通道(store-operated Ca2+ channels, SOC)广泛存在于非兴奋性细胞和部分兴奋细胞膜上, 是胞外Ca2+内流的主要通道之一, 参与多种生理和病理生理过程, 对维持细胞内游离Ca2+浓度稳定具有重要作用, 因此受到广泛重视. 基质交感蛋白(stromal interaction molecular, STIM)是近年来研究SOC通道的一个热点, 其有两种亚型, 即STIM1和STIM2, 其中STIM1被认为与SOC通道的激活高度相关, Liou et al[1]及Roos et al[2]实验充分证明了这一点, 他们均发现了利用siRNA技术沉默掉STIM1可以阻断SOC电流; 而STIM2与SOC通道的关系目前尚不十分明确, 各种实验结果的报道也有所不同.
肝细胞作为非兴奋细胞的代表, 已经发现其质膜上存在SOC[3-4], 我们的前期研究也证实了这一点[5-6]. 为了深入研究STIM1在肝细胞SOC通道的激活过程中扮演的角色, 以及他的表达情况在肝脏病理条件下的改变, 我们构建了人STIM1重组质粒, 并成功在人肝细胞株HL-7702中表达, 现报道如下.
人正常肝细胞株HL-7702(中国科学院细胞所). TRIzol、Lipofectamine2000(美国Invitrogen公司); 蛋白酶抑制剂、萘酚AS-MX磷酸盐、快红(美国Sigma公司); RPMI 1640培养液、新生牛血清(天津灏洋生物制品公司); EcoRⅠ内切酶(大连TaKaRa公司); pGM-T克隆试剂盒、cDNA第一链合成试剂盒、PCR Master Mix试剂及质粒提取试剂盒(北京天根生化科技公司); 兔抗人STIM1抗体(北京西美杰科技有限公司); ALP标记的羊抗兔抗体(北京中杉金桥生物技术有限公司). 其他常规试剂均为进口分装或国产分析纯.
1.2.1 细胞培养: HL-7702细胞在含200 g/L新生牛血清的RPMI 1640培养液中, 于37℃、50 mL/L CO2、饱和湿度的培养箱中培养.
1.2.2 反转录-聚合酶链反应(RT-PCR): 参照文献[7]中方法, 用酚/氯仿抽提法提取细胞总RNA, 按cDNA第一链合成试剂盒操作说明进行反转录: 反应体系为总RNA 1 μg、10×RT Mix 2 μL、dNTP混合液2 μL、Oligo-dT15 2 μL、Quant Reverse Transcriptase 1 μL, RNase-free水补足至20 μL. PCR扩增引物设计为, 上游: GTTTGCCTATATCCAGAACCGTTA, 下游: TACCATGAGCTGTGAGATTCTAGC, 由上海生工生物工程服务有限公司合成. PCR反应条件为: 94℃预变性3 min, 94℃变性30 s, 60℃退火30 s, 72℃延伸60 s, 循环30次, 最后72℃延伸5 min.
1.2.3 重组质粒构建、提取与鉴定: 参照文献[8]的方法, 纯化回收目的片段并添A后, 与pGM-T载体按照5∶1的比例混合, 加入连接体系中的其他成分后, 置于PCR仪16℃反应过夜. 将连接产物转化入感受态细胞中扩增, 提取并选择纯化pGM-T-STIM1重组质粒进行测序(由上海英骏生物技术有限公司完成). 采用EcoRⅠ内切酶于37℃水浴中切开已提取的质粒, 琼脂糖凝胶电泳检测片段连接情况, 电泳过程中设立空质粒作为对照.
1.2.4 细胞转染与RT-PCR检测: 参考Lipo-fectamine2000试剂说明向HL-7702细胞转染重组质粒pGM-T-STIM1, 培养24-48 h后重新提取转染后细胞的总RNA, 并进行RT-PCR反应, 取一定量反应产物进行琼脂糖凝胶电泳, 同时设立空质粒转染组与正常细胞组对照以观察转染重组质粒对HL-7702细胞表达STIM1基因的影响.
1.2.5 Western blot检测: 用低张蛋白提取液(35 mmol/L Tris-HCl, 0.4 mmol/L EDTA, 10 mmol/L MgCl2, 1 g/L蛋白酶抑制剂, pH7.4)解离细胞, 离心弃去不溶物, 上清液中的蛋白含量用BCA微板法定量, 使用牛血清白蛋白(BSA)作为参照物. 蛋白样品参照文献[9]中的方法完成SDS-聚丙烯酰胺凝胶电泳并转移至聚偏氟乙烯(PVDF)吸附膜后, 分别与兔抗人STIM1抗体(一抗)、ALP标记的羊抗兔抗体(二抗)结合, 最后与ALP底物溶液(10 μL Tris-HCl缓冲液(pH9.5、0.1 mol/L)中加入2 mg事先用10 μL无水乙醇溶解的萘酚AS-MX磷酸盐和5 mg快红)反应至特异蛋白带清晰显现, 平板扫描摄像. 该实验同样设立转染重组质粒组、转染空质粒组与正常细胞对照组.
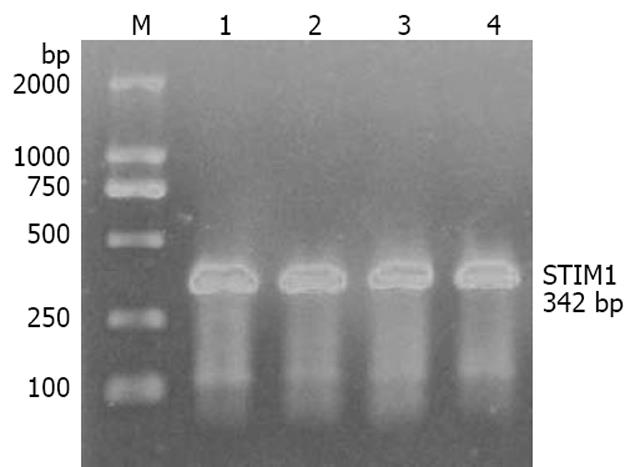
应用PCR技术扩增的产物经电泳检测, 特异性条带显示在342 bp左右, 与预期结果相符(图1).
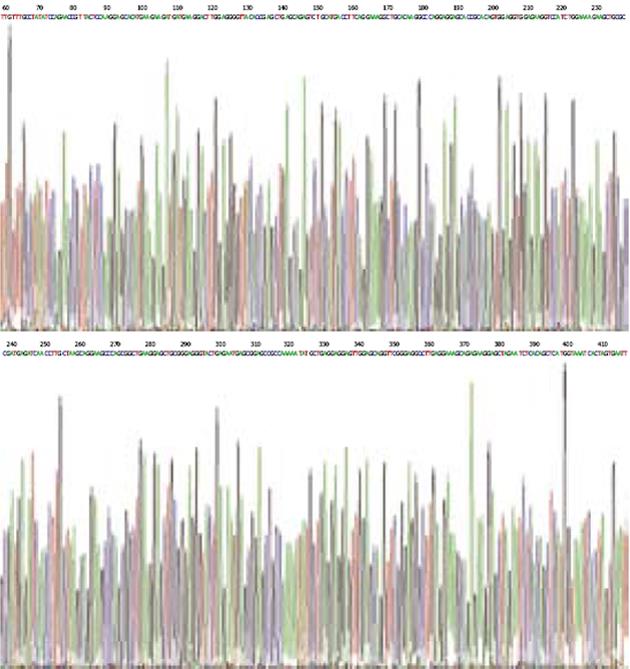
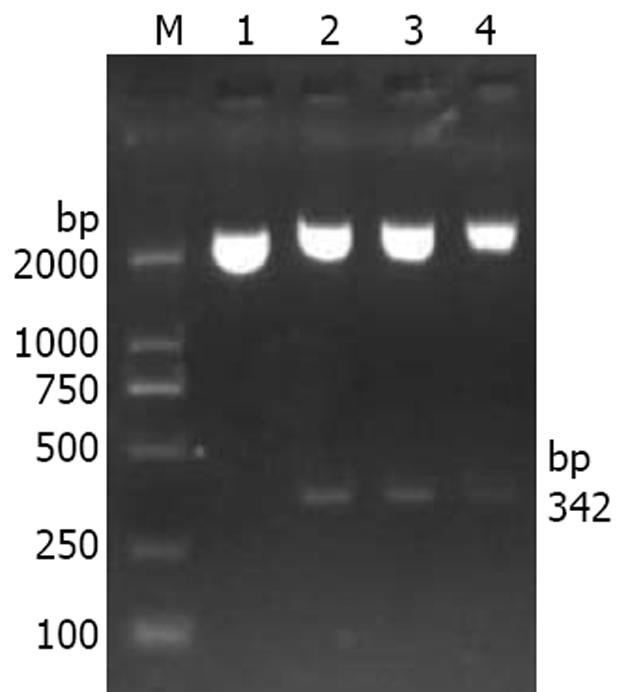
重组质粒的测序结果(图2)显示目的基因片段已经正确插入载体中, 故选用EcoRⅠ限制性内切酶对构建好的质粒进行酶切, 同时设立空质粒作为阴性对照, 结果显示重组质粒pGM-T-STIM1经酶切在342 bp处有条带, 空质粒组未见条带(图3).
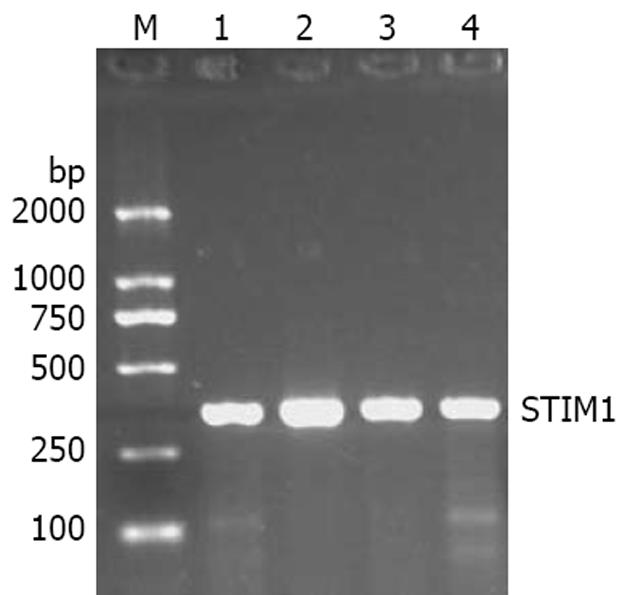
提取转染后HL-7702细胞的总RNA进行RT-PCR反应, 并取一定量反应产物进行琼脂糖凝胶电泳, 同时设立转染前细胞组作为对照. 实验结果表明, 质粒转染后的HL-7702细胞STIM1基因表达明显增强(图4), 这说明构建的重组质粒已经将STIM1基因导入HL-7702, 并有稳定表达.
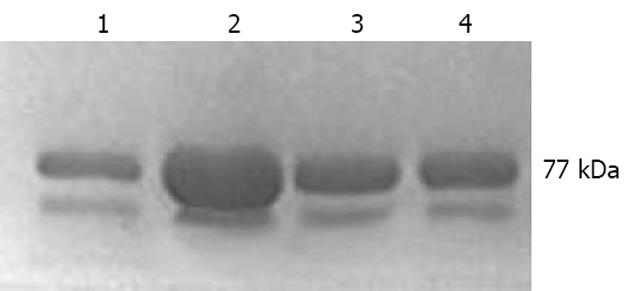
分别提取各组细胞的蛋白质, 定量并进行Western blot分析, 结果如图5所示, 转染重组质粒细胞组表达STIM1蛋白明显增强, 而转染空质粒组细胞与正常对照组相差不大, 提示重组质粒转染组细胞STIM1蛋白表达增强确由转染重组质粒引起.
肝脏在人体内具有非常重要的作用, 这与肝细胞内Ca2+浓度的维持是密不可分的; 当肝细胞发生损伤时, 胞质中的Ca2+浓度会一定程度的升高, 在这一过程中, SOC通道似乎又扮演着关键的角色[10]. 业已了解STIM1是SOC的重要组成部分, 而且他的过表达或缺失将显著影响多种细胞的SOC电流. 基于STIM1蛋白在细胞内的定位, 围绕STIM1如何影响SOC通道的问题目前存在三种假说: (1)STIM1蛋白存在于内质网膜上的和细胞膜上的STIM1形成复合体[2]; 这种假说首先需要承认细胞膜上存在STIM1, 并且他对激活SOC有十分重要的意义. (2)绝大多数或者全部STIM1蛋白在钙池耗竭之前都存在于内质网膜上, 钙池耗竭后, STIM1转移靠近并插入到细胞膜中[11]. (3)STIM1蛋白只存在于内质网膜上[1]. 钙池耗竭后, STIM1接近细胞表面却不直接插入细胞膜; STIM1蛋白的C末端与SOC通路的某些组分(或者通路本身)相互作用, 从而促进钙离子的内流. 此三种假说各有实验支持, 但却尚未见有STIM1蛋白在人类正常肝细胞中研究的报道. 因此, STIM1蛋白是否存在于人类的肝细胞中? 他在人肝细胞中又是通过何种机制来影响SOC 通道的功能? 有待进一步深入研究.
在新近的一些研究中, STIM1基因表达载体已被成功构建并应用于某些领域, 如Tamarina et al[12]通过EYFP-STIM1载体的构建与研究, 发现STIM1蛋白在胰岛β细胞中迁移对其分泌具有重要作用. Aromataris et al[13]研究发现, STIM1蛋白在大鼠肝癌细胞H4-IIE中的位置决定着其胆汁酸的分泌; 表明STIM1对于大鼠肝癌细胞的分泌活动也有着举足轻重的作用. 本研究成功构建了人STIM1基因的真核表达载体pGM-T-STIM1, 并在人肝细胞株HL-7702中稳定表达, 为研究人肝细胞中SOC通道的功能特性以及STIM1蛋白在人肝细胞内Ca2+浓度调控方面及其对人肝细胞分泌功能的影响奠定了良好的实验基础.
肝细胞内游离Ca2+作为第二信使, 在正常生理条件下, 对维持细胞分裂、增殖、运动、能量代谢、氧代谢、Ca2+依赖性蛋白激酶和磷脂酶激活等方面具有十分重要的作用. 钙池操纵的钙通道(SOC)作为肝细胞主要钙离子通道的候选者, 已经发现其存在于肝细胞质膜上, 但迄今为止, 引起SOC通道Ca2+内流的胞内信号传导机制尚不清楚.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科.
新近研究表明, 肝细胞SOC的激活与基质交感蛋白(STIM1)密切相关. 尽管STIM1激活SOC的具体机制尚不完全清楚, 但其与几种相关蛋白-Orai1, TRPC1对肝细胞SOC的影响是当前该领域的研究热点.
本文旨在通过构建质粒和脂质体转染的方法, 提高人肝细胞系HL-7702中STIM1的表达, 并利用RT-PCR和Western blot等方法进行验证.
本研究通过提高人肝细胞系HL-7702中STIM1的表达, 为进一步深入研究STIM1在激活人肝细胞SOC过程中的作用奠定基础, 并可能为以后通过抑制STIM1来实现预防或治疗某些肝脏疾病等目的提供新的方向和思路.
本实验设计合理, 方法先进, 结果可信, 图片质量较好, 对探讨Ca2+与肝细胞分泌功能的关系有重要理论指导意义.
编辑: 李军亮 电编:何基才
| 1. | Liou J, Kim ML, Heo WD, Jones JT, Myers JW, Ferrell JE Jr, Meyer T. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 2005;15:1235-1241. [PubMed] [DOI] |
| 2. | Roos J, DiGregorio PJ, Yeromin AV, Ohlsen K, Lioudyno M, Zhang S, Safrina O, Kozak JA, Wagner SL, Cahalan MD. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 2005;169:435-445. [PubMed] [DOI] |
| 3. | Gregory RB, Sykiotis D, Barritt GJ. Evidence that store-operated Ca2+ channels are more effective than intracellular messenger-activated non-selective cation channels in refilling rat hepatocyte intracellular Ca2+ stores. Cell Calcium. 2003;34:241-251. [PubMed] [DOI] |
| 4. | Rychkov G, Brereton HM, Harland ML, Barritt GJ. Plasma membrane Ca2+ release-activated Ca2+ channels with a high selectivity for Ca2+ identified by patch-clamp recording in rat liver cells. Hepatology. 2001;33:938-947. [PubMed] [DOI] |
| 7. | 徐 智, 沈 苏南, 钱 晓萍, 禹 立霞, 刘 宝瑞. 人CD40 ligand基因真核表达质粒的构建及对人肝癌细胞HepG2的促凋亡作用. 世界华人消化杂志. 2005;13:2413-2419. [DOI] |
| 8. | Fan CF, Mei XG. A simple, efficient, and economical method for recovering DNA from agarose gel. Prep. Biochem Biotechnol. 2005;35:71-78. [PubMed] [DOI] |
| 10. | 张 振亚, 张 宗明, 潘 丽洁, 税 朝祥, 王 尧尧. 人TRPC1基因真核表达载体的构建及肝细胞表达. 中华实验外科杂志 印刷中. . |
| 11. | Zhang SL, Yu Y, Roos J, Kozak JA, Deerinck TJ, Ellisman MH, Stauderman KA, Cahalan MD. STIM1 is a Ca2+ sensor that activates CRAC channels and migrates from the Ca2+ store to the plasma membrane. Nature. 2005;437:902-905. [PubMed] [DOI] |
| 12. | Tamarina NA, Kuznetsov A, Philipson LH. Reversible translocation of EYFP-tagged STIM1 is coupled to calcium influx in insulin secreting beta-cells. Cell Calcium. 2008;44:533-544. [PubMed] [DOI] |
| 13. | Aromataris EC, Castro J, Rychkov GY, Barritt GJ. Store-operated Ca(2+) channels and Stromal Interaction Molecule 1 (STIM1) are targets for the actions of bile acids on liver cells. Biochim Biophys Acta. 2008;1783:874-885. [PubMed] |