修回日期: 2009-03-20
接受日期: 2009-03-30
在线出版日期: 2009-05-18
目的: 研究核心蛋白聚糖(decorin, DCN)在原发性肝癌组织中的表达.
方法: 免疫组织化学(SP法)分别检测16例正常肝组织、20例肝硬化组织、30例肝癌及癌旁组织中DCN的表达, 利用阳性表达率及吸光度进行半定量及定量分析.
结果: DCN在肝硬化及癌旁组织中呈强阳性表达, 阳性表达率、平均吸光度与正常肝组织及肝癌组织相比, 有显著性差异(55%, 73.3% vs 0%, 10%; 0.2357±0.0396, 0.2983±0.1990 vs 0.1394±0.0072, 0.1589±0.0115, 均P<0.01).
结论: DCN可能作为一种负性调控蛋白参与肝癌及肝纤维化的发生发展.
引文著录: 上官建营, 窦科峰, 李霄, 胡小军, 张福琴, 雍召生, 遆振宇. 核心蛋白聚糖在原发性肝癌中的表达. 世界华人消化杂志 2009; 17(14): 1462-1465
Revised: March 20, 2009
Accepted: March 30, 2009
Published online: May 18, 2009
AIM: To study the expression of decorin (DCN) in primary hepatocellular carcinoma (PHC) tissues.
METHODS: Immunohistochemistry (SP) was used to detect DCN expression in 16 samples of normal hepatic tissues, 20 samples of liver cirrhosis tissues and 30 samples of PHC tissues and relative paracancerous tissues. The quantitative analysis was performed with positive expression rate and A value in this study.
RESULTS: Liver cirrhosis tissues and paracancerous tissues showed strong positive expression of DCN. Their positive expression rates and the average A values had significant difference compared with normal hepatic tissues and PHC tissues (55%, 73.3% vs 0%, 10%; 0.2357 ± 0.0396, 0.2983 ± 0.1990 vs 0.1394 ± 0.0072, 0.1589 ± 0.0115, P < 0.01).
CONCLUSION: Our results indicate that DCN may pose negative effects on the development of cirrhosis and carcinoma in hepatic tissues.
- Citation: Shangguan JY, Dou KF, Li X, Hu XJ, Zhang FQ, Yong ZS, Ti ZY. Expression of decorin in primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1462-1465
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1462.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1462
肿瘤的演变最终取决于肿瘤与微环境的相互作用, 两者的互动关系成为近年来肿瘤研究的热点与难点[1]. 核心蛋白聚糖(decorin, DCN)是细胞外基质的重要组分之一, 具有多种生物活性[2]. 目前研究发现DCN在体内外实验中均可以抑制肺、乳腺、结肠等组织来源的肿瘤细胞的生长[3-5], 但有关DCN在肝癌组织中表达的研究, 目前国内尚未见报道. 本实验以临床病例组织标本为研究对象, 检测DCN在正常肝、肝硬化、肝癌及癌旁组织中的表达, 并尝试探讨其在肝癌及肝硬化过程中可能发挥的作用.
收集中国人民解放军第四军医大学西京医院肝胆外科2007-09/2008-11手术切除的肝脏组织标本66例, 其中原发性肝癌及癌旁组织30例; 肝硬化20例; 正常肝组织16例, 来源于肝移植供肝活检组织, 于移植肝植入前取材. 其中男性42例, 占63.64%, 女性24例, 占36.36%, 男、女之比为1.75∶1, 发病年龄19-73(平均47.6)岁, 术前肝功能按Child分级, A级49例, B级17例. 肝癌患者中按照Edmondson分级标准Ⅰ级5例, Ⅱ级8例, Ⅲ级9例, Ⅳ级8例. 肿瘤直径≤5 cm的13例, 直径>5 cm的肿瘤17例. 所有病例均经病理检查确诊. 小鼠抗人DCN mAb购自美国abCAM公司, 羊抗鼠免疫组化试剂盒购自深圳晶美生物工程有限公司; 日本Olympus BX51光学显微镜、DP Controller图像采集系统及Image-Pro Plus 5.1图像分析软件.
1.2.1 操作步骤: 新鲜标本多聚甲醛固定, 常规脱水、浸蜡、包埋、切片, 片厚3-4 μm. 以PBS代替一抗作为空白对照, 以正常兔血清代替一抗作为阴性对照, 采用链霉菌抗生物素蛋白-过氧化物酶连接法(SP法)进行染色. 抗原微波热修复, 修复液为0.01 mol/L枸橼酸钠缓冲溶液(pH6.0). 一抗选用DCN单克隆抗体(美国abCAM公司, 稀释度1∶100). 具体实验步骤参照深圳晶美生物工程有限公司试剂盒说明书进行. 主要过程: 常规脱蜡至水, 30 mL/L H2O2-甲醇浸泡10 min, 以消除内源性过氧化物酶, 抗原微波热修复2-3次, 正常山羊血清封闭10 min, 加一抗4℃过夜后37℃复温45 min, 加入二抗37℃ 30 min, 二氨基联苯胺(DAB)显色, 苏木素衬染后, 脱水, 透明, 封片, 光镜下观察.
1.2.2 DCN在肝脏组织中表达的测定: 参照Fromowitz方法[6], DCN表达以纤维组织或细胞胞质内有棕黄色颗粒为阳性. 随机观察5个中倍镜下视野, 每个视野计数100个细胞, 算出各个视野中阳性细胞数的平均百分比进行计分. 0%-5%计为0分, 6%-25%计为1分, 26%-50%计为2分, 51%-75%计为3分, 大于75%计为4分; 染色强度则以阳性细胞呈现的染色特征为标准进行计分: 细胞未染色计为0分, 呈淡黄色计为1分, 棕黄色计为2分, 棕褐色计为3分; 然后根据两者相加所得的总分进行结果判定. 0-1分为阴性(-), 2-3分为弱阳性(+), 4-5分为中度阳性(++), 6-7分为强阳性(+++).
1.2.3 吸光度值测定: 利用Olympus BX51光学显微镜、DP Controller图像采集系统Image-Pro Plus 5.1图像分析软件测定各组切片吸光度(A值).
统计学处理 应用SPSS15.0软件包进行统计分析, 数据用率、mean±SD表示, 阳性表达率的比较采用χ2检验, 不同组织之间A值的比较采用SNK-q检验, 取P<0.05有统计学意义.
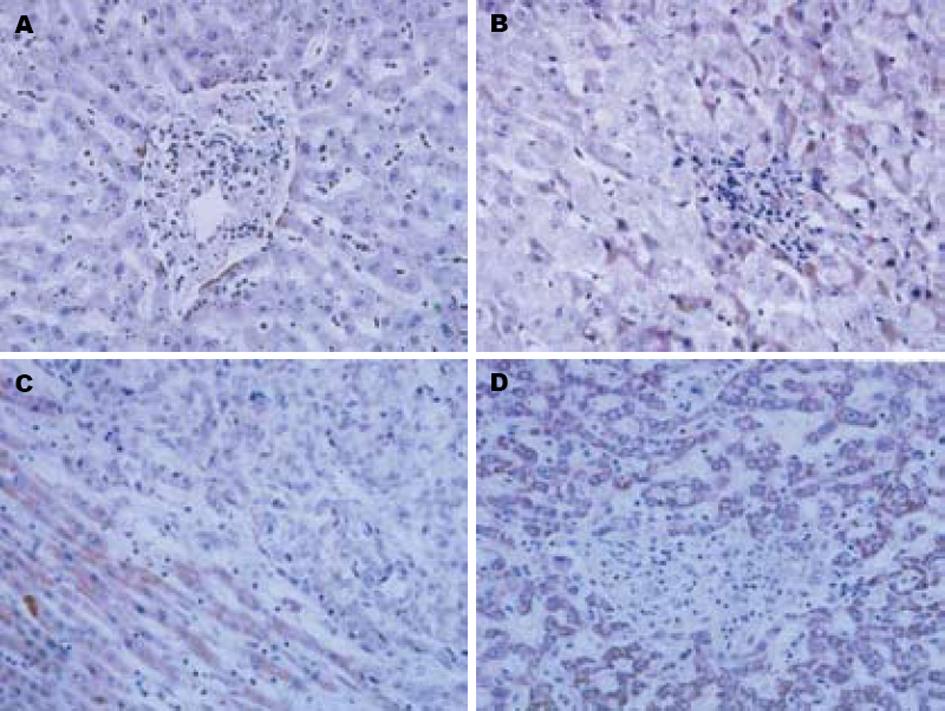
免疫组化结果显示DCN在正常肝组织中为阴性表达(图1A); 在肝硬化组织中随肝硬化程度增高而逐渐增强, 其阳性信号主要位于增生纤维组织周围肝细胞胞质中, 呈暗灰色至棕黄色颗粒(图1B); 在肝癌组织中主要位于癌巢周围的纤维组织里, 并将癌巢包裹, 呈黄色颗粒(图1C); 癌旁组织中主要位于纤维间隔及肝细胞胞质内, 呈现棕黄色粗大颗粒状物质, 均质分布(图1D). 肝硬化和癌旁组织的阳性表达率与肝癌及正常肝有统计学差异(P<0.05, 表1).
| 组织类型 | n | 分级表达 | 总阳性 | |||
| (-) | (+) | (++) | (+++) | |||
| 正常 | 16 | 16(100) | 0(0) | 0(0) | 0(0) | 0(0) |
| 肝硬化 | 20 | 9(45) | 4(20) | 6(30) | 1(5) | 11(55) |
| 肝癌 | 30 | 27(90) | 2(6.7) | 1(3.3) | 0(0) | 3(10) |
| 癌旁组织 | 30 | 8(26.7) | 7(23.3) | 6(20) | 9(30) | 22(73.3) |
肝硬化及癌旁组织较正常肝及肝癌组织平均A值明显升高, 差异具有统计学意义(0.2357±0.0396, 0.2983±0.1990 vs 0.1394±0.0072, 0.1589±0.0115, 均P<0.01).
DCN主要存在于结缔组织中, 是一种与胶原纤维相关的蛋白多糖, 是蛋白多糖家族中富含亮氨酸的一个小分子组分, 具有多种生物活性, 可特异性结合并下调表皮生长因子(epidermal growth factor receptor, EGFR)[7-8], 从而抑制多种肿瘤细胞增殖[9-11]; 并可调节胶原纤维生成[12], 阻断TGF-β通路[13], 从而达到抗纤维化作用.
众多实验证明DCN具有抑制肿瘤生长及抗纤维化作用. 肿瘤内注射DCN腺病毒载体不但可抑制裸鼠体内A549肿瘤细胞的生长, 而且可以抑制远离部位肿瘤的生长. TGF-β是当前较公认的致纤维化因子, 其突出作用是促进胶原与ECM形成, 同时抑制胶原酶的降解. TGF-β又可以经诱导新生血管、降低宿主免疫、介导肿瘤细胞耐药等多种途径有利于肿瘤细胞的生长、生存. TGF-β通过抑制免疫细胞生长、诱导免疫细胞凋亡及减少免疫细胞因子释放, 造成肿瘤患者免疫功能降低, 这或许是肿瘤细胞逃避宿主免疫监视得以生存的重要原因. DCN可与TGF-β结合, 负性调控TGF-β的生物活性, 从而表现出抗肿瘤及纤维化双重功能.
DCN在人肝癌细胞、正常肝细胞及星形细胞作用体外研究发现, 其对各种细胞均有不同程度抑制作用. 赵素莲 et al[14]研究发现DCN诱导肝癌细胞株凋亡呈剂量效应, 随DCN浓度升高, 凋亡发生的速率加快, 凋亡细胞百分率明显升高, DCN诱导细胞凋亡主要发生在G1期和S期, 同时DCN可通过改变细胞周期, 使G0期细胞增多, G1期阻滞, G0/G1期的肿瘤细胞比率升高, 延缓肿瘤细胞由G1期向S期的过渡, 使S期和G2期细胞明显降低, 从而抑制细胞增殖. 王桂琴 et al[15]研究发现DCN对正常肝细胞、星形细胞的作用依剂量而异, 小剂量有刺激细胞增殖的作用, 而大剂量则有抑制细胞增殖的作用. 从而证明DCN其有抑制肿瘤生长及抗纤维化作用.
本实验通过免疫组织化学的方法研究DCN在不同肝组织中的表达情况, 并通过半定量和定量方法进行分析, 了解DCN表达与不同病理的关系. 实验发现, DCN在纤维化肝脏及癌旁组织中的肝细胞胞质及纤维组织中呈强表达, 在癌巢周围纤维组织中亦有表达, 并将癌巢包绕. 操海萍 et al[16]研究乳腺癌时的发现DCN在乳腺癌癌细胞中表达阳性率高于相对正常乳腺腺细胞, 紧邻乳腺癌的间质中DCN表达较相对正常乳腺腺体周围间质高, 这与我们在肝癌及癌旁组织中的发现基本一致.
本研究结果表明, DCN在肝癌组织中呈低表达, 而在癌旁组织中呈高表达, 同时在正常肝中低表达, 在肝硬化肝脏中呈高表达, 说明其参与了肿瘤发生及肝纤维化过程. 根据这些研究结果我们推测其可能是机体对肝纤维化、肿瘤发生、发展的一种防御反应, 是机体防御肝纤维化、肿瘤侵袭、转移的一道屏障. 有关更深入的作用及其机制有待于进一步研究, 以便揭示DCN与肝脏肿瘤发生发展及肝纤维化关系, 从而为肝纤维化治疗及肿瘤防治提供理论基础.
原发性肝癌是在各种病因导致的慢性肝纤维化基础上逐渐发生的, 阻断其发生的关键是阻断与逆转肝纤维化, 抗肿瘤发生、发展及术后复发. 目前尚没有理想的药物能够防止肿瘤发生、发展及复发. DCN的发现为防治肿瘤开辟了新的途径. Masuda et al[17]发现小鼠静脉注射重组DCN后, 肝脏能完全摄取利用DCN, 血循环中DCN很快被完全清除. 该研究为DCN应用于临床治疗提供了依据. DCN是机体本身所有的细胞外基质的成分, 从组织中提取天然的DC有广泛的来源和技术上的可行性, 基因克隆技术也已成功获得DCN, 使得DCN在肝纤维化治疗及原发性肝癌的防治中具有良好的应用前景.
核心蛋白聚糖是在细胞外基质中存在的一些小分子蛋白聚糖, 是细胞外基质的重要组成成分, 具有多种生物活性. 目前研究发现DCN在体内外实验中均可以抑制多种组织来源的肿瘤细胞的生长, 与肿瘤的发生、发展密切相关.
于聪慧, 教授, 中国人民解放军北京军区总医院肝胆外科
许多研究结果表明DCN是一种抗增殖因子, 极可能是一种肿瘤抑制物, 这提示DCN有可能成为新的抗肿瘤药物. 但有关DCN在肝癌组织中的表达及作用国内尚未见到相关报道.
国内外有报道在结肠癌、乳腺癌、胰腺癌及癌旁组织中DCN的表达不同, 从而推测其为一种负性调控蛋白, 为人体抗肿瘤的第一道防线.
本文首次采用免疫组织化学SP法研究DCN在正常肝、肝硬化、肝癌及癌旁组织中的表达, 并用半定量及定量方法进行分析, 探讨DCN与不同病理条件下肝组织中的表达及作用.
DCN是机体本身所有的细胞外基质的成分, 从组织中提取天然的DCN有广泛的来源和技术上的可行性, 基因克隆技术也已成功获得DCN, 使得DCN在肝纤维化治疗及原发性肝癌的防治中具有良好的应用前景.
本研究设计可靠, 统计学方法恰当, 论证充分, 结果可靠, 学术价值很好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003;3:453-458. [PubMed] [DOI] |
| 2. | Dodge GR, Diaz A, Sanz-Rodriguez C, Reginato AM, Jimenez SA. Effects of interferon-gamma and tumor necrosis factor alpha on the expression of the genes encoding aggrecan, biglycan, and decorin core proteins in cultured human chondrocytes. Arthritis Rheum. 1998;41:274-283. [PubMed] [DOI] |
| 3. | Troup S, Njue C, Kliewer EV, Parisien M, Roskelley C, Chakravarti S, Roughley PJ, Murphy LC, Watson PH. Reduced expression of the small leucine-rich proteoglycans, lumican, and decorin is associated with poor outcome in node-negative invasive breast cancer. Clin Cancer Res. 2003;9:207-214. [PubMed] |
| 4. | Berto AG, Sampaio LO, Franco CR, Cesar RM Jr, Michelacci YM. A comparative analysis of structure and spatial distribution of decorin in human leiomyoma and normal myometrium. Biochim Biophys Acta. 2003;1619:98-112. [PubMed] |
| 5. | Banerjee AG, Bhattacharyya I, Lydiatt WM, Vishwanatha JK. Aberrant expression and localization of decorin in human oral dysplasia and squamous cell carcinoma. Cancer Res. 2003;63:7769-7776. [PubMed] |
| 6. | Nash MA, Deavers MT, Freedman RS. The expression of decorin in human ovarian tumors. Clin Cancer Res. 2002;8:1754-1760. [PubMed] |
| 7. | Santra M, Reed CC, Iozzo RV. Decorin binds to a narrow region of the epidermal growth factor (EGF) receptor, partially overlapping but distinct from the EGF-binding epitope. J Biol Chem. 2002;277:35671-35681. [PubMed] [DOI] |
| 8. | Zhu JX, Goldoni S, Bix G, Owens RT, McQuillan DJ, Reed CC, Iozzo RV. Decorin evokes protracted internalization and degradation of the epidermal growth factor receptor via caveolar endocytosis. J Biol Chem. 2005;280:32468-32479. [PubMed] [DOI] |
| 9. | Schaefer L, Iozzo RV. Biological functions of the small leucine-rich proteoglycans: from genetics to signal transduction. J Biol Chem. 2008;283:21305-21309. [PubMed] [DOI] |
| 10. | Tralhão JG, Schaefer L, Micegova M, Evaristo C, Schönherr E, Kayal S, Veiga-Fernandes H, Danel C, Iozzo RV, Kresse H. In vivo selective and distant killing of cancer cells using adenovirus-mediated decorin gene transfer. FASEB J. 2003;17:464-466. [PubMed] |
| 11. | Biglari A, Bataille D, Naumann U, Weller M, Zirger J, Castro MG, Lowenstein PR. Effects of ectopic decorin in modulating intracranial glioma progression in vivo, in a rat syngeneic model. Cancer Gene Ther. 2004;11:721-732. [PubMed] [DOI] |
| 12. | Reed CC, Iozzo RV. The role of decorin in collagen fibrillogenesis and skin homeostasis. Glycoconj J. 2002;19:249-255. [PubMed] |
| 13. | Ferdous Z, Wei VM, Iozzo R, Höök M, Grande-Allen KJ. Decorin-transforming growth factor- interaction regulates matrix organization and mechanical characteristics of three-dimensional collagen matrices. J Biol Chem. 2007;282:35887-35898. [PubMed] [DOI] |
| 15. | 王 桂琴, 郭 彩虹, 孔 宪涛, 仲 人前, 李 莉, 张 玲珍, 刘 涛, 王 红蓓. 核心蛋白聚糖对肝细胞和肝星形细胞体外增殖的影响. 第二军医大学学报. 2000;21:721-723. |
| 17. | Masuda H, Takakura Y, Hashida M. Pharmacokinetics and disposition characteristics of recombinant decorin after intravenous injection into mice. Biochim Biophys Acta. 1999;1426:420-428. [PubMed] |