修回日期: 2009-03-21
接受日期: 2009-03-23
在线出版日期: 2009-05-18
目的: 观察酸刺激模式下经腹腔卵清蛋白(OVA)致敏大鼠岛叶中基因谱的改变.
方法: SD大鼠20只分为3组: A组于实验前1 d腹腔注射OVA与氢氧化铝混合液[OVA 100 mg, Al(OH)3 200 mg]1.5 mL致敏; B组于实验前1 d腹腔注射生理盐水1.5 mL作假手术对照; C组不予处理作空白对照. 实验第14天, 对A、B、C组动物分别进行食管酸灌注, 使用0.1 mol/L盐酸滴注, 滴注液保持37℃, 速度10 mL/h, 共50 min. 通过脑定位仪定位岛叶并取材保存, 对标本进行RNA抽提和纯化后, 采用基因芯片进行寡核苷酸芯片杂交, 并对芯片差异基因进行数据分析.
结果: 在食管滴酸灌注致敏SD大鼠后, 31 099个待测基因中, 3组间显著差异表达基因389条(1.25%), 其中已知功能基因158条, 未知功能基因231条, 有显著性功能的基因有21条(4.88%). 这些基因主要涉及到初级代谢产物、转移酶活性、ATP结合物、阳离子结合物, 细胞定位, 阳离子转运等. 下调的基因中包括了调控与内脏感觉相关的5-HT1B受体基因.
结论: 岛叶皮层中枢可能存在有通过中枢下行抑制的减弱致内脏高敏感的中枢机制, HTR1B基因的下调可能在调控食管内脏感觉中发挥着重要的作用.
引文著录: 许树长, 王琛, 郜恒骏, 孔炫, 王志勇, 姚莉雯, 朱立人. 食管滴酸刺激诱导内脏致敏大鼠岛叶基因表达谱的改变. 世界华人消化杂志 2009; 17(14): 1437-1442
Revised: March 21, 2009
Accepted: March 23, 2009
Published online: May 18, 2009
AIM: To investigate the changes of gene expression profile in the insular lobe of enterocoelia OVA sensitized rat after esophageal acid perfusion using gene chips.
METHODS: Twenty male Sprague-Dawley (SD) rats were randomly divided into 3 groups. The rats in group A were sensitized by abdominal injection of 1.5 mL mixed liquor [OVA 100 mg, Al(OH)3 200 mg] in the beginning of the experiment. The rats in group B received abdominal injection of 1.5 mL normal sodium in the beginning of the experiment as sham operation group. The rats in group C were raised without any special interposal as control group. On the 14th day of the experiment, all rats in 3 groups received esophageal acid perfusion with 0.1 mol/L HCl, the drops was kept at 37℃ and 10 mL/h, the total duration lasted 50 min. According to the brain position indicator, the insular lobe was located and dissected then preserved in liquid nitrogen as samples. After RNA extraction and purification, the samples underwent oligonucleotide Array hybridization using gene clips and analyzed in differentially expressed genes.
RESULTS: Among the total 31 099 genes extracted from sensitized rats, there were 389 genes differentially expressed in 3 groups, involving 158 genes with definite functions and 231 genes with undefined functions. There were 21 remarkable function genes (9 up-regulated and 11 down-regulated). The gene functions referred to primary metabolite, transferase activity, ATP conjugate, positive ion conjugate, cellular positioning, and positive ionic transportation. The genes in down-regulated expression involved 5-HT1B receptor gene which was related to visceral sensation.
CONCLUSION: There should be a certain descending mechanism of visceral hypersensitivity inhibition in insular lobe cortex, and the down-regulated expression of HTR1B genes seems to play an important role in the visceral sensation.
- Citation: Xu SC, Wang C, Gao HJ, Kong X, Wang ZY, Yao LW, Zhu LR. Gene expression profile changes in the insular lobe of visceral sensitive rats following esophageal acid perfusion. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1437-1442
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1437.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1437
脑岛是初级内脏感觉皮层, 也是接受痛觉和温度觉的初级皮层区域. 当人类受到内脏伤害性刺激时, 脑岛可被活化. 作为重要的内脏感觉中枢的岛叶, 有其重要的结构和功能, 在食管接受酸刺激后出现的岛叶的改变已在相关的实验及临床研究中得到证实, 但其中可能存在的发生机制及相应的分子生物学基础尚未完全阐明, 其中所涉及的可以引起感觉异常的神经递质及其作用, 也尚无明确结论. 尤其在内脏致敏基础上食管滴酸刺激后岛叶中出现的基因谱的改变尚未见相关报道. 本研究应用基因芯片技术观察酸刺激模式下致敏大鼠岛叶中基因谱的改变, 试图发现新的有意义的与感觉相关的分子生物学基础, 并为深入探讨岛叶中变化的基因谱及其功能物质在食管感觉中的作用, 开展食管内脏感觉相关性疾病的基础与临床研究奠定一定的基础.
成年♂Sprague-Dawley大鼠20只, 体质量0.2-0.3 kg, 在同济大学附属同济医院动物实验中心适应性饲养1 wk后开始实验. 卵清蛋白(OVA)及焦碳酸二乙酯(DEPC)购自Sigma公司, RNeasy Mini Kit等试剂盒购自德国Qiagen公司, 基因芯片检测应用Gene array Scanner3000 7G, Affymetrix Fluidics Station 450等设备.
1.2.1 分组: 将♂SD大鼠20只随机分为3组: A组(实验组, n = 8): 在实验前1 d以OVA 100 mg, 辅以氢氧化铝佐剂200 mg的混合液1.5 mL行腹腔注射致敏; B组(假手术组, n = 6): 在实验前1 d以腹腔注射0.154 mol/L氯化钠溶液1.5 mL; C组(对照组, n = 6): 正常饲养, 不予以任何处理.
1.2.2 食管酸灌注: 实验第14天, 对A、B、C三组动物分别进行食管酸灌注. 动物禁食18-24 h, 自由饮水, 动物称质量后使用25 g/L戊巴比妥钠(1 mL/kg)腹腔注射麻醉. 将麻醉动物平卧位固定, 头部抬高20-30度, 于剑突下沿腹正中线作3 cm左右切口, 切开腹直肌及腹膜进入腹腔, 拨开肝脏暴露胃后, 于胃泡处沿与大弯侧纵轴垂直方向作一0.5 cm的切口切开胃壁, 将一连接负压引流器的引流管经切口放置在贲门处以收集从食管滴注的液体. 将一前端球囊剪断的PTCA管经口置放于食管内, 导管开口位于食管和胃交界处上2-3 cm, 固定导管, 另一端与持续灌注泵相连. 使用0.1 mol/L盐酸滴注, 滴注液保持37℃, 速度10 mL/h, 共50 min[1].
1.2.3 脑定位仪定位及标本取材: 根据大鼠脑立体定位图谱[2], 确定岛叶的精确定位: 以对耳线为0点, 向前12.2 mm, 正中线向右侧旁开4 mm, 深5 mm. 将安装好的动物脑定位仪放于平坦稳固的操作台上, 校准仪器后将鼠头固定, 不会有任何晃动即为妥当. 将固定好的大鼠作颅顶部正中切口, 分离开皮下组织, 暴露颅骨并剪去骨膜. 利用颅骨钻在标记处钻孔, 钻好孔后使用微量进样器向岛叶注射NBT 5-10 μL, 予以标记. 将标记好的大鼠处死后, 完整取出脑组织, 沿矢状裂将脑组织从中线切开, 根据蓝色标记分离岛叶组织, 将一半岛叶组织放入2 mL冻存管内并迅速投入液氮中, 另一半用40 g/L多聚甲醛固定. 整个取材过程于10 min内完成.
1.2.4 基因芯片的检测: 进行组织总RNA的提取, 纯化RNA; 以RNA为模板, 合成单链及双链cDNA, 纯化双链cDNA; 再以双链cDNA为模板, 体外转录合成生物素标记的cRNA; 片断化cRNA后进行基因芯片杂交、洗脱、染色和扫描.
统计学处理 应用GCOS数据分析软件进行芯片数据分析, GCOS软件通过一系列严谨的比较计算两张芯片上同一探针的信号值得到一个显著性差异P值, 同样根据统计学意义定义一个判定区间, 改变P在0-0.002, 认为基因表达为上调, 在0.998-0.999表达下调, 0.003-0.997该基因的表达量在所比较的两次芯片实验结果中没有变化, 从而挑选出差异基因, 进一步筛选实验组与正常组的显著性差异基因, 并分析差异基因群中显著性的Gene Ontology类和Pathway类(显著性功能中的差异基因将成为更有针对性的验证目标), 并根据以上确定出若干基因, 通过这些基因在芯片上的标准化后信号值, 利用人工智能的计算方法, 计算出实验状态下客观的基因表达的调控网络. 其具体分析方法包括Dif分析、GO-Analysis分析及Dif-Path分析等.
本实验选择的芯片Rat genome 230 2.0 Array包含31 099个大鼠基因, 本实验三组间显著差异表达基因389条, 占全部基因的1.25%, 其中已知功能基因158条, 未知功能基因231条, 有显著性功能的基因有21条(上调基因9条, 下调基因12条), 占三组间差异基因的4.88%, 这些基因主要涉及到初级代谢产物、转移酶活性、ATP结合物、阳离子结合物, 细胞定位, 阳离子转运等.
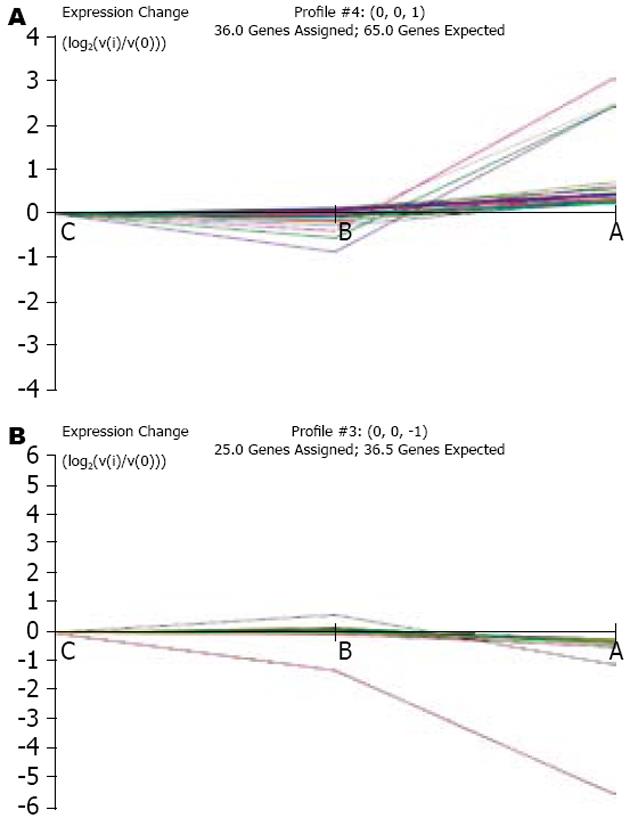
2.2.1 总体趋势分析及相关趋势选择: 通过筛选得到的差异基因, 根据C组-B组-A组的逻辑关系, 对差异基因进行表达趋势显著性分析, 找出主流表达趋势(与实验样本变化显著相关的基因). 在各种趋势中, 趋势1和趋势2(图1)为主流趋势(B组和C组程度一致, 均与A组有显著性差别). 趋势1说明通过全基因表达对三组进行分类时, B组和C组的效果一致, 均与A组的差异明显, A组基因表达水平出现明显上调. 趋势2的基因表达趋势显示B、C组的基因表达水平相似, 而A组的基因表达水平出现明显下调.
2.2.2 趋势1基因群的分子机制分析: 研究表明, 趋势1中A组较B、C表达水平出现明显上调的基因包括ABCA1、CASP8AP2_PREDICTED、CHST11_PREDICTED、CLPS、EPHB1、LARGE_PREDICTED、NKX2-2_PREDICT ED、PPM1F、RGD1565449_PREDICTED等9条, 其涉及初级代谢产物、转移酶活性、ATP结合物、大分子代谢过程、磷酸腺苷核苷酸结合物、蛋白代谢过程等9类功能. 基因功能分布表中P-value代表该基因功能(按照Gene Ontology分类标准)在趋势4中的重要程度, P值越低代表该功能在趋势中越重要, P值小于0.1的基因功能为显著性基因功能. 基因富集度(gene enriched)是指基因在基因功能分类中的富集程度, 该值越高的GO分类说明差异基因占该分类的比重越大, 也说明该GO分类参与表达差异的贡献越高.
2.2.3 趋势2基因群的分子机制分析: 研究表明, 趋势2中A组较B、C表达水平出现明显下调的基因包括ARR3、EDN1、FREM2_PRE DICTED、HTR1B、KDELR3_PREDICTED、LOC316457、NR1H4、PLA2G5、VPS26、ZFP335、ZW10、LOC287961等12条, 其涉及阳离子结合物, 细胞定位, 阳离子转运、细胞过程、细胞间交流等8类功能.
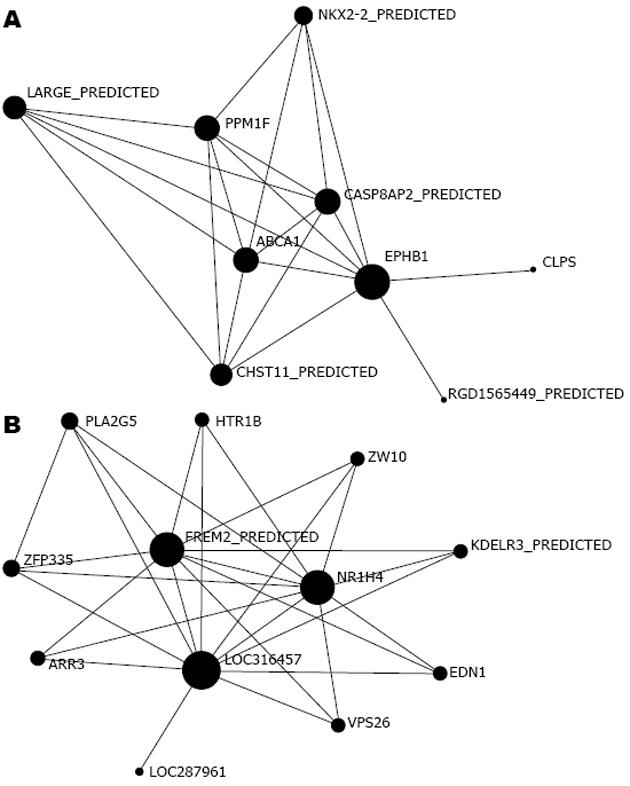
2.2.4 基因间相互作用网络分析: 对趋势1和趋势2的关键基因进行相互作用网络分析, 根据基因表达的相似性, 分析基因产物可能的相互作用关系. 图中圆圈代表基因, 直线代表作用关系. 圆圈大小为某基因产物与其他基因产物相互作用的能力, 该能力用度(degree)量化, degree = 11代表与该基因有相互作用关系的基因有11个. 对每个基因的度由高到低进行排列, 网络中心点就是基因作用网络中degree最高的基因. 最高值为网络的最中心基因, 该基因对网络总体的结构以及对其他基因间关系影响最大(图2). 通过分析基因间相互作用网络, 得出了在影响趋势1(上调)和趋势2(下调)中具有最重要的调控能力的基因(表1).
| 基因简称 | 度 | 基因名称 |
| 上调 | ||
| EPHB1 | 8 | Eph receptor B1 |
| ABCA1 | 6 | ATP-binding cassette, sub-family A (ABC1), member 1 |
| CASP8AP2_PREDICTED | 6 | Caspase 8 associated protein 2 (predicted) |
| PPM1F | 6 | Protein phosphatase 1F (PP2C domain containing) |
| 下调 | ||
| LOC316457 | 11 | Similar to phosphatidylinositol-3-phosphate/phosphatidylinositol 5-kinase, type III isoform 2 |
| NR1H4 | 10 | Nuclear receptor subfamily 1, group H, member 4 |
| FREM2_PREDICTED | 10 | Fras1 related extracellular matrix protein 2 (predicted) |
基因芯片又称DNA芯片, 属于生物芯片的一种, 其工作原理是: 经过标记的待测样本DNA通过与芯片上特定位置的探针杂交, 可根据碱基互补配对的原则确定靶DNA序列[3], 经激光共聚焦显微镜扫描, 以计算机系统对荧光信号进行比较和检测, 并迅速得出所需的信息. 基因芯片技术比常规方法效率高几十到几千倍, 可在一次实验中间平行分析成千上万个基因[4], 是一种进行DNA序列分析及基因表达信息分析的强有力工具[5]. 该技术近年来广泛应用于医学研究领域, 在疾病研究、临床疾病诊断、基因测序、药物筛选等方面得到了应用, 此技术也可作为筛选可能存在的分子生物学基础的重要手段. 本研究采用基因芯片技术, 通过制备内脏高敏感大鼠模型, 给予食管酸灌注后观察大鼠岛叶中基因表达谱的改变, 试图说明OVA致敏大鼠的可能中枢机制, 并为进一步的相关研究打下一定的基础.
本研究的结果提示, 在OVA致敏大鼠应用食管滴酸刺激后, 岛叶中出现了基因的差异表达, 大鼠基因多达31 099个, 其中三组间显著差异表达基因389条, 占全部基因的1.25%, 从差异基因的分析中发现, 其中已知功能基因158条, 未知功能基因231条, 有显著性功能的基因有21条(有上调显著性功能的基因9条, 有下调显著性功能的基因12条), 占三组间差异基因的4.88%. 从研究结果提示, 这些基因参与了初级代谢产物、转移酶活性、ATP结合物、大分子代谢过程、磷酸腺苷核苷酸结合物、蛋白代谢过程或阳离子结合物、细胞定位、阳离子转运、细胞过程、细胞间交流等分子生物学过程, 不同的功能过程有若干基因参与, 同一基因也参与到不同的功能过程中, 这也为内脏感觉中枢机制的研究带来了困难, 这些基因确切作用的机制及环节还有待于进一步研究明确.
而在21条上调及下调的基因中, 我们注意到了HTR1B基因, 功能上作为5-羟色胺G结合蛋白受体, 参与了记忆及学习等功能过程, 尽管其在下调的基因相互作用的网络中度只是3, 但均是与关键基因有关, 提示在本实验中HTR1B基因的作用须引起关注. 有关HTR1B基因的研究目前报道较少, 与其相关的疾病方面的研究多集中在精神神经领域[6-8], 有研究表明5-HT1B受体不仅与抑郁症的发病有关[9], 还与可能参与抗抑郁药的作用机制[10]; 另有研究表明5-HT1B受体的表达缺失会导致年龄相关的运动功能障碍、脑细胞早衰及寿命缩短[6]; 此外, HTR1B基因的基因多态性与注意缺陷多动障碍的发生有密切关系[11-13], 但未见与食管感觉相关的报道.
诸多研究表明, 5-HT与内脏感觉有关, 提示5-HT可能在内脏感觉中发挥着重要的作用[6]. Yamada et al[14]发现孤束核内的5-HT参与内脏感觉传入信息的调控过程, 孤束核内的5-HT能神经元成分可能通过突触后、突触前机制调控迷走神经信号传出. 有研究表明中脑导水管周围灰质和中缝背核均有向臂旁核投射的5-HT能神经元. 这些5-HT能神经元的投射纤维通过作用于臂旁核内的局部环路神经元或投射神经元, 可能参与躯体或内脏伤害性信息通过臂旁核向上位脑结构传递的调节. 疼痛信号从内脏传输到特定的脊髓背角层, 通过激活特定的二级投射神经元激活脑干及丘脑特定的区域, 引起疼痛的感觉和知觉及紧接着的高级中枢活动. 研究发现, 中枢的5-HT不仅能调节体温, 还能影响睡眠、记忆、摄食、镇痛、精神等活动, 其在外周和中枢的功能可以截然相反: 就疼痛而言, 5-HT在外周有致痛作用, 在中枢则抑制疼痛性神经传递而起镇痛作用. 中枢的5-HT能神经元分布较为广泛, 但主要集中在脑干的中缝核团, 从中缝核团至脊髓后角的5-HT能神经通路是下行性疼痛抑制系统的组成部分, 当激动5-HT能的下行镇痛系统时, 会促使5-HT释放到脊髓背角, 抑制后根初级传入纤维对伤害性刺激的传入. 有研究表明, 5-HT是下行抑制系统的主要神经活性物质, 参与中枢内源性下行抑制系统的镇痛活动, 来自脑干中缝核团的5-HT样阳性终末密集地分布于脊髓背角浅层[15], 释放的5-HT作用于γ-氨基丁酸(GABA)受体和甘氨酸(Gly)受体共存的神经元, 这些共存神经元释放的GABA和(或)Gly作用于初级传入纤维的终末, 通过突触后机制抑制他们的电活动, 从而间接达到抑制外周伤害性信息向中枢神经系统内传递的效应[16-17]. 电生理的研究也表明, 电刺激中缝大核能抑制脊髓背角细胞类纤维传入引起的放电. 这些研究从不同的角度说明, 中枢中存在有下行疼痛抑制的核团, 并可通过5-HT发挥作用[18]. 但在以往的研究中对内脏皮质的岛叶中5-HT的情况尚不明确. 本研究使用成熟的内脏高敏感大鼠模型, 并在此基础上给予酸灌注, 大鼠的岛叶中可出现差异性的基因表达, 其中下调的基因中出现了与5-HT代谢相关的基因-HTR1B, 推测OVA致敏大鼠在食管酸灌注后岛叶存在有与食管感觉相关的分子生物学基础, HTR1B的下调影响了5-HT的传递及作用, 使得下行疼痛抑制系统弱化, 食管内脏感觉增强, 表现为高敏感, 这也许是引起食管内脏感觉改变的岛叶的中枢机制之一.
当然, 本研究只是一个初步的探讨, 从实验设计上重点只观察了OVA致敏对大鼠食管感觉中枢改变的可能机制, 也只观察了酸灌注后一个时间点的基因改变, 因为不同的刺激及不同的时间点引起的基因的改变可能有不同, 从上调、下调及差异基因相互作用的网络分析也不难理解食管内脏感觉的中枢作用涉及到多环节、多途径等复杂的过程, 也许在上调或下调的基因中存在有与食管感觉关系更为重要的基因及相关的分子生物学基础. 我们期望能在本研究的基础上开展更进一步的实验研究, 进一步探讨食管内脏高敏感的中枢机制, 尤其是岛叶的可能作用.
内脏致敏基础上食管滴酸刺激后岛叶中出现的基因谱的改变尚未见相关报道. 本研究应用基因芯片技术观察酸刺激模式下致敏大鼠岛叶中基因谱的改变, 试图发现新的有意义的与感觉相关的分子生物学基础, 并为深入探讨岛叶中变化的基因谱及其功能物质在食管感觉中的作用, 开展食管内脏感觉相关性疾病的基础与临床研究奠定一定的基础.
葛海燕, 教授, 同济大学附属第十人民医院普通外科; 李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
食管内脏感觉的中枢机制较为复杂, 迄今尚无明确认识, 故对其中枢机制的研究已成为该领域的热点. 脑岛作为内脏感觉的中枢之一, 其在食管酸刺激后出现改变已在相关研究中证实, 但其具体发生机制分子生物学基础尚未完全阐明.
本文初步探讨了食管滴酸刺激诱导内脏致敏大鼠岛叶基因谱的改变, 发现了可能参与食管内脏感觉中枢机制的重要基因HTR1B.
HTR1B基因可能在食管内脏感觉中枢机制中发挥重要作用, 为食管内脏感觉相关性疾病的基础和临床研究奠定了一定的基础.
本文运用基因芯片技术探讨食管滴酸刺激诱导内脏致敏大鼠岛叶基因表达谱改变, 设计合理, 方法学先进, 结果可信, 讨论较客观, 有重要理论和临床指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | 杨 敏, 李 兆申, 房 殿春, 徐 晓蓉, 许 国铭, 邹 多武, 孙 振兴, 屠 振兴. 食管酸灌注对内脏高敏感模型大鼠中枢神经系统Fos表达的影响. 中华消化杂志. 2006;26:448-452. |
| 2. | 诸葛 启钏. 大鼠脑立体定位图谱. 第3版. 北京: 人民卫生出版社 2005; 73. |
| 3. | Bryant PA, Venter D, Robins-Browne R, Curtis N. Chips with everything: DNA microarrays in infectious diseases. Lancet Infect Dis. 2004;4:100-111. [PubMed] [DOI] |
| 4. | Chang JC, Hilsenbeck SG, Fuqua SA. Genomic approaches in the management and treatment of breast cancer. Br J Cancer. 2005;92:618-624. [PubMed] [DOI] |
| 5. | Hanai T, Hamada H, Okamoto M. Application of bioinformatics for DNA microarray data to bioscience, bioengineering and medical fields. J Biosci Bioeng. 2006;101:377-384. [PubMed] [DOI] |
| 6. | Sibille E, Su J, Leman S, Le Guisquet AM, Ibarguen-Vargas Y, Joeyen-Waldorf J, Glorioso C, Tseng GC, Pezzone M, Hen R. Lack of serotosnin1B receptor expression leads to age-related motor dysfunction, early onset of brain molecular aging and reduced longevity. Mol Psychiatry. 2007;12:1042-1056, 975. [PubMed] |
| 7. | Faraone SV, Perlis RH, Doyle AE, Smoller JW, Goralnick JJ, Holmgren MA, Sklar P. Molecular genetics of attention-deficit/hyperactivity disorder. Biol Psychiatry. 2005;57:1313-1323. [PubMed] [DOI] |
| 8. | van den Berg L, Imholz S, Versteeg SA, Leegwater PA, Zijlstra C, Bosma AA, van Oost BA. Isolation and characterization of the canine serotonin receptor 1B gene (htr1B). Gene. 2004;326:131-139. [PubMed] [DOI] |
| 9. | Huang YY, Oquendo MA, Friedman JM, Greenhill LL, Brodsky B, Malone KM, Khait V, Mann JJ. Substance abuse disorder and major depression are associated with the human 5-HT1B receptor gene (HTR1B) G861C polymorphism. Neuropsychopharmacology. 2003;28:163-169. [PubMed] [DOI] |
| 10. | Malagié I, David DJ, Jolliet P, Hen R, Bourin M, Gardier AM. Improved efficacy of fluoxetine in increasing hippocampal 5-hydroxytryptamine outflow in 5-HT(1B) receptor knock-out mice. Eur J Pharmacol. 2002;443:99-104. [PubMed] [DOI] |
| 11. | Ickowicz A, Feng Y, Wigg K, Quist J, Pathare T, Roberts W, Malone M, Schachar R, Tannock R, Kennedy JL. The serotonin receptor HTR1B: gene polymorphisms in attention deficit hyperactivity disorder. Am J Med Genet B Neuropsychiatr Genet. 2007;144B:121-125. [PubMed] [DOI] |
| 12. | Smoller JW, Biederman J, Arbeitman L, Doyle AE, Fagerness J, Perlis RH, Sklar P, Faraone SV. Association between the 5HT1B receptor gene (HTR1B) and the inattentive subtype of ADHD. Biol Psychiatry. 2006;59:460-467. [PubMed] [DOI] |
| 13. | Li J, Wang Y, Zhou R, Zhang H, Yang L, Wang B, Khan S, Faraone SV. Serotonin 5-HT1B receptor gene and attention deficit hyperactivity disorder in Chinese Han subjects. Am J Med Genet B Neuropsychiatr Genet. 2005;132B:59-63. [PubMed] [DOI] |
| 14. | Yamada Y, Tsukamoto G, Kobashi M, Sasaki A, Matsumura T. Abdominal vagi mediate c-Fos expression induced by X-ray irradiation in the nucleus tractus solitarii of the rat. Auton Neurosci. 2000;83:29-36. [PubMed] [DOI] |
| 15. | Anand P, Aziz Q, Willert R, van Oudenhove L. Peripheral and central mechanisms of visceral sensitization in man. Neurogastroenterol Motil. 2007;19:29-46. [PubMed] [DOI] |
| 16. | Liu FY, Xing GG, Qu XX, Xu IS, Han JS, Wan Y. Roles of 5-hydroxytryptamine (5-HT) receptor subtypes in the inhibitory effects of 5-HT on C-fiber responses of spinal wide dynamic range neurons in rats. J Pharmacol Exp Ther. 2007;321:1046-1053. [PubMed] [DOI] |