修回日期: 2009-04-03
接受日期: 2009-04-08
在线出版日期: 2009-05-08
目的: 探讨凋亡抑制蛋白Livin及线粒体促凋亡蛋白Smac/DIABLO和PTEN在胃癌发生发展分子机制中的调控作用及意义.
方法: 实时荧光定量PCR检测75例手术切除胃癌患者组织, 20例癌旁组织及20例正常胃组织中Livin mRNA和Smac/DIABLO mRNA的表达, Western blot结合免疫组织化学法检测两者与PTEN蛋白的表达及组织学定位.
结果: 正常胃组织及癌旁组织中均无Livin mRNA表达, 胃癌组织中Livin mRNA相对表达量显著上调(6.374±4.759), 其表达在低分化胃癌组及淋巴结转移组具有显著差异(χ2 = 9.60, 5.51, P<0.01或0.05), 与肿瘤大小, 浸润程度及TNM分期等病理表现无关; Smac/DIABLO mRNA胃癌组织中的表达水平低于正常胃组织及癌旁组织, 但差异无显著性(0.731±0.420 vs 1.104±0.276, 1.061±0.737, 均P>0.05), Smac/DIABLO mRNA的表达水平与胃癌各临床病理因素无关; 其蛋白表达量与Smac/DIABLO mRNA的表达水平存在差异. Smac/DIABLO在肠型胃癌与弥漫型胃癌中的表达有显著差异(χ2 = 5.06, P<0.05). 正常胃黏膜及胃癌组织中未检出PTEN蛋白表达.
结论: Livin、Smac/DIABLO及PTEN的表达水平在不同阶段及病理类型的胃癌中存在差异. 实时荧光定量PCR检测Livin及Smac/DIABLO的表达量, 有可能为判断胃癌的发生, 分化程度及预测化疗敏感性提供新的指标.
引文著录: 赵毅, 邓鑫, 王强. Livin、Smac/DIABLO和PTEN在胃癌组织中的表达及其与胃癌的相关性. 世界华人消化杂志 2009; 17(13): 1303-1311
Revised: April 3, 2009
Accepted: April 8, 2009
Published online: May 8, 2009
AIM: To investigate the regulating role and significance of protein Livin, mitochondrial apoptosis-promoting protein Smac/DIABLO and PTEN in carcinogenesis and progression mechanism.
METHODS: Real-time RT PCR was used to examine the expression of Livin mRNA and Smac/DIABLO mRNA in 75 gastric carcinoma specimens, 20 normal gastric tissues and 20 adjacent tissues. The expression and location of Livin, Smac/DIABLO and PTEN were detected using Western blot combined with immunohistochemistry (SP).
RESULTS: The expression of Livin mRNA was significantly up-regulated in gastric carcinoma specimens (6.374 ± 4.759), however, no expression was found in normal or adjacent tissues. There was a significance in expression between low differentiated carcinoma group and lymph node metastases group (χ2 = 9.60, 5.51, P < 0.01 or 0.05). The expression of Livin mRNA had no correlation with tumor size, invasion of nerve or TNM stage. The expression of Smac/DIABLO mRNA was lower in gastric cancer tissues than in normal gastric tissues and adjacent tissues, but there was no significant difference (0.731 ± 0.420 vs 1.104 ± 0.276, 1.061 ± 0.737, all P > 0.05). The expression of Smac/DIABLO mRNA in gastric cancer tissues had no correlation with clinical pathological factors of gastric carcinoma. The expression of Smac/DIABLO held significant difference from intestinal-type gastric carcinoma to diffuse-type gastric carcinoma (χ2 = 5.06, P < 0.05). The expression of PTEN was not determined in gastric carcinoma tissues and normal tissues.
CONCLUSION: There is a diversity of expression of Livin, Smac/DIABLO and PTEN in different stages and pathological types of gastric carcinoma. Real-time RT PCR and the expression of Livin and Smac/DIABLO could be beneficial to diagnosis of gastric carcinogenesis, severity of differentiation, and chemotherapy sensitivity.
- Citation: Zhao Y, Deng X, Wang Q. Expression of Livin, Smac/DIABLO and PTEN and their relationships with human gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1303-1311
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1303.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1303
细胞凋亡与增殖失衡是导致肿瘤发生和进展的病理基础[1-3], 从分子水平探寻凋亡相关基因的表达变化是目前胃癌研究中的热点. Livin是新近发现的凋亡抑制蛋白(inhibitor of apopotsis portein, IAP)家族成员[4], 通过BIR区与caspase-3, 7, 9结合并抑制其活性, 从而抑制细胞凋亡[5-6]. Smac/DIABLO(second mitochondria -derived activator of caspase/direct IAP-binding protein with low PI)是目前发现的唯一存在于哺乳动物细胞中直接抑制IAPs的蛋白, 具有促进细胞凋亡的功能[7]. 第10号染色体同源缺失性磷酸酶-张力蛋白基因(phosphatase and tensin homology deleted on chromosome ten, PTEN)通过诱导细胞周期阻滞和细胞凋亡等机制发挥抑制肿瘤的发生发展的作用. 最近的研究表明, 凋亡抑制蛋白Livin和线粒体促凋亡蛋白Smac/DIABLO之间存在着相互拮抗、相互调节的关系, 两者复杂的作用机制是肿瘤凋亡信号转导网络中的重要环节. 本研究分别从分子水平及蛋白水平检测三者在胃癌组织中的表达, 探讨其表达变化与肿瘤发生发展及临床病理因素之间的关系, 为胃癌的分子诊断、分型及预后转归等研究奠定基础.
中国医科大学附属第二医院普通外科2006-07/2008-07手术切除胃癌标本75例, 所有病例术前均未经放化疗, 术后均经病理证实, 且临床资料完整. 年龄32-78岁, 中位年龄63岁; 男48例, 女27例; 高分化4例, 中分化9例, 低分化62例; 有局部淋巴结转移53例, 无转移22例; Ⅰ期11例, Ⅱ期18例, Ⅲ期26例, Ⅳ期20例. 胃溃疡或十二指肠溃疡患者胃黏膜20例作为正常对照(排除重度不典型增生). 20例癌旁组织为取自距胃癌组织边缘5 cm以上的胃黏膜组织, 病理证实无肿瘤细胞浸润、无明显炎症且无明显细胞增生等病变. 肿瘤的分期分级根据世界卫生组织及国际癌症防治联合会制定的标准进行划分. 主要试剂及仪器: 鼠抗人Smac/DIABLO/Diablo mAb、辣根过氧化物酶标记的羊抗兔及兔抗鼠二抗均购自Cell Signaling Technology公司(USA); 兔抗人Livin多克隆抗体BA1743购自武汉博士德生物公司, 兔抗人Actin多克隆抗体购自Santa Cruz公司(USA); 鼠抗人Livin mAb购自Alexesis公司(USA); 鼠抗人PTEN mAb购自北京中山生物技术有限公司, 工作浓度1∶75; PVDF膜购自Roch公司(USA); 免疫组化SP试剂盒购自福州迈欣生物技术公司; UVP凝胶成像分析系统购自Upland公司(USA); ABI PRISM 7500荧光定量PCR扩增仪购自Applied Biosystems公司(USA); Platinum SYBR Green qPCR Super Mix-UDG(#11733-046)、Platinum® Taq DNA polymerase(#10966-083)均购自Invitrogen公司(USA); 核酸蛋白分析仪DU-800购自Backman公司(USA); 逆转录试剂购自Promega公司(USA).
1.2.1 RNA提取及纯度测定: 取100 mg待检测的组织, 应用TRIzol Reagent(Invitrogen, USA), 参照说明书提供的方法抽提总RNA, 核酸蛋白分析仪测定其纯度, A260/A280值为1.8-2.0, 达到反转录要求. 计算样品总RNA浓度, 置于-80℃保存备用.
1.2.2 cDNA的合成: 逆转录反应体系包括细胞总RNA 4 μL(0.5 g/L), 1 U/μL Rnasin 1 μL, 0.5 g/L随机引物2 μL, 10 mmol/L dNTPs 1 μL, 5×Buffer 5 μL, 200 U/L M-MLV 1 μL, DEPC水补足至25 μL. 逆转录反应条件: 42℃, 60 min; 95℃, 10 min; 4℃, 2 min后终止反应. 产物cDNA于-80℃冻存.
1.2.3 实时定量RT-PCR检测Livin及Smac/DIABLO基因的表达: 应用ABI 7500 RQ-PCR仪检测Livin mRNA及Smac/DIABLO mRNA的相对表达量, 引物根据GenBank Livinα/β(NM_022161, NM_139317)及Smac/DIABLO(NM_019887)基因序列应用Primer 5.0(Applied Biosystems)软件设计, 美国Applied Biosystems公司合成. 选取β-actin(AK225414)作为内参. Livinα/β: 上游引物: 5'-TCCACAGTGTGCAGGAGACT-3'; 下游引物: 5'-ACGGCACAAAGACGATGGAC-3'; 扩增产物为两种片段: Livinα: 312 bp, Livinβ: 258 bp; Smae/DIABL:上游引物: 5'-TGT GAC GAT TGG CTT TGG AGT AAC-3'; 下游引物: 5'-TTC AAT CAA CGC ATA TGT GGT CTG-3'; 扩增产物片段: 425 bp, β-actin: 上游引物:5'-GAGACCTTCAACACCCCAGCC-3'; 下游引物: 5'-GGAGTACAGGTCTTTGCGGATG-3'; 扩增产物片段: 512 bp. 25 μL PCR反应体系中需加入10 μL cDNA模版, 引物各1 μmol, 10×Buffer 1 μL, 10 μL PCR反应液(Platinum SYBR Green qPCR Super Mix-UDG)包括1.5 U Platinum Taq DNA polymerase, 20 mmol Tris-HCl(pH 8.4), 50 mmol KCl, 3 mmol MgCl2, dGTP、dATP、dCTP和dUTP各200 μmol以及1 U uracil-DNA-glycosylase(UDG). 反应条件: 50℃ 2 min(预热UDG), 95℃ 2 min(灭活UDG, 激活DNA聚合酶); 95℃ 15 s, 退火61℃ 30 s, 50个循环, 延伸72℃ 10 s.
将胃癌组织及正常胃组织的cDNA按1∶10、1∶100、1∶1000、1∶10000稀释, 分别构建Livin, Smac/DIABLO及β-actin的标准品及每次扩增的标准曲线. 每次检测均设立空白阴性对照(NTC), 每个样本设3个复管. 巢式RT-PCR对荧光定量PCR的产物进行验证.
1.2.4 Western blot法检测蛋白在肿瘤组织和正常组织中表达的差异: 将100 mg组织提取的总蛋白用考马斯亮蓝试剂盒定量. 取50 μg蛋白上样到150 g/L SDS-PAGE凝胶, 电泳. 将凝胶上的蛋白电转移至NC膜, 以50 g/L脱脂奶粉4℃封闭过夜, 分别加一抗(鼠抗人Livin mAb 1∶250, 兔抗人Smac/DIABLO多克隆抗体, 兔抗人Actin多克隆抗1∶200), 37℃孵育2 h, 0.1% TBST液漂洗PVDF膜3×10 min, 取出PVDF膜加入二抗(辣根过氧化物酶标记的兔抗鼠二抗1∶5000, 羊抗兔二抗1∶5000), 37℃孵育2 h, TBST洗膜后加入ECL试剂, 曝光, 显影, 定影, 对X光底片拍照保存.
1.2.5 免疫组化SP法检测蛋白表达: 所有组织标本经40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚切片. 石蜡切片经二甲苯脱蜡, 梯度乙醇水化, 0.01 mol/L柠檬酸盐缓冲液(pH6.0)95℃抗原修复10 min, 30 mL/L H2O2室温孵育10 min, 磷酸盐缓冲液(PBS)冲洗后滴加非免疫性动物血清室温孵育15 min, 加一抗(兔抗人Livin多克隆抗体抗体浓度为1∶50, 鼠抗人Smac/DIABLO抗体1∶200, 鼠抗人PTEN mAb 1∶75)4℃孵育过夜; PBS冲洗后滴加生物素标记二抗37℃孵育10 min, 辣根过氧化物酶标记抗生物素三抗37℃孵育15 min, PBS冲洗后DAB显色, 冲洗, 苏木素复染, 透明封固. 封片, 显微镜观察并拍照. 以已知的阳性切片作阳性对照(Livin以人乳腺癌, Smac/DIABLO和PTEN以人胃腺癌为阳性对照, 以PBS代替一抗作阴性对照).
Livin和Smac/DIABLO蛋白阳性细胞主要为胞质着色, 呈棕黄色颗粒, 胞核偶见着色. PTEN在胞核染色, 呈棕黄色颗粒. 将染色强度和阳性细胞数结合判断Livin、Smac/DIABLO和PTEN染色结果. 每张切片随机选取10个高倍视野, 每个高倍视野计数100个癌细胞, 观察阳性细胞染色强度, 计数阳性细胞百分比. 先按染色强度打分: 与背景颜色相对比, 无色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分. 再按阳性细胞所占的百分比记分, 阳性细胞<5%为0分, 5%-25%为1分, 26%-50%为2分, >50%为3分. 两者之和是0分为阴性(-), 1-2分为弱阳性(+), 3-4分为阳性(++), 5-6分为强阳性(+++).
统计学处理 有关数据用mean±SD表示, SPSS13.0统计软件进行数据分析. 两个样本率的比较采用χ2检验、Fisher精确概率检验; 采用Spearman等级相关分析两变量之间相关关系. 两样本均数比较采用t检验. P<0.05定为具有统计学意义.
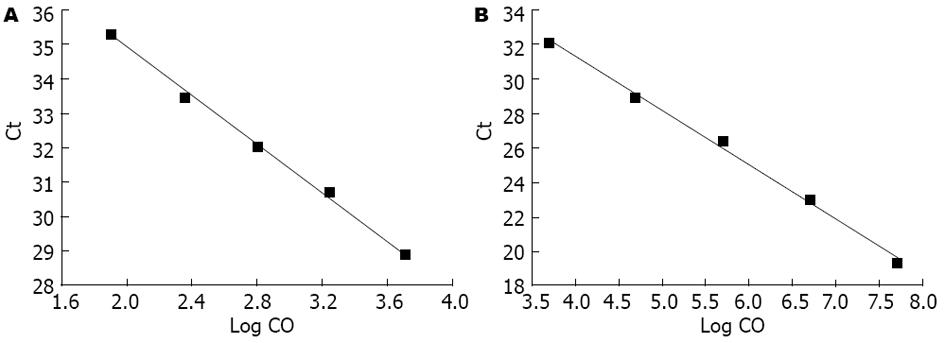
荧光定量PCR的标准曲线图中, 标准品cDNA的起始浓度的对数值与Ct值成一直线, Livin、Smac/DIABLO及β-actin的标准曲线斜率slope分别为-3.5398、-3.0459及-3.1378; 纵截距b为42.002、43.822及39.924; 相关系数r可达0.9999、0.9959及0.9964, 线性关系良好(图1). Livin及Smac/DIABLO特异性扩增产物分别对应温度(81.7±0.16)℃及(82.1±0.14)℃, 熔解曲线单峰集中无杂带, 产物特异性好. RT-PCR结果显示Livin和Smac/DIABLO分别在312 bp、258 bp和425 bp出现明亮清晰条带.
75例胃癌组织中有64例表达Livin mRNA, 其相对表达量为6.374±4.759, 20例正常组织及20例癌旁组织中均未检出其表达. 75例胃癌组织中有53例胃癌组织检测到Smac/DIABLO mRNA的表达, 且胃癌组织中的表达水平(0.731±0.420)低于正常组织(1.104±0.276)及癌旁组织(1.061±0.737), 但差异无显著性(P>0.05).
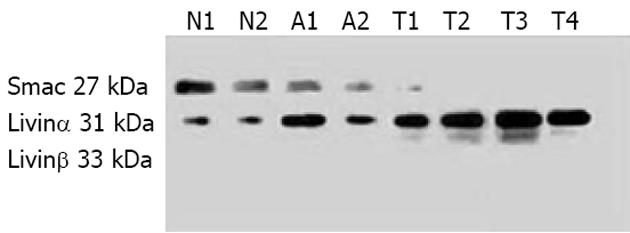
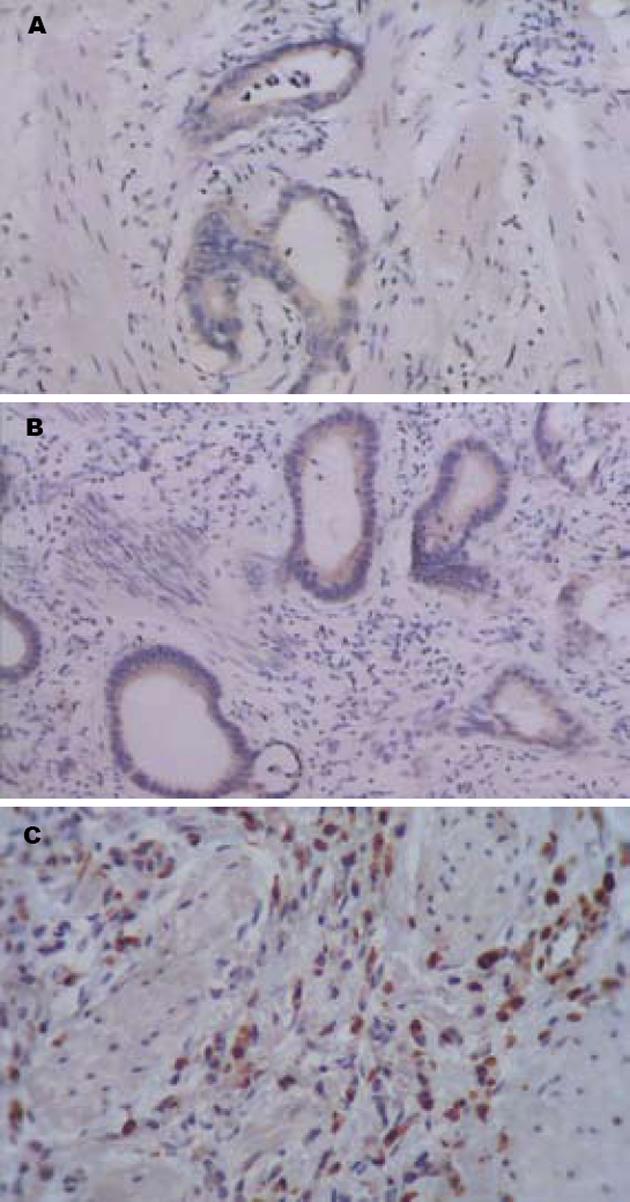
Western blot检测Livinα和Livinβ蛋白分别出现在31 kDa和33 kDa处出现条带, Smac/DIABLO蛋白出现在26 kDa处(图2). 75例胃癌组织中有59例检出Livin蛋白表达, 其中58例同表达Livin mRNA的胃癌标本相一致, 而Smac/DIABLO蛋白的表达率为49.33%, 与mRNA表达的一致性较差. 免疫组化染色结果显示, 癌旁组织及正常胃组织均无Livin表达, 其阳性染色主要位于胃癌组织的细胞质, 分布弥散而均匀(图3A). Smac/DIABLO在胃癌组织、癌旁组织及正常胃组织中均有表达, 其阳性染色主要于细胞质和少部分细胞核. 各切片显色分布不均, 以弥漫性分布为主, 少数为片状和局灶性(图3B). 胃癌组织无PTEN表达, 其阳性染色主要位于正常及癌旁组织, 分布弥散而均匀(图3C).
Livin的表达率随着胃癌组织分化程度的降低而增高, 呈显著负相关(P<0.01), 而与肿瘤的大小、临床分期及浸润深度无关(P>0.05). 伴淋巴转移组Livin的阳性率(92.45%)大于无淋巴转移组(68.19%), 且差异有显著性(P<0.05). Smac/DIABLO表达率随胃癌临床分期的提高、肿瘤浸润深度的加深、随着胃癌组织分化程度的减低及伴淋巴结转移的产生而降低, 但并无显著差异(P>0.05); 84.38%的肠型胃癌(27/32例)表达Smac/DIABLO, 明显高于其在弥散型胃癌的表达率(60.65%)(表1).
| 参数 | n | Livin | χ2值 | P值 | Smac/DIABLO | χ2值 | P值 | ||
| 阳性 (n) | 阳性率(%) | 阳性 (n) | 阳性率(%) | ||||||
| 年龄 | |||||||||
| 30-50 | 14 | 11 | 78.57 | 1.38 | >0.05 | 9 | 64.29 | 0.35 | >0.05 |
| 50-70 | 46 | 41 | 89.13 | 33 | 71.74 | ||||
| ≥70 | 15 | 12 | 80.00 | 11 | 73.33 | ||||
| 性别 | |||||||||
| 男 | 48 | 42 | 87.50 | 0.13 | >0.05 | 35 | 72.92 | 0.33 | >0.05 |
| 女 | 27 | 22 | 81.48 | 18 | 66.67 | ||||
| TNM分期 | |||||||||
| Ⅰ+Ⅱ | 29 | 24 | 82.76 | 0.03 | >0.05 | 22 | 75.86 | 0.62 | >0.05 |
| Ⅲ+Ⅳ | 46 | 40 | 86.96 | 31 | 67.39 | ||||
| 浸润深度 | |||||||||
| T1 T2 | 35 | 29 | 82.86 | 0.32 | >0.05 | 26 | 74.29 | 0.41 | >0.05 |
| T3 T4 | 40 | 35 | 87.50 | 70.45 | |||||
| 肿瘤大小(cm) | |||||||||
| ≥5 | 31 | 27 | 87.10 | 0.00 | >0.05 | 23 | 74.19 | 0.13 | >0.05 |
| <5 | 44 | 37 | 84.09 | 31 | |||||
| 分化程度 | |||||||||
| 高中分化 | 13 | 7 | 53.85 | 9.60 | <0.01 | 10 | 76.92 | 0.04 | >0.05 |
| 低分化 | 62 | 57 | 91.94 | 43 | 69.35 | ||||
| 淋巴结转移 | |||||||||
| 有 | 53 | 49 | 92.45 | 5.51 | <0.05 | 36 | 67.92 | 0.66 | >0.05 |
| 无 | 22 | 15 | 68.19 | 17 | 77.27 | ||||
| Lauren's分型 | |||||||||
| 肠型 | 32 | 28 | 87.50 | 0.02 | >0.05 | 27 | 84.38 | 5.06 | 0.01<P<0.05 |
| 弥散型 | 43 | 36 | 83.72 | 26 | 60.65 | ||||
凋亡是由基因控制的细胞自我消亡过程. 目前认为机体细胞凋亡的调控机制发生紊乱与肿瘤形成关系密切, 是其形成过程中的一个重要机制. 细胞凋亡受多条通路和多种因子的调控, IAPs家族是新近发现的人类内源性抗凋亡蛋白家族, Livin是Ashhab et al[8]在2000-2001年根据IAP同源序列发现的一种新的细胞凋亡抑制蛋白, 他含有IAP家族成员特有的BIR和RING指结构域, 其转录产物因剪接方式不同形成有Livinα mRNA和Livinβ mRNA两种亚型. Livin通过直接或间接阻断以凋亡受体及线粒体为基础的外源性途径和内源性途径, 与各种凋亡刺激因子结合发挥抑制细胞凋亡的作用[9].
目前的国内外研究均提示Livin主要表达于恶性肿瘤组织和胎儿组织, 在成人除胎盘外的大多数终末分化组织中不表达或表达下调[10]. 作为一种具有表达特异性的凋亡抑制蛋白, Livin在胃癌中研究的相关报道较少. Yagihashi et al[11]采用RT-PCR的方法检测了胃癌细胞株Livin mRNA高表达, 并采用ELISA的方法及Western blot检测到在17/35例(47%)胃肠道肿瘤患者血清有抗Livin抗体的表达. 本研究结果显示, 75例胃癌组织中Livin阳性率为85.33%, 而癌旁组织和正常胃组织不表达Livin, 与Yagihashi et al的结果相似. Livin特异性表达在胃癌中, 而癌旁组织及良性的胃溃疡组织中无表达, 提示其表达与胃癌的发生发展有一定的关系.
Livin与临床病理因素间的关系在各种肿瘤组织中报道有所不同, 有报道Livin在分期较晚者胃癌中比例较高[12], 但整个研究例数偏少. 本研究结果显示Livin在有淋巴结转移、组织分化较差者中阳性率高, 且差异显著. Livin在胃癌组织中的表达与其分化程度具有显著相关性(P<0.05), 可能是Livin在胃癌发生过程中导致凋亡受抑, 胃癌细胞表现为过度增殖, 提示其在判断胃癌的侵袭性及恶性程度上有一定的意义. 此外, 本研究中肿瘤浸润较深、临床病理分期较晚者Livin阳性率有升高趋势, 但统计学分析没有显著性差异, 不排除与样本量不足有关.
Western blot结果显示在有Livin表达的胃癌组织中, 其表达的强弱也有差异, 推测可能是每例胃癌类型和病理分期不同, 结合转录水平的研究结果, 表明在胃癌中Livin mRNA和蛋白的表达具有较高的一致性, 该基因在mRNA和蛋白水平是相对稳定.
Livin mRNA和蛋白在正常胃组织、癌旁组织及胃癌组织中表达的一致性提示该基因在胃癌组织中的异常高表达发生于转录以上水平的激活. 最新的研究报道指出[13], Livin在转录水平直接受到β-catenin的调节, 可能是启动Livin基因在肿瘤中的活化的重要原因. Livin可能是通过参与β-catenin/TCF信号转导通路的调节, 在肿瘤发病的分子机制中起着一定的作用.
Livin在细胞内定位尚无定论. 有研究显示转染Livin的HeLa细胞和肺癌细胞在胞质和胞核中同时显色[14]. 本研究中Livin阳性显色均位于肿瘤细胞的胞质中, 与Yagihashi et al[15]在乳腺癌中的研究结果相一致.
胃癌组织中高表达Livin, 其在胃癌中表达具有一定的普遍性, 初步提示Livin可能有助于胃癌的诊断. Livin在胃癌组织中表达增高, 且与组织分化程度和淋巴结转移有关, 提示其在胃癌的发生和发展中具有重要的作用. Livin异常高表达可能与胃癌的发病有密切的关系, 可作为辅助胃癌预后判断的分子标志之一.
Smac/DIABLO是2000-07首次报道的一种促凋亡蛋白. 主要定位于线粒体上[16]. Smac/DIABLO在正常细胞不诱发凋亡, 只在受损的细胞中起作用. 成熟Smac/DIABLO在细胞发生凋亡时与细胞色素C一同释放入胞质, 通过逆转IAP的作用而实现其促凋亡作用[17-18]. Smac/DIABLO参与并介导许多凋亡事件, 包括死亡受体介导的凋亡和中性粒细胞的自发凋亡[19], 直接与Apaf-1, cyto-c和caspase-9作用, 增强caspase的激活效应. 同时通过与IAP结合, 去除IAPs的抑制作用来促caspase-9的激活[20].
Smac/DIABLO作为促凋亡基因, 目前国内外对其在肿瘤组织中的表达报道各异. Yoo et al[21]研究发现约62%的癌组织中可见Smac/DIABLO表达, 且不同的癌组织中Smac/DIABLO的表达有差异, 在肾癌[22-23]、肝癌[24]、神经母细胞瘤[25-26]等实体恶性肿瘤中的研究均显示他表达下调或缺失. 本研究中, 胃癌组织中Smac/DIABLO表达率为70.67%(53/75, 正常胃组织及癌旁组织标本中均可见Smac/DIABLO表达, 与Yoo et al研究结果基本一致. 胃癌组织中Smac/DIABLO mRNA的相对表达量低于正常胃组织及癌旁组织, 但不具有显著差异(P<0.05), 且其表达水平与胃癌各临床病理因素无关. 我们推测Smac/DIABLO在癌组织中表达下降, 可能是因为直接或间接影响Livin的活性, 拮抗其发挥抑制胃癌细胞凋亡的功能, 在胃癌中Smac/DIABLO表达量的多少并不一定能反应恶性程度的高低.
值得一提的是, 本研究中Western blot结果显示细胞内Smac/DIABLO蛋白的表达与其mRNA的表达有显著差异, 一致性较差. Smac属于细胞正常的基因表达, 其mRNA和蛋白的表达量不一致表明其表达强度受到许多外界因素的影响, 可能是转录后存在其他一些调节因素的作用, 例如原癌基因或抑癌基因如bcl-2、p53等通过其蛋白与凋亡相关基因启动子、转录后加工修饰或翻译调控区的特定序列结合, 影响凋亡相关蛋白的表达, 发挥对其下游caspase家族的作用效应[27]. 故推测在胃癌中, 一方面胃癌中异常升高的Livin通过与Smac/DIABLO蛋白结合引起Smac/DIABLO蛋白表达减少, 对抗其家族其他成员如XIAP或survivin和Smac/DIABLO之间的相互作用, 间接发挥抗凋亡作用[28]. 另一方面可能存在其他各种抑制因子作用于Smac/DIABLO的翻译或之后的蛋白的水平, 使某些细胞没有对mRNA进行有效翻译, 或者翻译过程中存在蛋白表达丢失的现象, 导致两个表达水平上的调控机制的不平衡.
随着对肿瘤相关基因研究的不断深入, 越来越多的抑癌基因被相继发现. PTEN又名TEP1(TGF-β-regulated and epithelial cell enriched phosphatase)基因和MMAC1(muted in multiple advanced cancers)基因[29]. 是1997年由3个实验室分离鉴定并统一命名而确认的新的候选抑癌基因. PTEN基因位于染色体10q23.3,全长200 kb, 有9个外显子和8个内含子, PTEN第5外显子编码的122-132位氨基酸序列与酪氨酸磷酸酯酶或丝/苏氨酸、酪氨酸双特异磷酸酯酶催化中心的氨基酸序列高度一致. 酪氨酸磷酸酯酶能够拮抗蛋白质酪氨酸激酶的生长刺激作用, PTEN蛋白与酪氨酸磷酸酯酶有相同的功能. PTEN基因与抑癌功能相关的结构域主要是氨基端的磷酸酶结构域、脂质结合C2结构域和羧基端结构域. PTEN的N端辅助蛋白与神经突触小泡的运输有关; 张力蛋白为一种细胞骨架蛋白, 在细胞聚集黏着时, 在锚着点通过黏着斑与肌动蛋白细丝形成复合体, 共同参与细胞生长调节, 并在肿瘤细胞浸润、血管发生及肿瘤转移中起到一定作用[30-31]. PTEN蛋白能与肌动蛋白纤维细丝发生局部黏附, 参与细胞的黏附聚集而抑制肿瘤细胞的浸润及转移. 本研究结果显示, PTEN蛋白表达于正常胃组织, 在胃癌中未观察到其特异表达, 推测PTEN基因可能在正常胃组织中发挥抑制肿瘤的作用.
以往研究显示, Livin和Smac/DIABLO基因之间的表达存在相互拮抗的负反馈调节关系[32]. 本研究结果未显示出两者之间存在某种明确的相关性, 可能是因为Livin与Smac/DIABLO相互作用的同时还直接或间接受多种因素如死亡受体、caspase酶、线粒体及其他凋亡抑制蛋白等的影响, 参与不同的相关传导通路信号的调节, 导致两者在胃癌发生发展的不同阶段和不同病理类型中的表达水平及作用地位存在差异. 此外, 癌前病变的细胞对细胞凋亡信号刺激是有反应的, 细胞增生和凋亡相互间是有联系的, 促凋亡基因和凋亡抑制基因在肿瘤发生过程中均可表达上调[33]. 在对检测结果进行分析时, 我们发现Livin与Smac基因相对拷贝数的比值在正常胃组织与胃癌组织之间及胃癌进展过程中成单向的上升趋势. 胃癌中Livin与Smac基因的表达比具有多大的临床意义, 是我们下阶段研究中所要观察和探讨的方向之一.
本研究中Samc在Lauren's分型为肠型(84.38%)和弥漫型胃癌(60.65%)中的表达水平呈现一定差异(0.01<P<0.05). 可能是由于肠型胃癌往往伴有p53基因的突变[34], 突变型p53使bax表达下调, 粒体膜通透性减低, 进而导致Samc释放障碍. Samc表达水平在肠型胃癌和弥漫型胃癌中存在差异提示两型胃癌可能在演进过程中对凋亡信号的反应敏感性有所不同, 体现了"肿瘤的异质化". 但Samc能否为胃癌的分型提供分子病理学依据, 尚需大量进一步深入研究.
胃癌中凋亡抑制基因及促凋亡基因表达产物间的相互抑制, 相互调节, 组成了复杂的肿瘤抑制及促进网络. 应用实时荧光定量PCR对检测凋亡相关基因的表达, 可以由较少的细胞数量得到更加可信的结果, 敏感性和特异性高, 简便易行, 使其应用于临床胃癌的早期诊断和预后分析成为可能. Livin特异性高表达于各阶段的胃癌组织, 提示其存在贯穿于胃癌的发生发展过程, 可能在癌细胞的生长、增殖、凋亡过程中起到广泛的直接或间接促进作用, PTEN在维持细胞正常生长, 抑抵制癌因素上发挥一定作用. Smac/DIABLO与Livin相互抑制, 两者的表达失调可能是胃癌发生发展过程中的一个重要环节.
Livin在黑色素瘤、 白血病、肺癌、膀胱癌、消化系肿瘤等许多恶性肿瘤中高表达, 该基因可能在肿瘤的发生发展中起重要的作用, 而Smac在不同癌组织中表达不同, Smac高表达可增强癌细胞对各种凋亡刺激的敏感性. 胃癌中是否存在Smac介导的对抗Livin抑制细胞凋亡作用的负性调节机制尚未得到明确的研究结论.
陈卫昌, 教授, 苏州大学附属第一医院消化内科; 关玉盘, 教授, 首都医科大学附属朝阳医院消化科.
细胞凋亡调节紊乱是细胞恶性转化及肿瘤进展的关键因素之一. 研究肿瘤细胞凋亡的分子调控机制, 阐明凋亡信号通路及其相关调控因子的相互作用成为目前的研究焦点.
凋亡抑制蛋白家族IAPs的新成员 Livin在凋亡信号转导通路中发挥抑制作用, 而Smac是目前发现的唯一存在于哺乳动物细胞中直接抑制IAPs的蛋白, 可以与多种IAPs分子结合. 最近研究表明Livin和Smac之间存在着复杂的相互关系.
本研究从分子和蛋白水平检测Livin及Smac在胃癌中的表达, 对两者间的相互关系及其与胃癌各临床病理特征的相关性进行探讨, 初步阐明两者在胃癌发生发展过程中的作用及意义.
本研究首次应用实时荧光定量PCR、Western blot及免疫组织化学方法, 对凋亡相关调控基因Livin和Smac mRNA及其转录产物所编码的蛋白进行定量检测, 为研究胃癌的分子标志物及其临床检测奠定坚实基础.
1 IAP: 一类对凋亡信号具有抑制作用的调控因子. 2 Smac: IAP的主要对抗物, 有促进凋亡作用.
本研究选题尚可, 方法先进, 具有一定的科学性和可读性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Feng Y, Tian ZM, Wan MX, Zheng ZB. Low intensity ultrasound-induced apoptosis in human gastric carcinoma cells. World J Gastroenterol. 2008;14:4873-4879. [PubMed] [DOI] |
| 2. | Nørsett KG, Laegreid A, Kusnierczyk W, Langaas M, Ylving S, Fossmark R, Myhre S, Falkmer S, Waldum HL, Sandvik AK. Changes in gene expression of gastric mucosa during therapeutic acid inhibition. Eur J Gastroenterol Hepatol. 2008;20:613-623. [PubMed] [DOI] |
| 3. | Gangar SC, Koul A. Histochemical, ultrastructural, and biochemical evidences for Azadirachta indica-induced apoptosis in benzo(a)pyrene-induced murine forestomach tumors. J Environ Pathol Toxicol Oncol. 2008;27:219-232. [PubMed] |
| 4. | Hariu H, Hirohashi Y, Torigoe T, Asanuma H, Hariu M, Tamura Y, Aketa K, Nabeta C, Nakanishi K, Kamiguchi K. Aberrant expression and potency as a cancer immunotherapy target of inhibitor of apoptosis protein family, Livin/ML-IAP in lung cancer. Clin Cancer Res. 2005;11:1000-1009. [PubMed] |
| 5. | Grzybowska-Izydorczyk O, Smolewski P. [The role of the inhibitor of apoptosis protein (IAP) family in hematological malignancies]. Postepy Hig Med Dosw (Online). 2008;62:55-63. [PubMed] |
| 6. | Liu B, Han M, Wen JK, Wang L. Livin/ML-IAP as a new target for cancer treatment. Cancer Lett. 2007;250:168-176. [PubMed] [DOI] |
| 7. | Tong QS, Zheng LD, Wang L, Zeng FQ, Chen FM, Dong JH, Lu GC. Downregulation of XIAP expression induces apoptosis and enhances chemotherapeutic sensitivity in human gastric cancer cells. Cancer Gene Ther. 2005;12:509-514. [PubMed] |
| 8. | Ashhab Y, Alian A, Polliack A, Panet A, Ben Yehuda D. Two splicing variants of a new inhibitor of apoptosis gene with different biological properties and tissue distribution pattern. FEBS Lett. 2001;495:56-60. [PubMed] [DOI] |
| 9. | Ka H, Hunt JS. Temporal and spatial patterns of expression of inhibitors of apoptosis in human placentas. Am J Pathol. 2003;163:413-422. [PubMed] |
| 10. | Nachmias B, Mizrahi S, Elmalech M, Lazar I, Ashhab Y, Gazit R, Markel G, Ben-Yehuda D, Mandelboim O. Manipulation of NK cytotoxicity by the IAP family member Livin. Eur J Immunol. 2007;37:3467-3476. [PubMed] [DOI] |
| 11. | Yagihashi A, Asanuma K, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of anti-livin antibody in gastrointestinal cancer patients. Clin Chem. 2003;49:1206-1208. [PubMed] [DOI] |
| 12. | Tanabe H, Yagihashi A, Tsuji N, Shijubo Y, Abe S, Watanabe N. Expression of survivin mRNA and livin mRNA in non-small-cell lung cancer. Lung Cancer. 2004;46:299-304. [PubMed] [DOI] |
| 13. | Yuan D, Liu L, Gu D. Transcriptional regulation of livin by beta-catenin/TCF signaling in human lung cancer cell lines. Mol Cell Biochem. 2007;306:171-178. [PubMed] [DOI] |
| 14. | Ma L, Huang Y, Song Z, Feng S, Tian X, Du W, Qiu X, Heese K, Wu M. Livin promotes Smac/DIABLO degradation by ubiquitin-proteasome pathway. Cell Death Differ. 2006;13:2079-2088. [PubMed] [DOI] |
| 15. | Yagihashi A, Ohmura T, Asanuma K, Kobayashi D, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of autoantibodies to survivin and livin in sera from patients with breast cancer. Clin Chim Acta. 2005;362:125-130. [PubMed] [DOI] |
| 16. | Chai J, Du C, Wu JW, Kyin S, Wang X, Shi Y. Structural and biochemical basis of apoptotic activation by Smac/DIABLO. Nature. 2000;406:855-862. [PubMed] [DOI] |
| 17. | Vince JE, Wong WW, Khan N, Feltham R, Chau D, Ahmed AU, Benetatos CA, Chunduru SK, Condon SM, McKinlay M. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 2007;131:682-693. [PubMed] [DOI] |
| 18. | Morizane Y, Honda R, Fukami K, Yasuda H. X-linked inhibitor of apoptosis functions as ubiquitin ligase toward mature caspase-9 and cytosolic Smac/DIABLO. J Biochem. 2005;137:125-132. [PubMed] [DOI] |
| 19. | Wang L, Du F, Wang X. TNF-alpha induces two distinct caspase-8 activation pathways. Cell. 2008;133:693-703. [PubMed] [DOI] |
| 20. | Bockbrader KM, Tan M, Sun Y. A small molecule Smac-mimic compound induces apoptosis and sensitizes TRAIL- and etoposide-induced apoptosis in breast cancer cells. Oncogene. 2005;24:7381-7388. [PubMed] [DOI] |
| 21. | Yoo NJ, Kim HS, Kim SY, Park WS, Park CH, Jeon HM, Jung ES, Lee JY, Lee SH. Immunohistochemical analysis of Smac/DIABLO expression in human carcinomas and sarcomas. APMIS. 2003;111:382-388. [PubMed] [DOI] |
| 22. | Gao Z, Tian Y, Wang J, Yin Q, Wu H, Li YM, Jiang X. A dimeric Smac/diablo peptide directly relieves caspase-3 inhibition by XIAP. Dynamic and cooperative regulation of XIAP by Smac/Diablo. J Biol Chem. 2007;282:30718-30727. [PubMed] [DOI] |
| 23. | Kempkensteffen C, Hinz S, Christoph F, Krause H, Magheli A, Schrader M, Schostak M, Miller K, Weikert S. Expression levels of the mitochondrial IAP antagonists Smac/DIABLO and Omi/HtrA2 in clear-cell renal cell carcinomas and their prognostic value. J Cancer Res Clin Oncol. 2008;134:543-550. [PubMed] [DOI] |
| 24. | Bao ST, Gui SQ, Lin MS. Relationship between expression of Smac and Survivin and apoptosis of primary hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2006;5:580-583. [PubMed] |
| 25. | Kim DK, Alvarado CS, Abramowsky CR, Gu L, Zhou M, Soe MM, Sullivan K, George B, Schemankewitz E, Findley HW. Expression of inhibitor-of-apoptosis protein (IAP) livin by neuroblastoma cells: correlation with prognostic factors and outcome. Pediatr Dev Pathol. 2005;8:621-629. [PubMed] [DOI] |
| 26. | Liu X, Chen N, Wang X, He Y, Chen X, Huang Y, Yin W, Zhou Q. Apoptosis and proliferation markers in diffusely infiltrating astrocytomas: profiling of 17 molecules. J Neuropathol Exp Neurol. 2006;65:905-913. [PubMed] [DOI] |
| 27. | Kempkensteffen C, Jäger T, Bub J, Weikert S, Hinz S, Christoph F, Krause H, Schostak M, Miller K, Schrader M. The equilibrium of XIAP and Smac/DIABLO expression is gradually deranged during the development and progression of testicular germ cell tumours. Int J Androl. 2007;30:476-483. [PubMed] [DOI] |
| 28. | Vucic D, Franklin MC, Wallweber HJ, Das K, Eckelman BP, Shin H, Elliott LO, Kadkhodayan S, Deshayes K, Salvesen GS. Engineering ML-IAP to produce an extraordinarily potent caspase 9 inhibitor: implications for Smac-dependent anti-apoptotic activity of ML-IAP. Biochem J. 2005;385:11-20. [PubMed] [DOI] |
| 29. | Trotman LC, Wang X, Alimonti A, Chen Z, Teruya-Feldstein J, Yang H, Pavletich NP, Carver BS, Cordon-Cardo C, Erdjument-Bromage H. Ubiquitination regulates PTEN nuclear import and tumor suppression. Cell. 2007;128:141-156. [PubMed] [DOI] |
| 30. | Wang MY, Lu KV, Zhu S, Dia EQ, Vivanco I, Shackleford GM, Cavenee WK, Mellinghoff IK, Cloughesy TF, Sawyers CL. Mammalian target of rapamycin inhibition promotes response to epidermal growth factor receptor kinase inhibitors in PTEN-deficient and PTEN-intact glioblastoma cells. Cancer Res. 2006;66:7864-7869. [PubMed] [DOI] |
| 31. | Morimoto AM, Berson AE, Fujii GH, Teng DH, Tavtigian SV, Bookstein R, Steck PA, Bolen JB. Phenotypic analysis of human glioma cells expressing the MMAC1 tumor suppressor phosphatase. Oncogene. 1999;18:1261-1266. [PubMed] [DOI] |
| 32. | Chang H, Schimmer AD. Livin/melanoma inhibitor of apoptosis protein as a potential therapeutic target for the treatment of malignancy. Mol Cancer Ther. 2007;6:24-30. [PubMed] [DOI] |
| 33. | Schulze-Bergkamen H, Krammer PH. Apoptosis in cancer--implications for therapy. Semin Oncol. 2004;31:90-119. [PubMed] [DOI] |
| 34. | Rugge M, Shiao YH, Busatto G, Cassaro M, Strobbe C, Russo VM, Leo G, Parenti AR, Scapinello A, Arslan P. The p53 gene in patients under the age of 40 with gastric cancer: mutation rates are low but are associated with a cardiac location. Mol Pathol. 2000;53:207-210. [PubMed] [DOI] |