修回日期: 2009-03-20
接受日期: 2009-03-23
在线出版日期: 2009-05-08
目的: 观察5-ASA对三硝基苯磺酸(TNBS)灌肠诱发的结肠炎大鼠血中性粒细胞凋亡及血清IL-8水平的影响, 并探讨5-ASA治疗炎症性肠病(IBD)的作用机制.
方法: 成年SD大鼠30只, ♀, 随机分成A、B、C组, A组为正常对照组, B、C组采用TNBS/乙醇灌肠制作大鼠结肠炎模型. B组每天给予生理盐水1 mL灌肠, C组每天给予5-ASA溶液(200 mg/kg)灌肠, 连续7 d. 经过处理后评定各组大鼠一般状况、结肠大体损伤及结肠组织学损伤; 在全麻下心脏采血, 分别通过流式细胞术检测血中性粒细胞凋亡率及通过酶联免疫吸附法检测血清中IL-8浓度.
结果: 与A组比较, B组的DAI评分、大体损伤评分和组织学损伤评分及血清IL-8水平均显著升高(2.74±0.437分 vs 0.27±0.346分, 5.10±1.101分 vs 0.50±0.527分, 4.70±0.949分 vs 0.44±0.458分, 720.97±71.718 ng/L vs 129.88±18.399 ng/L, 均P<0.01), 而C组(1.34±0.385分, 1.70±0.483分, 1.50±0.850分, 392.84±43.628 ng/L)明显低于B组(均P<0.01); 与A组比较, B组中性粒细胞凋亡率明显降低(30.54%±4.036% vs 56.13%±5.188%, P<0.01), 而C组(48.89%±4.522%)明显高于B组(P<0.01).
结论: 5-ASA灌肠对结肠炎大鼠具有显著的治疗作用, 其机制可能与其降低血清IL-8水平及诱导血中性粒细胞凋亡有关.
引文著录: 贺文成, 李瑾, 周瑞, 唐平飞. 5-ASA对TNBS结肠炎大鼠血中性粒细胞凋亡及血清IL-8水平的影响. 世界华人消化杂志 2009; 17(13): 1297-1302
Revised: March 20, 2009
Accepted: March 23, 2009
Published online: May 8, 2009
AIM: To investigate the therapeutic mechanism of 5-ASA in inflammatory bowel disease (IBD) through observation of its effects on serum level of IL-8 and PMN apoptosis in trinitrobenzene sulphonic acid (TNBS)-induced rat colitis.
METHODS: Thirty female Sprague-Dawley (SD) rats were randomly divided into three groups, namely, normal control group (group A) and colitis groups (group B and C). Then group B was given 1 mL normal saline while group C was given 5-ASA (200 mg/kg) for 7 d. All of the animals in three groups were anesthetized, and the macroscopic and histological changes of the colon were evaluated and scored. Expression of serum IL-8 was detected using ELISA, and the apoptosis of PMN was examined by flow cytometry.
RESULTS: Compared with group A, macroscopic and histological scores and the serum level of IL-8 were significantly higher in group B (2.74 ± 0.437 vs 0.27 ± 0.346, 5.10 ± 1.101 vs 0.50 ± 0.527, 4.70 ± 0.949 vs 0.44 ± 0.458, 720.97 ± 71.718 ng/L vs 129.88 ± 18.399 ng/L, all P < 0.01), but they were markedly decreased in group C than in group B (1.34 ± 0.385 vs 2.74 ± 0.437, 1.70 ± 0.483 vs 5.10 ± 1.101, 1.50 ± 0.850 vs 4.70 ± 0.949, 392.84 ± 43.628 ng/L vs 720.97 ± 71.718 ng/L, all P < 0.01). Compared with group A, PMN apoptosis rate was notably lower in group B (30.54% ± 4.036% vs 56.13% ± 5.188%, P < 0.01), but it was markedly increased in group C (48.89% ± 4.522%) than in group B (P < 0.01).
CONCLUSION: There is notably therapeutic effect in topical enema with 5-ASA for IBD, which may be related to reduced serum level of IL-8 and induced PMN apoptosis.
- Citation: He WC, Li J, Zhou R, Tang PF. Effect of 5-ASA on serum level of IL-8 and PMN apoptosis in TNBS-induced rat colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1297-1302
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1297.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1297
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和Crohn's病(Crohn's disease, CD), 是一种病因和发病机制至今尚未完全明确的慢性肠道炎症性疾病. 目前认为IBD发病机制可能涉及遗传、免疫失调、感染、环境及精神心理因素等诸多方面, 并认为他是多种炎症细胞、细胞因子、炎症介质、神经内分泌肽及活性氧共同作用引起的肠道黏膜的损伤[1]. 目前针对性的治疗药物主要包括氨基水杨酸类制剂、糖皮质激素、免疫抑制剂、黏膜保护剂等. 氨基水杨酸类制剂(如5-ASA)是目前临床上最为常用的治疗IBD的药物, 但其治疗机制并未完全明确. 本次研究通过观察5-ASA对TNBS结肠炎大鼠血中性粒细胞(polymorphonuclear neutrophil, PMN)凋亡及血清IL-8水平的影响, 来探讨其治疗机制.
清洁级健康成年♀未育Sprague-Dawley(SD)大鼠30只, 7 wk龄, 体质量190-220 g, 由武汉大学实验动物研究中心提供; 50 g/L 2, 4, 6-三硝基苯磺酸(2, 4, 6-TNBS)和5-氨基水杨酸(5-ASA)均购自美国Sigma公司; 大鼠IL-8 ELISA试剂盒为英国R&D公司产品; 大鼠淋巴细胞分离液Ficoli购自天津灏洋生物有限公司; 红细胞裂解液为北京索莱宝科技有限公司产品; RPMI 1640培养液购自美国Gibco公司; 100 mL/L胎牛血清购自杭州四季青生物工程材料有限公司; Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司; 酶标仪购自日本日立公司; 流式细胞仪购自德国PARTEC公司.
1.2.1 动物模型的制备及处理: 30只SD大鼠, 置于温度为(22±1)℃, 湿度为50%-70%的净化动物饲养房内, 混合食料喂养, 自由饮水. 随机数字表法将大鼠随机分成A、B、C组, 每组各10只. A组作为正常对照组, B、C组参考文献[2-3]方法建立大鼠结肠炎模型: 第1天观察记录实验前大鼠的一般情况, 第2天禁食不禁水1 d, 第3天用20 g/L异戊巴比妥钠(40 mg/kg)ip麻醉, 用橡胶管经大鼠肛门插入结肠深约8 cm, 每只大鼠一次性注入TNBS/乙醇混合溶液(按100 mg/kg的量计算TNBS加上等体积的无水乙醇). 第4天观察造模效果, 造模成功后, 第5天, 各组分别给予不同的处理方法: B组给予生理盐水1 mL灌肠; C组给予5-ASA溶液(200 mg/kg)1 mL灌肠; 此后每天于同一时间段给药1次, 于治疗7 d后在全麻下取材.
1.2.2 观察指标及检测方法: (1)大鼠的一般情况: 每天在给予处理前观察大鼠精神状态、毛发光泽、活动状态等变化并记录体质量变化、大便性状和便血情况(大便潜血试纸检测). 对后三项指标进行疾病活动指数(disease activity index, DAI)评分. DAI = (体质量下降分数+大便性状分数+便血分数)/3. (2)大鼠结肠组织大体损伤评分和组织学损伤评分: 各组大鼠均在第12天全麻下取远端结肠约12 cm, 沿纵轴剪开肠管并用冰盐水冲洗干净后, 参考文献[4]进行局部结肠大体损伤评分. 此后, 取病变段结肠标本经40 g/L甲醛固定、石蜡包埋后切片进行HE染色, 光镜下观察炎症浸润情况, 并采用Fedorak积分标准进行组织学损伤评分[5]. (3)大鼠血清IL-8浓度检测: 第12天各组大鼠全麻下心脏取血, 酶联免疫吸附实验(ELISA)检测血清IL-8浓度. 具体方法及操作步骤按试剂盒说明书进行, 根据测得标准品的A值及对应浓度结果绘制出标准曲线, 根据标准曲线估算出样本中IL-8的浓度. (4)大鼠血PMN提取、纯化与培养: 第12天各组大鼠在全麻下心脏取血约3 mL, 肝素抗凝, 参考文献[6-7]采用密度梯度离心法分离出PMN, 经台盼蓝染色法检测PMN活力>98%、瑞氏染色法检测PMN纯度>95%后悬于含100 mL/L胎牛血清的RPMI-1640培养液中, 并调整细胞浓度为1×106/L, 置于50 mL/L CO2浓度、37℃培养箱中培养24 h. (5)大鼠血PMN凋亡的检测: 取培养24 h后的PMN, 用PH为7.2的PBS洗涤两次, 调整细胞浓度为1×106/L, 按Annexin V-FITC细胞凋亡检测试剂盒说明书进行染色后上流式细胞仪进行凋亡检测.
统计学处理 计量资料以mean±SD表示, 使用SPSS13.0统计软件进行统计分析, 采用方差分析法判断资料的同质性, 两组间比较采用t检验, 两变量之间的相关关系采用Spearman相关分析, 两变量之间的回归曲线关系采用曲线估计分析, P<0.05认为差异有统计学意义.
大鼠经TNBS灌肠苏醒后, 都明显出现食量下降, 稀便(其中尚有7只(B组3只, C组4只)大鼠出现黏液血便)等消化系症状以及毛发无光泽、精神萎靡、体质量下降等全身改变. 经5-ASA治疗后的大鼠上述表现逐渐好转, 处死前治疗组大鼠已无稀便及血便, 精神明显好转, 食量和体质量明显增加, DAI评分明显下降(表1).
B组大鼠结肠炎症病变主要靠近肛门段结肠, 病变黏膜弥漫性充血、水肿、脆性增加, 糜烂和溃疡形成, 局部肠壁增厚, 肠腔狭窄, 部分大鼠的结肠与周围组织粘连, 甚至有腹水形成. 经过5-ASA治疗后的大鼠结肠局部病变明显好转, 大部分仅表现为局部肠壁黏膜充血、增厚或瘢痕形成, 少部分尚有局部点状糜烂、浅溃疡. B组结肠大体损伤评分明显高于A组(P<0.01, t = 11.92), C组则明显低于B组(P<0.01, t = 8.95, 表1).
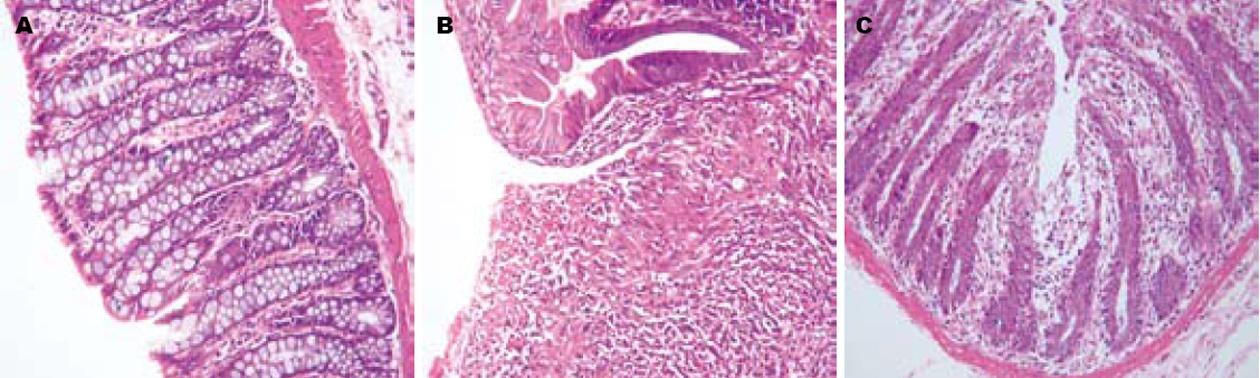
TNBS/乙醇造模后, 组织学检查病变主要位于黏膜及黏膜下层, 以PMN浸润为主, 亦可见数量不等的巨噬细胞和嗜酸性粒细胞, 黏膜糜烂及溃疡形成, 且病变部位腺体排列紊乱. 经过5-ASA治疗后, 糜烂及溃疡灶被肉芽组织及新生的腺上皮组织取代, 局部纤维组织增生, 尚有散在炎性细胞, 以单核细胞及巨噬细胞为主(图1). B组大鼠组织学损伤评分显著高于A组大鼠(P<0.01, t = 12.79), 而C组组织学损伤评分较B组显著降低(P<0.01, t = 7.95, 表1).
先通过标准品绘制出标准曲线, 通过标准曲线计算出各组样本中IL-8的平均浓度, 经统计分析发现: B组血清IL-8的浓度明显高于A组(P<0.01, t = 25.25), 而C组血清IL-8的浓度明显低于B组, 差异极具显著性(P<0.01, t = 12.36, 表2).
B组血PMN凋亡率明显低于A组(P<0.01, t = 12.31), C组凋亡率明显高于B组, 差异极具显著性(P<0.01, t = 9.57), 但较A组低(P<0.01, t = 3.33, 表2).
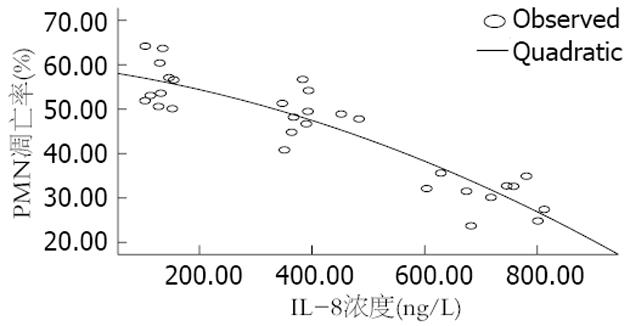
把测得的各大鼠的血清IL-8浓度及其对应的血PMN凋亡率输入SPSS13.0统计软件, 进行Spearman相关分析及曲线估计分析得: Spearman相关系数 = -0.833(P<0.01), 即两者呈高度负相关; 曲线估计分析得回归方程为y = (59.134-0.18x-3×10-5x2)×100 (R2 = 0.827, 图2).
本次实验采用TNBS/乙醇制作IBD大鼠模型, 大鼠造模后的一般表现、结肠大体形态、组织学变化均与人类炎症性肠病的特点相似. C组大鼠经7 d的5-ASA灌肠治疗后症状和体征均有明显好转, 且各项指标(食量变化、体质量变化、表观形态评分、DIA评分、组织学评分)均与生理盐水对照组有显著性好转, 再次证明5-ASA对结肠炎有明显的治疗作用, 而本次研究结果出现5-ASA治疗组上述各种指标与正常对照组有统计学差异, 分析其原因可能是我们此次研究选用的治疗时间太短(仅7 d), 经治疗后病变并没有痊愈所致.
IBD的发病机制迄今还不明确, 目前较多学者趋向于认为IBD的发病机制是由多种因素相互作用, 导致体内免疫系统失调, 细胞因子网络平衡破坏, 大量炎症细胞活化并向炎症部位趋化募集, 释放多种炎症因子, 而引起肠组织的炎症反应[8-9]. 因此, 近年来各种细胞因子、炎症细胞在IBD的发病及治疗中的作用备受关注.
IL-8是一种促炎细胞因子, 主要由单核细胞、内皮细胞、表皮细胞以及T淋巴细胞在IL-1、TNF-α和外源性因子脂多糖的刺激下产生. IL-8又是一种很强的PMN趋化因子, 且能促进PMN的溶酶体酶活性和吞噬作用, 他在PMN介导的组织损伤中起重要作用. 许多研究发现IL-8在IBD的发病及治疗中起着十分重要的作用: Matsuda et al[10]通过实时定量PCR分析发现活动期UC患者肠组织中浸润的IL-8 mRNA表达明显增加; Daig et al[11]发现IBD患者肠黏膜中IL-8升高的程度与局部炎症程度相一致, 这种关系尤其见于有大量PMN浸润形成隐窝脓肿的患者; Braunstein et al[12]通过动物实验发现抗IL-8抗体对IBD具有明显的治疗作用. 本研究也发现结肠炎模型组大鼠血清IL-8浓度显著高于正常对照组, 这与上述研究结果相一致, 同时发现5-ASA治疗组大鼠血清IL-8水平显著低于模型组, 这说明5-ASA能下调结肠炎大鼠血清IL-8水平.
PMN是机体免疫防御系统中的一类重要细胞, 他在血液的非特异性细胞免疫系统中起着十分重要的作用, 他处于机体抵御病原体入侵的第一线, 然而他又是一类主要的急性期炎症细胞, 能产生多种炎性介质, 如前列腺素、白三烯、血栓素、活性氧等介导和放大炎症反应, 且当其解体时能释出溶酶体酶而溶解周围正常组织, 从而引起组织损伤[13-14]. 而当PMN凋亡后被巨噬细胞吞噬、清除, 这样不但能使PMN不释放炎症介质及溶酶体酶, 而且也缩短了PMN介导炎症反应的时间. 大量研究表明: IBD急性期肠固有膜内有大量PMN浸润, PMN在IBD的发生发展中起着重要作用[11], 且有众多研究报道IBD患者血PMN凋亡延迟, PMN凋亡延迟可能是IBD肠组织损伤的重要机制之一[15-16]. 因此促进PMN凋亡能减轻炎症反应强度和时间, 从而达到治疗IBD的目的. 近年来众多研究发现5-ASA对免疫和炎症瀑布过程中的多数环节均有作用. 目前关于5-ASA对免疫细胞的影响方面的研究主要集中于淋巴细胞, 而5-ASA对PMN有无影响尚不清楚. 本研究通过动物实验发现结肠炎模型组大鼠血PMN凋亡率比正常对照组显著降低(P<0.01), 而5-ASA治疗组大鼠凋亡率显著高于结肠炎模型组(P<0.01), 此结果再次验证了"IBD存在血PMN凋亡延迟或减少", 同时证明5-ASA能上调结肠炎大鼠血PMN凋亡率, 从而减轻炎症反应和黏膜损伤.
PMN凋亡受抑制的具体机制尚不明确, 诸多研究认为可能与多种炎性因子表达失调有关[17-18], 尤其与IL-8的关系受到许多学者的关注. Dunican et al[19]通过细胞培养技术发现TNF-α诱导的PMN凋亡延迟是通过IL-8介导的; Leuenroth et al[20]进一步发现IL-8可能通过抑制Fas-FasL的结合而发挥抑制PMN凋亡的作用. 而本次实验也发现血清IL-8水平与血PMN凋亡率呈高度负相关(r = -0.883), 且呈一定的曲线关系, 此结果与文献报道相符, 据此我们推测5-ASA可能通过影响IL-8的表达而影响PMN凋亡. 而IL-8具体通过何种途径抑制血PMN凋亡尚有待进一步研究.
总之, 通过本次研究我们可以推测5-ASA治疗IBD的可能机制为: 一方面能下调IBD患者血及局部肠组织IL-8水平, 从而减少局部PMN浸润和激活, 解除IL-8对PMN凋亡的抑制作用, 从而减轻局部炎症反应强度; 另一方面又可能通过各种其他信号途径直接促进IBD患者血PMN凋亡, 从而减少活化PMN数量, 减少PMN释放炎性介质, 而达到消除炎症减少肠组织损伤的目的.
5-ASA作为一种有效的IBD治疗药物, 已被广泛应用于临床, 但其具体治疗机制尚不明确. 近年来研究发现5-ASA对IBD疾病免疫和炎症瀑布过程中的多数因素均有作用. 本次研究通过观察5-ASA对TNBS结肠炎大鼠血中性粒细胞(PMN)凋亡及血清IL-8水平的影响, 来探讨其治疗机制.
刘占举, 教授, 同济大学附属第十人民医院胃肠内科.
目前关于5-ASA治疗IBD的机制研究主要集中在: (1)对机体免疫系统的影响, 其中又以对淋巴细胞平衡及凋亡和细胞因子网络的影响为热点; (2)对炎症损伤的影响, 其中又以对炎症介质的影响及活性氧族的清除作用为热点. 关于5-ASA对中性粒细胞的影响的研究很少. 目前众多研究只是发现其对免疫和炎症瀑布过程中的众多因素有作用, 而对各因素之间的相互联系及其上下游关系比较模糊, 以致其具体机制尚不明确.
Brannigan et al通过比较IBD患者与癌症患者肠系膜静脉血中性粒细胞凋亡, 发现IBD患者静脉血中性粒细胞凋亡明显受到抑制, 同时发现IBD患者血清IL-8水平显著增高, 而pro-caspase 3表达水平显著降低; Leuenroth et al通过中性粒细胞的体外培养方法, 发现IL-8能抑制中性粒细胞凋亡, 并认为可能是通过影响Fas/FasL途径.
本次研究发现5-ASA能够降低中性粒细胞趋化、活化因子IL-8水平, 能够诱导中性粒细胞凋亡, 从而为5-ASA治疗IBD提供一种可能机制.
疾病活动指数(DAI): 结合患者(患病动物)的体质量下降百分率(体质量不变为0, 1-5为1分, 5-10为2分, 10-15为3分, 大于15为4分)、大便黏稠度(正常为0, 松散的大便为2分, 腹泻为4分)和大便出血(正常0分, 隐血阳性为2分, 显性出血为4分)3种情况进行综合评分, 将3项结果的总分除以3即得到DAI值. 即DAI = (体质量指数+大便形状+出血情况)/3.
本文设计严密, 科学性强, 具有一定的实用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Packey CD, Sartor RB. Interplay of commensal and pathogenic bacteria, genetic mutations, and immunoregulatory defects in the pathogenesis of inflammatory bowel diseases. J Intern Med. 2008;263:597-606. [PubMed] [DOI] |
| 2. | Tirosh O, Levy E, Reifen R. High selenium diet protects against TNBS-induced acute inflammation, mitochondrial dysfunction, and secondary necrosis in rat colon. Nutrition. 2007;23:878-886. [PubMed] [DOI] |
| 3. | Giriş M, Depboylu B, Doğru-Abbasoğlu S, Erbil Y, Olgaç V, Aliş H, Aykaç-Toker G, Uysal M. Effect of taurine on oxidative stress and apoptosis-related protein expression in trinitrobenzene sulphonic acid-induced colitis. Clin Exp Immunol. 2008;152:102-110. [PubMed] |
| 4. | Luk HH, Ko JK, Fung HS, Cho CH. Delineation of the protective action of zinc sulfate on ulcerative colitis in rats. Eur J Pharmacol. 2002;443:197-204. [PubMed] [DOI] |
| 5. | Fedorak RN, Empey LR, MacArthur C, Jewell LD. Misoprostol provides a colonic mucosal protective effect during acetic acid-induced colitis in rats. Gastroenterology. 1990;98:615-625. [PubMed] |
| 8. | Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho JK. Role of cytokines in inflammatory bowel disease. World J Gastroenterol. 2008;14:4280-4288. [PubMed] [DOI] |
| 9. | Claesson MH, Nicoletti F, Stosic-Grujicic S, Doria A, Zampieri S. Interactions between infections and immune-inflammatory cells in type 1 diabetes mellitus and inflammatory bowel diseases: evidences from animal models. Clin Exp Rheumatol. 2008;26:S8-S11. [PubMed] |
| 10. | Matsuda R, Koide T, Tokoro C, Yamamoto T, Godai T, Morohashi T, Fujita Y, Takahashi D, Kawana I, Suzuki S. Quantitive cytokine mRNA expression profiles in the colonic mucosa of patients with steroid naïve ulcerative colitis during active and quiescent disease. Inflamm Bowel Dis. 2009;15:328-334. [PubMed] [DOI] |
| 11. | Daig R, Andus T, Aschenbrenner E, Falk W, Schölmerich J, Gross V. Increased interleukin 8 expression in the colon mucosa of patients with inflammatory bowel disease. Gut. 1996;38:216-222. [PubMed] [DOI] |
| 12. | Braunstein J, Qiao L, Autschbach F, Schürmann G, Meuer S. T cells of the human intestinal lamina propria are high producers of interleukin-10. Gut. 1997;41:215-220. [PubMed] |
| 13. | Bredeţean O, Ciochină AD, Mungiu OC. [The neutrophil in human pathology]. Rev Med Chir Soc Med Nat Iasi. 2007;111:446-453. [PubMed] |
| 14. | Kantarci A, Van Dyke TE. Neutrophil-mediated host response to Porphyromonas gingivalis. J Int Acad Periodontol. 2002;4:119-125. [PubMed] |
| 15. | Brannigan AE, O'Connell PR, Hurley H, O'Neill A, Brady HR, Fitzpatrick JM, Watson RW. Neutrophil apoptosis is delayed in patients with inflammatory bowel disease. Shock. 2000;13:361-366. [PubMed] |
| 16. | Ina K, Kusugami K, Hosokawa T, Imada A, Shimizu T, Yamaguchi T, Ohsuga M, Kyokane K, Sakai T, Nishio Y. Increased mucosal production of granulocyte colony-stimulating factor is related to a delay in neutrophil apoptosis in Inflammatory Bowel disease. J Gastroenterol Hepatol. 1999;14:46-53. [PubMed] [DOI] |
| 17. | Cross A, Moots RJ, Edwards SW. The dual effects of TNFalpha on neutrophil apoptosis are mediated via differential effects on expression of Mcl-1 and Bfl-1. Blood. 2008;111:878-884. [PubMed] [DOI] |
| 18. | McNamee JP, Bellier PV, Kutzner BC, Wilkins RC. Effect of pro-inflammatory cytokines on spontaneous apoptosis in leukocyte sub-sets within a whole blood culture. Cytokine. 2005;31:161-167. [PubMed] [DOI] |