修回日期: 2009-03-06
接受日期: 2009-03-09
在线出版日期: 2009-04-28
目的: 研究Cortactin对大肠癌细胞运动性和侵袭力的影响.
方法: HT-29细胞常规培养, 在体外合成Cortactin siRNA后转染结肠癌细胞, 通过Western blot和免疫荧光观察转染后Cortactin表达量变化, 通过癌细胞体外迁移侵袭实验和伸展实验来观察转染后癌细胞伸展、迁移和侵袭能力的改变.
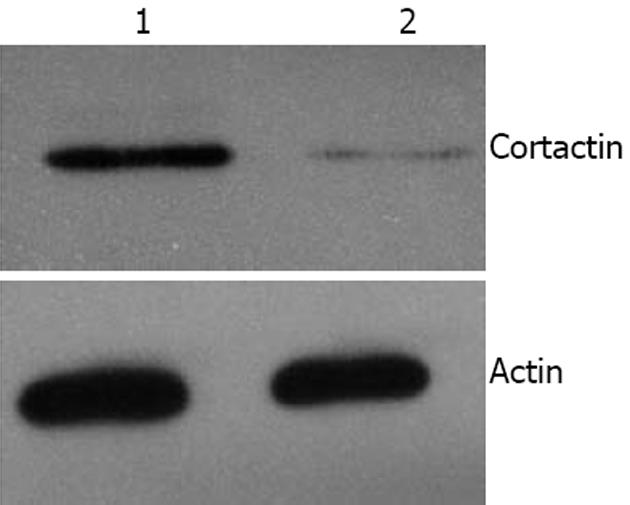
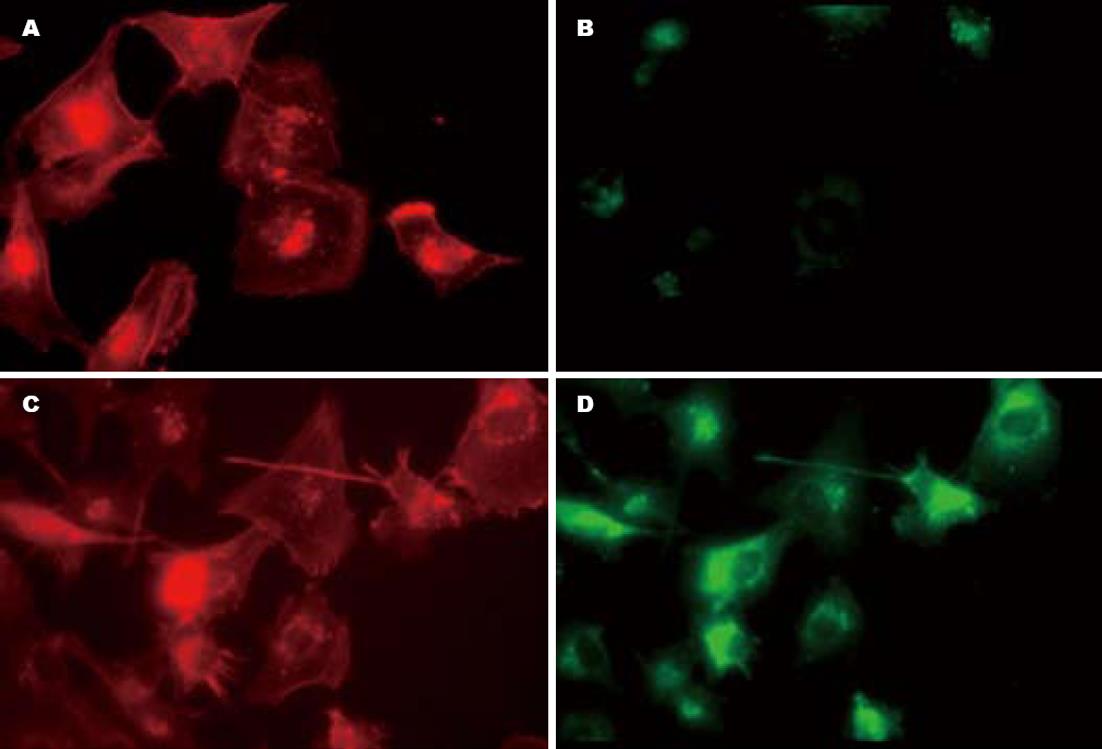
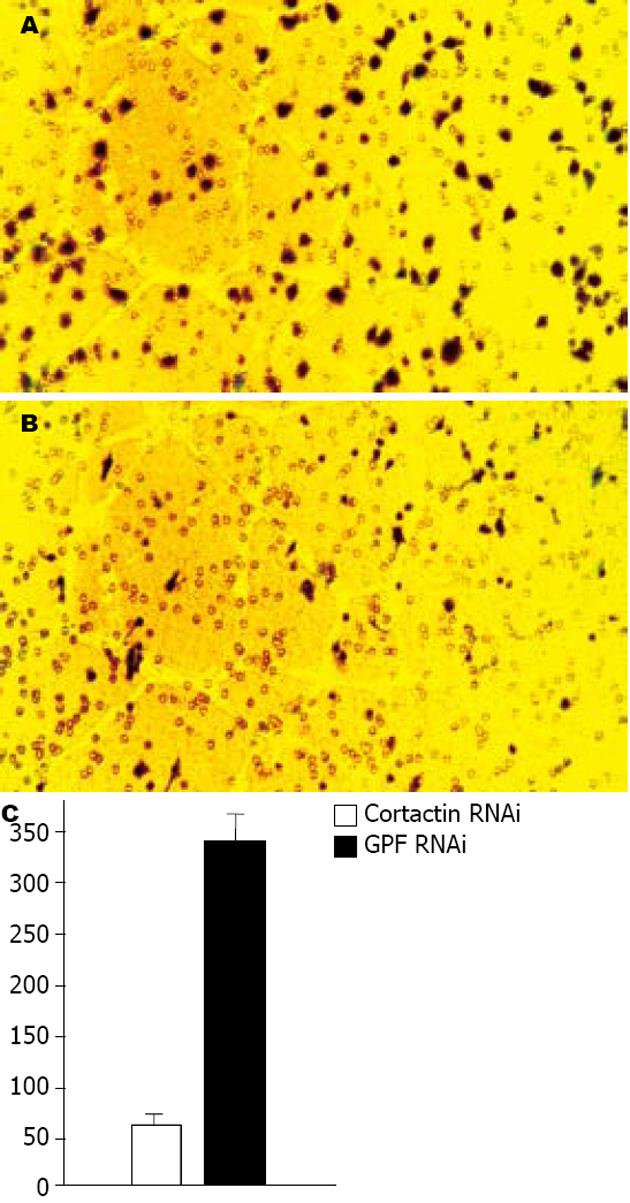
结果: Western blot和免疫荧光显示Cortactin在siRNA处理后癌细胞内的表达水平明显下降; 癌细胞经过Cortactin siRNA处理后细胞的胞膜展开比对照组晚; Cortactin siRNA处理的大肠癌细胞和对照GFP siRNA处理的癌细胞通过涂胶基膜和微孔的细胞数目统计分别为60±15个和340±45个, 两者差异有统计学意义(P<0.01).
结论: Cortactin可能对大肠癌的侵袭转移发挥作用.
引文著录: 朱建伟, 赵任. 沉默Cortactin表达对大肠癌细胞伸展、迁移和侵袭的抑制. 世界华人消化杂志 2009; 17(12): 1197-1201
Revised: March 6, 2009
Accepted: March 9, 2009
Published online: April 28, 2009
AIM: To examine the role of Cortactin in motility and invasive ability of human colon cancer cells.
METHODS: HT-29 colon cancer cells were cultured and treated with Cortactin siRNA. After treatment, the expression level of Cortactin was detected by western blot assay and the expression in cells was assayed under confocal. For test, cells were seeded in 6-well plates and the spreading of cancers was observed. Furthermore, cells were seeded into chambers coated with collagen, and the migration and invasiveness were examined by counting the cells passing through the mini pores on chamber.
RESULTS: Cortactin in cancer cells were knocked down dramatically. The cancer cells treated with Cortactin siRNA demonstrated a postponed spreading, less migration and attenuated invasive ability, compared with cancer cells treated with GFP siRNA. After Cortactin RNAi, the cells that passed through mini-pores was 60 ± 15, while it was 340 ± 45 in the control group (P < 0.01).
CONCLUSION: Cortactin might play an important role in invasion and metastasis of colon cancer.
- Citation: Zhu JW, Zhao R. Inhibition of spreading, migration and invasion of colon cancer cells by Cortactin small RNA interference. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1197-1201
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1197.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1197
肿瘤细胞的活动性(motility)是肿瘤发生侵袭、转移的必需条件, 这个过程需要肌动蛋白细胞骨架的参与. Cortactin蛋白是肌动蛋白相关蛋白复合物ARP2/3的激活因子, 也是丝状肌动蛋白的结合蛋白. Cortactin蛋白是由CTTN基因(以前被称为EMS1)编码, 该基因位于染色体11q13, 这个区域在很多肿瘤, 包括头和颈部肿瘤、卵巢、乳腺、肝和肺等肿瘤组织中存在扩增. 研究表明, Cortactin基因的扩增以及mRNA的表达增加都与肿瘤的转移和不良预后相关. 有学者对转移相关的39种基因包括CTTN在高转移性和低转移性肝癌细胞中表达程度做比较显示, Cortactin在低转移性肝癌细胞中过分表达能使癌细胞转移能力提高, 促进转移灶的形成. 先前研究表明[1-4], Cortactin蛋白的过表达无论是在变异细胞系还是在肿瘤细胞中, 都能导致细胞的迁移和转移能力增加. 我们对这一基因已有深入的研究, 首次发现Cortactin在癌细胞的内吞运动中发挥的调节作用[5-6]. 由于目前还没有Cortactin与大肠癌细胞的运动性和侵袭力关系的研究报道, 本实验首次采用siRNA技术, 选择性的沉默大肠癌细胞中CTTN基因来降低Cortactin蛋白的表达, 观察癌细胞在伸展能力、迁移和侵袭能力的改变, 从一个方面来观察Cortactin对大肠癌进展的影响.
Cortactin mAb 4F11购自美国Upstate公司, actin抗体购自Sigma公司, 荧光素标记的二抗和actin标志物鬼笔环肽购自Sigma公司. Western blot试剂购自Sigma公司. 细胞迁移用培养小室购自BD公司. 细胞培养和基因转染试剂购自美国Life technologies公司. siRNA构建试剂盒购自美国Ambion公司.
1.2.1 细胞培养: 大肠癌细胞株HT-29源自美国ATCC, 细胞以DMEM培养液在37℃ 50 mL/L CO2条件下传代培养.
1.2.2 人Cortactin siRNA的设计、合成和细胞处理: 在GenBank中获取人Cortactin cDNA序列, 编号为BC008799, Cortactin siRNA的目标序列为: AAG TAT GGG GTG CAG AAG GAT. siRNA的合成依据试剂盒说明采用T7 RNA聚合酶体外转录合成. 同时, 以人体细胞不存在的绿色荧光蛋白(GFP)为靶标, 设计GFP siRNA作为对照. 细胞以0.8×105的密度接种在6孔板上隔夜培养, 按照转导试剂Lipofectamine的使用说明以50 μmol/L的siRNA处理细胞, 并继续培养24 h. 收获并裂解细胞做Western blot分析观察Cortactin的表达水平.
1.2.3 Western blot分析和共聚焦显微镜观察: 作Western blot分析时, 将细胞以SDS蛋白裂解液裂解, 以100 g/L SDS-PAGE电泳做蛋白分离, 并转移至硝酸纤维膜上. 纤维膜洗涤并加入Cortactin抗体室温1 h摇动孵育, 洗去一抗, 加HRP标记的二抗室温孵育30 min, 洗涤并加化学发光试剂ECL显影. 作共聚焦显微镜检测时, 细胞在置入盖玻片的6孔板中培养过夜, 玻片在PBS中洗涤并以40 g/L的多聚甲醛固定, 作通透后滴加Cortactin一抗, 室温2 h, PBS洗涤并滴加FITC标记的二抗和鬼笔环肽, 室温30 min, 洗涤封片并在共聚焦显微镜下作观察.
1.2.4 癌细胞的伸展能力观察: 将单细胞悬液接种在6孔板中, 接种密度为1×105, 接种后10、20和30 min在相差显微镜下观察细胞贴壁延展的情况, 并作比较.
1.2.5 癌细胞的迁移侵袭能力实验: 癌细胞以单细胞悬液接种在涂有胶原的底膜并带有8 μm小孔的培养小室, 接种密度0.5×105, 加入含有100 mL/L小牛血清的DMEM培养液, 在37度50 mL/L CO2条件下培养6 h, 将膜上细胞用棉签拭去, 底膜剪下并在750 mL/L乙醇中固定30 min, 作苏木素染色并计数.
癌细胞经过siRNA处理后做Western blot分析以观察Cortactin水平的改变. 如图1所示, 与对照GFP siRNA处理的细胞比较, Cortactin的表达水平明显下降, 表现为Cortactin蛋白条带的密度明显变浅. 为进一步观察细胞内Cortactin水平在RNA干扰后的变化, 我们采用免疫荧光染色的方法观察大肠癌细胞内Cortactin的表达, 如图2所示, Cortactin siRNA处理的细胞胞质内Cortactin(绿色荧光)的荧光强度与对照相比明显减弱. 而肌动蛋白荧光染色强度没有改变, 提示Cortactin的RNA干扰对肌动蛋白的表达不发生影响.
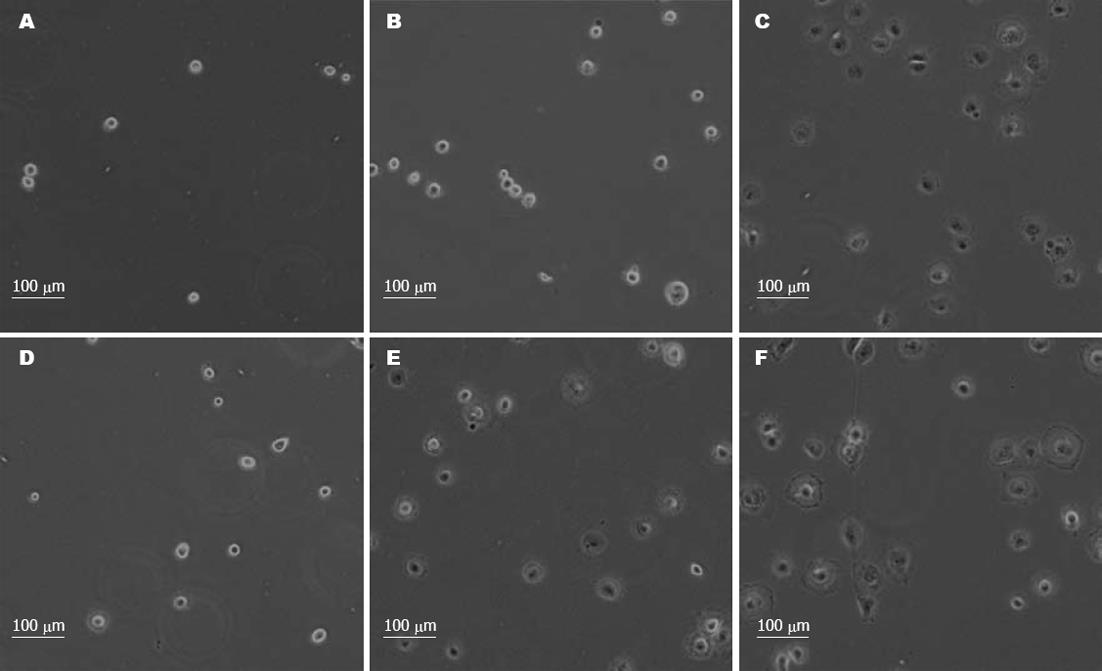
我们进一步观察大肠癌细胞的贴壁伸展情况. 将癌细胞接种后在相差显微镜下观察短时间之内癌细胞的胞膜伸展. 在图3中可见, 对照GFP siRNA处理的癌细胞伸展良好, 而Cortactin siRNA处理的细胞伸展缓慢, 接种20 min后细胞还是呈收缩状态, 而对照组细胞已经有明显的胞膜展开. 研究提示癌细胞的运动性在Cortactin表达抑制的情况下减弱.
癌细胞以单细胞悬液接种在底膜带有8 μm小孔的培养小室(底膜涂有胶原), 接种密度0.5×105, 加入含有100 mL/L小牛血清的DMEM培养液, 在37度50 mL/L CO2条件下培养6 h, 将膜上细胞用棉签拭去, 底膜剪下并在750 mL/L乙醇中固定30 min, 作苏木素染色并计数, 比较穿过微孔的癌细胞数目. 如图4所示, Cortactin siRNA处理的大肠癌细胞穿过底膜微孔的数目与对照组比较明显减少. 综合三次重复实验(每次6孔), Cortactin siRNA处理组穿越细胞数为60±15个, 对照GFP siRNA处理组为340±45个, 差异有显著统计学意义(P<0.01). 由于小室底面涂胶, 癌细胞需要突破人工基膜并穿越微孔方能到达另一面, 该实验方法常用来观察癌细胞的侵袭能力, 从实验得到的结果看, Cortactin siRNA处理后, 癌细胞的侵袭力明显受到抑制.
细胞的运动性与细胞皮层肌动蛋白的动态组装有着直接关系. 在电镜下观察动物细胞, 细胞膜下存在着一层0.2-0.5 μm厚的透明区域, 称为细胞皮层或称为表层胞质溶胶. 他是一层主要由肌动蛋白微丝相互交联构成的、与质膜紧密相连的三维立体网络结构. 细胞皮层的肌动蛋白网络结构比较致密, 孔径仅有0.6 nm, 所有细胞器和大分子物质都不能进入[7]. 在大部分类型的细胞中, 细胞皮层及其相连的质膜构成了细胞中最为活跃的结构, 不断进行着细胞骨架的重组和小分子介导的细胞信号的传递. 细胞运动以及其他许多重要的细胞生理活动, 如细胞形状的维持或改变、细胞黏附、胞吞、胞质分裂、跨膜蛋白质的组织以及细胞表面张力的形成等, 都是皮层肌动蛋白细胞骨架动态变化的结果. 近年来, 细胞运动分子机制的研究取得了长足进展, Cortactin在细胞皮层肌动蛋白组织、细胞信号转导中的调控以及在细胞迁移、细胞形变等许多方面所扮演的重要角色也逐渐被人们所认识.
Cortactin的突变能够直接引起细胞运动状态和细胞形态的改变. 在小鼠和人的体外培养细胞中, Cortactin基因的突变导致微丝组装活动的减弱, 带来细胞运动受阻. 过量表达Cortactin蛋白的NIH3T3成纤维细胞则表现出显著的细胞形态变化: 细胞变圆, 发生堆叠, 细胞运动性也显著增强. Cortactin蛋白的过量表达还能引起乳腺肿瘤细胞转移的增强. 在诱发乳腺肿瘤的裸鼠中过量表达Cortactin蛋白导致肿瘤细胞的骨转移率提高了85%[8].
亚细胞定位和生化分析表明, Cortactin蛋白在皮层肌动蛋白的组装和组织上具有重要作用[9]. 在体外培养细胞中, Cortactin蛋白主要分布在发生活跃组装的细胞皮层区域, 例如运动细胞的前导缘、丝状伪足以及细胞膜皱褶中. Cortactin蛋白在细胞皮层的定位和功能的发挥是他与皮层肌动蛋白微丝交联以及与ARP2/3复合物作用的结果. 如果Cortactin蛋白的NTF结构域或重复序列结构域发生了突变, 便不能再定位于细胞皮层, 也失去了结合Arp2/3复合物的能力. 降解肌动蛋白的细胞松弛素D, 能够导致Cortactin从皮层微丝网络解离, 这也表明Cortactin在细胞皮层的定位与肌动蛋白的作用相关.
RNA干涉是生物体内的一种通过双链RNA(double-stranded RNA, dsRNA)来抵抗病毒入侵和抑制转座子活动的自然机制. 近来研究发现, 21-25 nt大小的siRNA可在哺乳动物细胞中介导高度序列特异性的基因沉默, 并且具有高效性和序列特异性, 已经成为功能基因组研究的有力工具, 并且有可能在某些疾病如肿瘤等的基因治疗中发挥重要作用[10-13]. Cortactin siRNA的设计是通过对转录本(mRNA), 从AUG密码子开始寻找"AA"二连序列, 并记录下3'端的19个碱基序列(5'-AATGATGTGAGTGAGAAGGAG-3')作为siRNA的潜在靶位点. 为了阴性对照将序列5'-GUUUCGAGGACUACUACAUUU-3'作为正义链, 5'-AUGUAGUAGUCCUCGAAACUU-3'作为反义链. 合成的siRNA整合进RNA诱导的沉默复合体中, 进而酶切特异性mRNA, 导致ETTN基因的沉默, 从而使细胞Cortactin蛋白的表达量下降. 本研究中, 我们设计合成的Cortactin siRNA能有效抑制大肠癌细胞Cortactin的表达, 进一步的实验首次发现, 大肠癌细胞中Cortactin表达受到抑制后癌细胞的运动性包括细胞伸展、细胞迁移能力受到抑制. 通过侵袭模型发现, 大肠癌细胞的侵袭能力也因Cortactin的水平下调而降低. 由于癌细胞的运动性和侵袭能力与肿瘤的发展密切相关, 从本研究可以推论, Cortactin在大肠癌的侵袭转移等进展过程中发挥重要的作用. 事实上, 在我们过去的研究中已经发现, Cortactin在癌细胞的内吞活动中发挥重要作用, 而内吞作用与癌细胞的侵袭有重要联系[5-6], 结合本研究的结果, 我们推测, 癌基因src的下游信号分子Cortactin在大肠癌等肿瘤的进展中存在特殊的功能, 值得进一步探索.
尽管Cortactin蛋白在影响癌细胞的运动性和侵袭性的详细机制不完全清楚, 通过本实验不难看出, 降低Cortactin蛋白在大肠癌细胞中的表达能降低大肠癌细胞的运动性和侵袭能力. 这个结果也提示Cortactin蛋白可以作为一个新的指标来判定大肠癌细胞的转移能力, 并在大肠癌的治疗中, Cortactin蛋白也可能成为一个新的治疗靶点.
Cortactin蛋白的过表达无论是在变异细胞系还是在肿瘤细胞中, 都能导致细胞的迁移和转移能力增加. 本实验首次采用siRNA技术, 选择性的沉默大肠癌细胞中CTTN基因来降低Cortactin蛋白的表达, 观察癌细胞在伸展能力、迁移和侵袭能力的改变, 从一个方面来观察Cortactin对大肠癌进展的影响.
王正康, 教授, 北京中日友好医院普外科
Cortactin参与肌动蛋白的聚合, 同时他又是癌基因Src的底物, Cortactin在乳腺癌等肿瘤组织中存在基因扩增, 但与消化系肿瘤的关系尚不清楚.
有研究表明, Cortactin在大肠癌组织中表达增高, 但迄今为止, Cortactin与大肠癌细胞运动特性的关系尚未见报道.
本课题采用RNA干扰的方法, 抑制大肠癌细胞中Cortactin的表达, 观察该蛋白降低后癌细胞的运动性的变化.
本文为一初步研究, 但内容较新, 提供了该领域的最新信息, 有一定的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Weaver AM. Cortactin in tumor invasiveness. Cancer Lett. 2008;265:157-166. [PubMed] [DOI] |
| 2. | Buday L, Downward J. Roles of cortactin in tumor pathogenesis. Biochim Biophys Acta. 2007;1775:263-273. [PubMed] |
| 3. | Luo ML, Shen XM, Zhang Y, Wei F, Xu X, Cai Y, Zhang X, Sun YT, Zhan QM, Wu M. Amplification and overexpression of CTTN (EMS1) contribute to the metastasis of esophageal squamous cell carcinoma by promoting cell migration and anoikis resistance. Cancer Res. 2006;66:11690-11699. [PubMed] [DOI] |
| 4. | van Rossum AG, Moolenaar WH, Schuuring E. Cortactin affects cell migration by regulating intercellular adhesion and cell spreading. Exp Cell Res. 2006;312:1658-1670. [PubMed] [DOI] |
| 5. | Zhu J, Zhou K, Hao JJ, Liu J, Smith N, Zhan X. Regulation of cortactin/dynamin interaction by actin polymerization during the fission of clathrin-coated pits. J Cell Sci. 2005;118:807-817. [PubMed] [DOI] |
| 6. | Zhu J, Yu D, Zeng XC, Zhou K, Zhan X. Receptor-mediated endocytosis involves tyrosine phosphorylation of cortactin. J Biol Chem. 2007;282:16086-16094. [PubMed] [DOI] |
| 7. | Welch MD, Mullins RD. Cellular control of actin nucleation. Annu Rev Cell Dev Biol. 2002;18:247-288. [PubMed] [DOI] |
| 8. | Li Y, Tondravi M, Liu J, Smith E, Haudenschild CC, Kaczmarek M, Zhan X. Cortactin potentiates bone metastasis of breast cancer cells. Cancer Res. 2001;61:6906-6911. [PubMed] |
| 9. | Uruno T, Liu J, Zhang P, Fan YX, Egile C, Li R, Mueller SC, Zhan X. Activation of Arp2/3 complex-mediated actin polymerization by cortactin. Nat Cell Biol. 2001;3:259-266. [PubMed] [DOI] |
| 10. | Schiffelers RM, Ansari A, Xu J, Zhou Q, Tang Q, Storm G, Molema G, Lu PY, Scaria PV, Woodle MC. Cancer siRNA therapy by tumor selective delivery with ligand-targeted sterically stabilized nanoparticle. Nucleic Acids Res. 2004;32:e149. [PubMed] [DOI] |
| 11. | Fan Y, Zhang YL, Wu Y, Zhang W, Wang YH, Cheng ZM, Li H. Inhibition of signal transducer and activator of transcription 3 expression by RNA interference suppresses invasion through inducing anoikis in human colon cancer cells. World J Gastroenterol. 2008;14:428-434. [PubMed] [DOI] |
| 12. | Li TJ, Song JN, Kang K, Tong SS, Hu ZL, He TC, Zhang BQ, Zhang CQ. RNA interference-mediated gene silencing of vascular endothelial growth factor in colon cancer cells. World J Gastroenterol. 2007;13:5312-5316. [PubMed] |
| 13. | Zhang SQ, Du QY, Ying Y, Ji ZZ, Wang SQ. Polymerase synthesis and potential interference of a small-interfering RNA targeting hPim-2. World J Gastroenterol. 2004;10:2657-2660. [PubMed] |