修回日期: 2009-03-26
接受日期: 2009-03-30
在线出版日期: 2009-04-28
目的: 观察D-氨基半乳糖(D-GalN)联合脂多糖(LPS)诱导的小鼠急性肝衰竭TNF-α、Caspase-3、TGF-β1 mRNA的表达, 并探讨罗格列酮的干预作用.
方法: ♂昆明小鼠随机分为3组: 正常组、对照组、干预组. 对照组和干预组以D-GalN/LPS腹腔注射构建小鼠急性肝衰竭模型, 正常组则相应予以生理盐水腹腔注射; 干预组于造模前2 h予以罗格列酮灌胃, 正常组和对照组则相应予以生理盐水灌胃. 比较各组小鼠血清丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平, 肝组织病变程度及肝组织TNF-α、Caspase-3, TGF-β1 mRNA的表达水平.
结果: D-GalN联合LPS腹腔注射成功构建了小鼠急性肝衰竭模型, 对照组肝组织中TNF-α、Caspase-3、TGF-β1 mRNA的表达较正常组明显增高(P<0.001); 干预组小鼠血清ALT, AST水平明显低于对照组(403.6±76.1 U/L vs 3664.8±646.1 U/L, 464.6±63.0 U/L vs 3514.0±468.9 U/L, 均P<0.001), 肝组织中TNF-α、Caspase-3、TGF-β1 mRNA表达水平明显低于对照组(0.270±0.042 vs 0.459±0.072, 0.388±0.033 vs 0.553±0.033, 0.261±0.031 vs 0.403±0.042, 均P<0.001); 与对照组比较, 干预组肝组织炎性细胞浸润明显减少, 肝细胞以变性为主, 未见明显坏死.
结论: 罗格列酮可能通过下调TNF-α、Caspase-3、TGF-β1的表达对D-GalN/LPS小鼠急性肝衰竭起保护作用.
引文著录: 陈海鸥, 傅爱. 急性肝衰竭TNF-α、Caspase-3及TGF-β1 mRNA的表达及罗格列酮的干预. 世界华人消化杂志 2009; 17(12): 1185-1189
Revised: March 26, 2009
Accepted: March 30, 2009
Published online: April 28, 2009
AIM: To observe the levels of TNF-α, Caspase-3 and TGF-β1 mRNA on the acute hepatic failure induced by D-GalN and LPS, and to observe efficacy of rosiglitazone intervention.
METHODS: Male mice were divided into three groups randomly: the normal group, the control group and the intervention group. The control group and the intervention group were injected with D-GalN/LPS, while the normal group was injected with saline; the intervention group was lavaged by rosiglitazone at 2 h before the D-GalN/LPS injection, while the control group and the normal group were lavaged with saline. Serum levels of ALT, AST, the histopathological changes of liver and the levels of TNF-α, Caspase-3 and TGF-β1 mRNA of the liver were observed.
RESULTS: We succeeded in establishing the acute hepatic failure model by intraperitoneal injection of D-GalN combined with LPS. The levels of TNF-α, TGF-β1 and Caspase-3 mRNA of the liver in the control group were significantly higher than the normal group (P < 0.001). The serum levels of ALT, AST in the intervention group were significantly lower than the control group (403.6 ± 76.1 U/L vs 3664.8 ± 646.1 U/L, 464.6 ± 63.0 U/L vs 3514.0 ± 468.9 U/L, both P < 0.001). The degree of liver injury in the intervention group was significantly reduced than the control group. The levels of TNF-α, Caspase-3 and TGF-β1 mRNA in the hepatic tissue of the intervention group were significantly lower than the control group (0.270 ± 0.042 vs 0.459 ± 0.072, 0.388 ± 0.033 vs 0.553 ± 0.033, 0.261 ± 0.031 vs 0.403 ± 0.042, all P < 0.001).
CONCLUSION: Rosiglitazone plays an effectively protective role in the acute hepatic failure of mice, possibly through down-regulation of the expression of TNF-α, TGF-β1 and Caspase-3.
- Citation: Chen HO, Fu A. Expression of TNF-α, Caspase-3 and TGF-β1 mRNA in acute hepatic failure and rosiglitazone intervention. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1185-1189
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1185.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1185
急性肝衰竭(acute hepatic failure, AHF)是由多种因素引起的肝细胞严重损害, 导致肝脏合成、代谢、转运和排泄等功能发生严重障碍, 继而出现以严重消化系症状、极度乏力、深度黄疸、凝血功能障碍、肝性脑病和腹水等为主要表现的临床综合征, 最终可出现多器官功能衰竭和死亡. AHF来势凶猛, 发展迅速, 预后差, 是严重危害人类健康的一种疾病, 其发病机制复杂, 至今尚未完全阐明. 本研究拟通过D-氨基半乳糖(D-GalN)联合脂多糖(lipopolysaccharide, LPS)腹腔注射构建小鼠AHF模型, 以罗格列酮干预, 观察血清转氨酶、肝组织病理学以及肝组织中TNF-α、Caspase-3和TGF-β1 mRNA的表达水平, 探讨AHF的可能发病机制及罗格列酮对AHF的干预作用及可能机制.
LPS购自美国Sigma公司, D-GalN购自重庆医科大学生物医学工程研究室, 罗格列酮片购自葛兰素-史克制药公司, 逆转录试剂盒购自美国Ferments公司, 总RNA分离试剂盒购自美国MRC公司. TNF-α引物上游为5'-GGTGCCTATGTCTCAGCCTCTT-3', 下游为5'-GCTCCTCCACTTGGTGGTTT-3', 扩增片段长度为225 bp; Caspase-3引物上游为5'-GGAGAAATTCAAAGGACGG-3', 下游为5'-AACAAAACAGAAACACGCCC-3', 扩增片段长度为271 bp; TGF-β1引物上游为5'-GGACCGCAACAACGCCATCTA-3', 下游为5'-AAAGCCCTGTATTCCGTCTCCT-3', 扩增片段长度为310 bp; GAPDH引物上游为: 5'-ACCACAGTCCATGACATCAC-3', 下游为5'-TCCACCACCCTGTTGCTGTA-3', 扩增片段长度为452 bp. 各引物均由上海生工生物工程公司合成.
1.2.1 分组与药物干预: 据预实验结果以D-GalN 600 mg/kg联合LPS 10 μg/kg腹腔注射构建小鼠AHF模型, 以罗格列酮20 mg/kg为干预剂量. ♂昆明小鼠60只, 随机分为正常组、对照组、干预组, 每组20只. 对照组和干预组均给予D-GalN 600 mg/kg联合LPS 10 μg/kg ip构建AHF模型, 干预组于造模前2 h以罗格列酮20 mg/kg ig, 对照组则以生理盐水ig; 正常组均在各相应时间点以生理盐水ig、ip. 造模后6 h, 各组随机选择5只小鼠去眼球采血检测血清转氨酶, 再随机选择5只小鼠断颈处死, 取肝组织提取总RNA行RT-PCR及HE染色.
1.2.2 RT-PCR检测肝组织中TNF-α、Caspase-3和TGF-β1 mRNA的表达: 将肝组织匀浆后, 按TRIzol说明书抽提总RNA, 取RNA于42℃逆转录, 将逆转录产物用于PCR扩增. 反应条件: 94℃ 5 min, (94℃ 30 s, 55℃ 30 s, 72℃ 60 s)30个循环, 72℃ 10 min. 取PCR反应产物5 μL进行20 g/L琼脂糖凝胶电泳, 鉴定产物, 应用上海天能科技有限公司凝胶成像分析系统进行半定量分析. 以GAPDH与各目的片段的吸光度比值确定其表达水平.
统计学处理 计数资料采用mean±SD表示, 各组间比较采用方差分析. 采用SPSS13.0统计软件包进行统计学处理, P<0.05认为差异有显著性.
对照组ALT和AST水平均显著高于正常组(P<0.05), 而干预组ALT和AST水平较对照组显著降低(P<0.05, 表1).
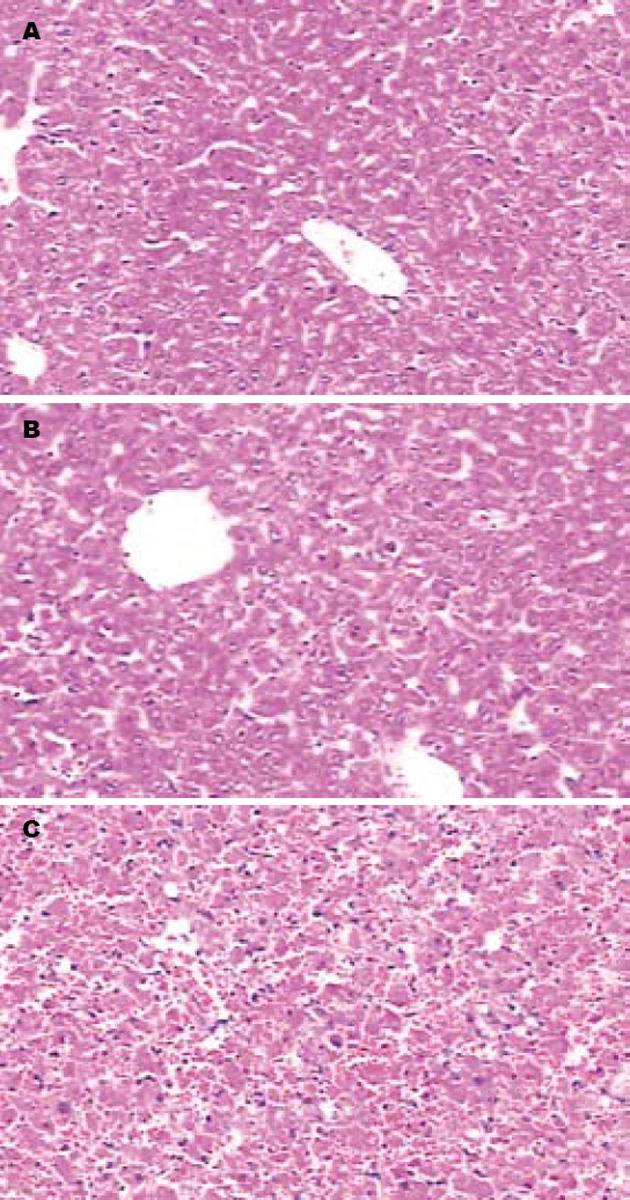
正常组: 肝小叶结构清晰, 肝细胞未见炎性病变及坏死, 汇管区无炎性细胞浸润. 对照组: 肝组织失去正常肝小叶结构, 肝索解离, 大面积肝组织溶解, 肝细胞弥漫性坏死, 见大量嗜酸性坏死, 嗜酸性小体形成和炎性细胞浸润, 肝窦内可见红细胞淤积. 干预组: 肝组织结构正常, 以广泛肝细胞变性为主, 坏死较少, 炎性细胞浸润明显减少, 偶见双核及嗜酸样病变, 肝细胞损伤程度较对照组明显减轻(图1).
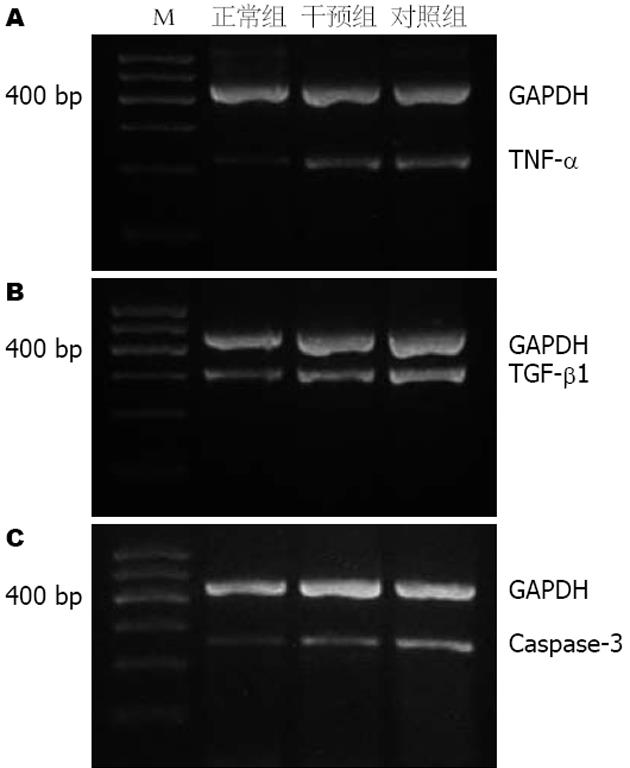
正常组肝组织中TNF-α、Caspase-3和TGF-β1 mRNA的表达比较低, 对照组的表达水平显著升高(P<0.05), 而予以罗格列酮干预后, 干预组TNF-α、Caspase-3和TGF-β1 mRNA的表达水平显著低于对照组(P<0.05, 图2, 表2).
AHF来势凶猛, 发展迅速, 预后差, 是严重危害人类健康的一种疾病. 长久以来, 人们一直致力于寻找一种能够用于研究AHF致病机制和检验疗效的理想动物模型. D-GalN是一种氨基糖选择性肝毒性药物, 在肝脏通过半乳糖途径代谢, 消耗该途径的中间产物二磷酸尿嘧啶核苷, 进而抑制尿嘧啶核苷的代谢, 导致RNA核蛋白质合成受阻, 引起肝细胞损伤, 继之是胞外的Ca2+流入胞内, 加重肝损害[1]. LPS是G-菌外膜层的主要成分, G-菌所致的机体损伤主要是由LPS介导. Uesugi et al[2]研究表明LPS不仅可以加重肝硬化、酒精性肝损害, LPS本身也能导致肝损伤. 另外, D-GalN促使肥大细胞脱颗粒释放组胺, 造成结肠水肿, 使肠源性内毒素吸收增加, 增强对LPS的敏感性及肝脏损伤特异性[3], 而这种特性与AHF时肝脏损伤的机制相似. 综合相关文献, 多数学者认为D-GalN联合LPS腹腔注射诱导的AHF模型是AHF的良好模型, 可用于对AHF的机制研究、治疗药物评价筛选. 本实验采用D-GalN 600 mg/kg联合LPS 10 μg/kg腹腔注射构建的AHF模型, 符合国际上通用的急性肝衰动物模型的标准[4], 经生化检测小鼠血清转氨酶ALT和AST水平显著增高; HE染色见大面积肝组织溶解, 肝细胞弥漫性坏死, 以上与AHF特征相符, 为后续研究的开展奠定良好基础.
TNF-α是一种主要由单核巨噬细胞产生的具有广谱生理和病理效应的细胞因子. TNF-α一方面参与机体的免疫防御机能, 选择性杀伤肿瘤细胞, 另一方面介导休克、炎症反应、组织损伤等病理生理反应[5]. 既往研究表明, TNF-α对肝细胞有直接损伤作用, 其通过与肝细胞膜上的TNF受体结合而导致一系列信号传导途径最终激活细胞内多种非溶酶体性脱氧核糖核酸内切酶, 将肝细胞双链基因组DNA切割成寡脱氧核苷酸片段, 从而引起肝细胞的死亡. TNF-α除有直接的肝细胞毒性外, 还可激活肝内皮细胞和肝细胞转录因子, 使炎性基因表达, 诱发炎性细胞对肝细胞的损伤, 引起肝细胞坏死; 上调中性粒细胞表面黏附因子CD11b/CD18的表达, 使中性粒细胞或Kupffer细胞释放炎性介质, 引起白细胞在炎症部位聚集并引起组织的免疫损伤. 而Nguyen et al[6]研究表明TNF-α与肝细胞凋亡也有着非常密切的联系, 且TNF-α诱导肝细胞异常凋亡在AHF过程中起着重要作用. 有学者认为TNF-α是AHF动物模型中诱发肝细胞凋亡关键的细胞因子之一. TNF-α与肝细胞膜上其受体TNF-R1结合而诱发肝细胞凋亡是内毒素性肝衰竭模型的重要病理机制[7], 预先使用抗TNF-α IgG可完全阻断LPS诱导的小鼠肝细胞凋亡和坏死. 我们的研究发现正常组小鼠肝组织仅有少量TNF-α mRNA的表达, 对照组TNF-α mRNA的表达较正常组显著增加, 说明TNF-α与肝细胞炎症坏死有着非常密切的关系, D-GalN/LPS可能通过上调TNF-α的表达而导致肝细胞炎症坏死乃至AHF.
大量的实验已证实在AHF中, 除了炎症坏死这一死亡形式外, 也存在着细胞凋亡. 目前认为凋亡是蛋白酶级联切割的过程, 不同的蛋白酶在不同的阶段发挥功能, 但总的来说, 在蛋白酶级联切割过程中, Caspase-3处于核心位置, 其受上游蛋白酶的切割活化, 活化的Caspase-3又切割活化下游的底物, 在细胞凋亡过程中起着关键作用[8], 其过量表达可诱发细胞凋亡, 在凋亡的执行阶段负责对全部或部分关键性蛋白的酶切从而引起凋亡的激活或灭活, 因此许多学者将活化的Caspase-3的出现作为细胞凋亡的标志[9-10]. Jaeschke et al[11]研究证实TNF-α能激活Caspase-3蛋白酶活性并能诱发肝细胞凋亡. Künstle et al[12]的研究也证实广谱的Caspase抑制剂可阻断TNF-α介导的肝细胞毒性. 同样我们研究发现正常组小鼠肝组织仅有少量Caspase-3 mRNA的表达, 对照组肝组织中Caspase-3 mRNA的表达较正常组显著增加, D-GalN/LPS可能通过上调Caspase-3的表达而导致肝细胞异常凋亡继而出现AHF; 而对照组肝组织中TNF-α mRNA的表达较正常组也显著增强, 我们推测D-GalN/LPS可能通过上调TNF-α的表达继而上调Caspase-3的表达导致肝细胞凋亡.
现研究表明TGF-β1是强有力的肝增生、再生及癌变的负性调节剂, 高水平的TGF-β1对肝损伤再生具有较强的抑制作用, 而持续高水平的TGF-β1与肝纤维化的发生发展过程相关[13]. 目前认为TGF-β1抑制肝细胞再生和增生的机制有两点: 一是TGF-β1可抑制肝细胞的DNA合成, 使其停留在细胞周期的G1期, 从而对肝细胞的生长有较明显的抑制作用; 二是TGF-β1能导致肝细胞的凋亡, 拮抗TGF-α的促肝细胞生长作用. 我们的研究发现, 正常组小鼠肝组织仅有少量TGF-β1 mRNA的表达, 对照组肝组织中TGF-β1 mRNA的表达较正常组显著增加, 我们推测D-GaIN/LPS可能通过上调TGF-β1的表达而抑制了肝细胞再生, 继而进一步加重肝损伤出现AHF.
罗格列酮属于新一代噻唑烷二酮类药, 目前主要用于2型糖尿病的治疗. 然而近年随着研究的深入, 人们发现罗格列酮除具有降糖作用外还具有许多其他方面的作用, 如改善血流动力学, 影响细胞增殖和转型、抗炎、抗氧化和抗凋亡等, 其中的许多作用与肝脏及其相关疾病有着密切联系. 如罗格列酮通过抑制α-平滑肌肌动蛋白及Ⅰ型胶原的表达, 抑制肝星状细胞的增殖, 降低基质金属蛋白酶组织抑制因子表达, 进而减弱对胶原降解的抑制作用, 延缓或逆转肝纤维化[14]. 近期研究[15]证明罗格列酮与脂肪肝和肝脏炎症反应的发生与调控有关, 另外, Ratziu et al予经肝活检证实有非酒精性肝病的患者以罗格列酮治疗, 治疗结束后肝活检显示坏死炎症改变明显减退, 肝细胞气球样变性和窦周隙区纤维化明显改善, 转氨酶和胰岛素抵抗也明显改善[16-17]. 本研究发现罗格列酮可显著降低AHF血清转氨酶水平, 罗格列酮干预组肝组织病理以肝细胞变性为主, 坏死较少, 肝细胞损伤程度较对照组明显减轻; 此外, 我们发现罗格列酮干预组肝组织中TNF-α、TGF-β1、Caspase-3 mRNA的表达较对照组明显减弱, 差异有显著性, 基于前面讨论TNF-α和Caspase-3参与肝细胞的坏死与凋亡, TGF-β1可抑制肝细胞的再生, 我们推测罗格列酮可能是通过下调TNF-α、Caspase-3 mRNA的表达使肝细胞炎症和坏死得以减轻, 凋亡减少; 此外罗格列酮也通过下调TGF-β1 mRNA的表达而有利于肝细胞的再生, 从而对AHF起保护作用. 至于罗格列酮如何下调上述细胞因子, 目前机制尚不清楚, 有待更深入的研究.
急性肝衰竭与肝脏的炎症、坏死及肝细胞的凋亡有着密切关系. 近来研究发现肝组织也有PPAR-γ表达, 而罗格列酮作为PPAR-γ的合成型配体, 具有抗炎、抗氧化和抗凋亡等作用, 且在抗肝纤维化、非酒精性脂肪肝治疗上取得较好疗效, 是否也可用于治疗急性肝衰竭, 国内外尚未见相关报道.
秦成勇, 教授, 山东省立医院消化内科; 刘正稳, 教授, 西安交通大学医学院第一附属医院
AHF来势凶猛, 发展迅速, 预后差, 是严重危害人类健康的一种疾病. 长久以来, 人们一直致力于寻找一种能够用于研究AHF致病机制和检验疗效的理想动物模型.
研究表明罗格列酮通过活化PPAR-γ, 可在基因和蛋白水平抑制单核细胞趋化蛋白的表达, 抑制肝脏炎症介质的释放; 可抑制核转录因子、活化蛋白-1的活性, 从而在转录水平抑制多种促炎介质的基因表达; 可通过抑制α-平滑肌肌动蛋白及Ⅰ型胶原的表达, 达到延缓或逆转肝纤维化的作用; 对非酒精性肝病患者, 罗格列酮能明显减轻坏死炎症, 改善肝细胞气球样变性、窦周隙区纤维化、转氨酶和胰岛素抵抗.
罗格列酮对急性肝衰竭有保护作用, 能降低死亡率, 故将此研究进一步完善和深入, 有可能为急性肝衰竭的临床研究和药物开发提供一个新的方向.
本文选题尚可, 设计合理, 结论可靠, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Wang YJ, Li MD, Wang YM, Chen GZ, Lu GD, Tan ZX. Effect of extracorporeal bioartificial liver support system on fulminant hepatic failure rabbits. World J Gastroenterol. 2000;6:252-254. [PubMed] |
| 2. | Uesugi T, Froh M, Arteel GE, Bradford BU, Thurman RG. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology. 2001;34:101-108. [PubMed] [DOI] |
| 3. | Mignon A, Rouquet N, Fabre M, Martin S, Pagès JC, Dhainaut JF, Kahn A, Briand P, Joulin V. LPS challenge in D-galactosamine-sensitized mice accounts for caspase-dependent fulminant hepatitis, not for septic shock. Am J Respir Crit Care Med. 1999;159:1308-1315. [PubMed] |
| 4. | Terblanche J, Hickman R. Animal models of fulminant hepatic failure. Dig Dis Sci. 1991;36:770-774. [PubMed] [DOI] |
| 5. | Ding WX, Yin XM. Dissection of the multiple mechanisms of TNF-alpha-induced apoptosis in liver injury. J Cell Mol Med. 2004;8:445-554. [PubMed] [DOI] |
| 6. | Nguyen NT, Banskota AH, Tezuka Y, Le Tran Q, Nobukawa T, Kurashige Y, Sasahara M, Kadota S. Hepatoprotective effect of taxiresinol and (7'R)-7'-hydroxylariciresinol on D-galactosamine and lipopolysaccharide-induced liver injury in mice. Planta Med. 2004;70:29-33. [PubMed] [DOI] |
| 7. | Nowak M, Gaines GC, Rosenberg J, Minter R, Bahjat FR, Rectenwald J, MacKay SL, Edwards CK 3rd, Moldawer LL. LPS-induced liver injury in D-galactosamine-sensitized mice requires secreted TNF-alpha and the TNF-p55 receptor. Am J Physiol Regul Integr Comp Physiol. 2000;278:R1202-R1209. [PubMed] |
| 8. | 方 福德, 杨 焕明. 分子生物学前沿技术. 第1版. 北京: 北京医科大学、中国协和医科大学联合出版社 1998; 67-124. |
| 11. | Jaeschke H, Fisher MA, Lawson JA, Simmons CA, Farhood A, Jones DA. Activation of caspase 3 (CPP32)-like proteases is essential for TNF-alpha-induced hepatic parenchymal cell apoptosis and neutrophil-mediated necrosis in a murine endotoxin shock model. J Immunol. 1998;160:3480-3486. [PubMed] |
| 12. | Künstle G, Hentze H, Germann PG, Tiegs G, Meergans T, Wendel A. Concanavalin A hepatotoxicity in mice: tumor necrosis factor-mediated organ failure independent of caspase-3-like protease activation. Hepatology. 1999;30:1241-1251. [PubMed] [DOI] |
| 13. | Boulton RA, Alison MR, Golding M, Selden C, Hodgson HJ. Augmentation of the early phase of liver regeneration after 70% partial hepatectomy in rats following selective Kupffer cell depletion. J Hepatol. 1998;29:271-280. [PubMed] [DOI] |
| 14. | 赵 彩彦, 王 建彬, 邓 卓军, 刘 敬稳, 李 建梅, 李 丽, 姜 玲玲. 大鼠肝组织核因子-κB活性变化与过氧化物酶体增殖物激活受体γ表达的关系. 中华肝脏病杂志. 2005;13:96-100. |
| 16. | Ratziu V, Jacqueminer S, Giral P, Podevin P, Serfaty L, Charlotte F. A one-year, randomized, placebo-controlled, double-blind trial of rosiglitazone in non alcoholic steatohepatitis: results of the FLIRT pilot trial. Diabetologia. 2006;49:755. |
| 17. | Neuschwander-Tetri BA, Brunt EM, Wehmeier KR, Oliver D, Bacon BR. Improved nonalcoholic steatohepatitis after 48 weeks of treatment with the PPAR-gamma ligand rosiglitazone. Hepatology. 2003;38:1008-1017. [PubMed] |