修回日期: 2009-03-11
接受日期: 2009-03-16
在线出版日期: 2009-04-18
目的: 探讨单乙基甘胺酰二甲苯胺(MEGX)试验对肝脏储备功能评估的价值.
方法: 采用改良复合因素(CCl4、胆固醇、乙醇)制备大鼠肝硬化模型, 将40只雄性肝硬化大鼠完全随机分成A、B、C、D组4组, 每组10只, 分别行不同肝切量的肝切除(0%、15%、30%、45%). 术前、术后行MEGX试验、吲哚氰绿排泄(ICGR15)试验、常规肝功能检测, 并对切除的肝组织进行常规病理检查.
结果: 实验组(B、C、D组)肝切后大鼠血清MEGX的量较肝切前均有不同程度的下降(30.22±10.6 μg/L vs 37.52±14.01 μg/L, 22.68±6.19 μg/L vs 38.47±15.24 μg/L, 12.60±5.88 μg/L vs 37.26±13.87 μg/L, 均P<0.05). 且随着肝切量的增加, MEGX的量明显减少, 术后各组间比较均有显著性差异(P<0.05).
结论: MEGX试验能较灵敏反映肝储备功能受损的程度, 优于常规肝功能检测及ICGR15试验.
引文著录: 李建华, 邬林泉, 刘石龙, 罗志强, 傅华群. MEGX试验对肝脏储备功能评估价值. 世界华人消化杂志 2009; 17(11): 1126-1129
Revised: March 11, 2009
Accepted: March 16, 2009
Published online: April 18, 2009
AIM: To study the effectiveness of MEGX test in evaluating liver reserve of rats with experimental liver cirrhosis in different hepatectomy.
METHODS: A rat model of liver cirrhosis was established with improved and complex factors (CCl4, cholesterol, alcohol). Forty male SD cirrhosis rats were randomly divided into 4 groups; the rats of all groups underwent different partial hepatectomy (A group: 0%; B group: 15%; C group: 30%; D group: 45%). MEGX, ICGR15 and common hepatic function were performed, and the liver tissue samples were taken for pathologic examination.
RESULTS: MEGX were lower following partial hepatectomy in experimental groups (B, C, D groups) (30.22 ± 10.6 μg/L vs 37.52 ± 14.01 μg/L, 22.68 ± 6.19 μg/L vs 38.47 ± 15.24 μg/L, 12.60 ± 5.88 μg/L vs 37.26 ± 13.87 μg/L, all P < 0.05). With the extracted liver tissue increased, the serum level of MEGX was decreased obviously. There were significant differences among all postoperative groups for MEGX concentrations (P < 0.05).
CONCLUSION: The MEGX test can sensitively reflect the damage to liver reserve capacity, which is better than ICGR15 test or conventional liver function tests.
- Citation: Li JH, Wu LQ, Liu SL, Luo ZQ, Fu HQ. Evaluation of the liver reserve of rats with experimental liver cirrhosis in hepatectomy by MEGX test. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1126-1129
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1126.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1126
肝细胞癌是我国常见的恶性肿瘤, 我国肝细胞癌伴肝硬化率高达72.1%-82.3%, 肝切除术后并发症发生率和手术死亡率分别为23.4%-40.0%和1.6%-7.5%[1]. 正确评估肝硬化患者的肝功能损害程度和肝脏储备功能, 是肝脏外科的重要课题. 本实验通过建立肝硬化大鼠肝切除模型, 研究血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清总蛋白(TP)等常规肝功能指标和MEGX试验、吲哚氰绿排泄试验(ICGR15)等肝储备功能指标与肝切除量间的变化关系, 探索估计肝储备功能的敏感指标和方法.
标准♂SD大鼠60只, 体质量270-300 g, 由南昌大学医学院动物科学部提供. 分析纯CCl4(天津市恒兴化学试剂有限公司); 盐酸利多卡因(山东益健药业有限公司); 氯胺酮(福建古田药业有限公司); 盐酸MEGX(瑞典Astra Zeneca公司产品); 吲哚氰绿(辽宁省辽阳市第三制药厂产品).
1.2.1 肝硬化大鼠模型制作: 将大鼠按0.3 mL/100 g体质量给予400 mL/L CCl4橄榄油溶液2 wk, 2 wk后改为500 mL/L CCl4橄榄油溶液应用2 wk, 从第5周改为600 mL/L CCl4橄榄油溶液应用4 wk. 行大鼠ip, 每周2次. 第1-2周给予50 mL/L乙醇溶液作为饮用水, 第3-4周给予100 mL/L乙醇溶液作为饮用水, 第5-8周给予200 mL/L乙醇溶液作为饮用水. 共诱导8 wk给予普通鼠料混合猪油及葵花籽喂养, 8 wk后制成肝硬化模型. 每天观察大鼠的一般状况、饮食变化、行为(自主活动、精神状态)变化、毛发变化.
1.2.2 分组: 将40只肝硬化大鼠完全随机分成A、B、C、D组, 每组10只, A组只开腹搔扰腹腔不作肝切除; B组切除右肝叶(约占肝总量15%); C组切除左肝叶(约占肝总量30%); D组切除左、右肝叶(约占肝总量45%).
1.2.3 实验操作步骤: 各组用氯胺酮70 mg/kg剂量肌注, 大鼠麻醉成功后经阴茎静脉丛注射0.1%利多卡因1 mg/kg及0.05%吲哚氰绿0.5 mg/kg, 15 min后经眼眶后静脉丛取血0.5 mL两肝素管, 离心出血清后置-20 ℃冰箱中冷冻保存后分别送LC-10A高效液相色谱仪检测MEGX浓度及UV-2450紫外分光光度计805 nm处检测ICGR15浓度.
取上腹正中切口, 长约6 cm, 逐层开腹后从腔静脉取血约1 mL, 静置后离心取血清, 送全自动生化分析仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)三项指标. 再游离肝周各韧带, 采用肝叶根部结扎法分别作不同肝组织量的肝切除术, 将切除的肝组织小块置于100 g/L中性甲醛溶液中固定. 缝闭切口各层, 术后喂以普通鼠料及自由饮水. 术后48 h重复如上取血处理.
统计学处理 实验数据用mean±SD表示, 采用SPSS13.0版本的统计软件进行数据分析处理, 多组变量采用单因素方差分析, 多个样本均数两两比较采用q检验等, 确定P<0.05为有统计学意义.
观察大鼠1-2 wk无明显变化, 3 wk以后体毛不顺, 饮食饮水稍减少, 但体质量有所减轻. 5 wk后毛发凌乱无光泽, 食欲差, 精神萎靡活动少, 对外界刺激反应慢, 体质量增长缓慢. 8 wk后造模结束, 造模过程中大鼠共死亡8只. 各组大鼠经麻醉剖开腹腔后, 见肝脏呈黄褐色, 其表面可见细小颗粒状结节, 形成典型肝硬化外观, 腹腔内有腹水, 量不等. 各组肝硬化大鼠完成不同肝切除后48 h内无死亡.
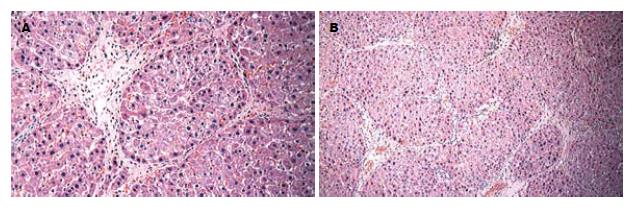
大鼠肝内小叶结构紊乱, 中央静脉偏离或消失; 肝细胞索排列紊乱, 中央静脉区及肝小叶周边区出现明显肝细胞大泡性脂肪变性, 气球样变性, 少数细胞肿胀及嗜酸性变, 散在不同程度的小叶内坏死、碎屑坏死、桥接坏死; 汇管区扩大, 有较多炎性细胞浸润, 纤维结缔组织增生, 部分假小叶形成. 其结果显示大鼠肝硬化模型成功(图1).
肝切后大鼠血中总蛋白(TP)值下降, 与肝切前比较, B、C、D组差异均有显著性(P<0.05). 肝切后各组转氨酶亦均有不同程度升高. B组和C组ALT、AST水平肝切前后差异无显著性(P>0.05). D组肝切后的ALT、AST、TP水平明显高于肝切前, 差异有显著性(P<0.05), 且与A、B、C各组比较差异均有显著性(P<0.05, 表1).
| 分组 | ALT(U/L) | AST(U/L) | TP(g/L) | |||
| 术前 | 术后 | 术前 | 术后 | 术前 | 术后 | |
| A组 | 141.54±48.1 | 141.78±53.5 | 348.50±189.7 | 350.80±196.1 | 56.00±3.9 | 55.00±3.4 |
| B组 | 177.44±90.4 | 182.80±53.8 | 309.63±94.8 | 385.67±268.6 | 60.56±7.6 | 50.87±5.4a |
| C组 | 146.32±52.2 | 201.36±93.4 | 335.20±93.3 | 407.81±395.3 | 59.72±4.5 | 50.12±5.6a |
| D组 | 143.80±95.7 | 372.80±153.7ac | 345.80±183.9 | 606.30±193.4ac | 60.60±4.4 | 47.53±4.2ac |
实验组肝切后大鼠血清MEGX含量较切肝前均有不同程度的下降(P<0.05). 随着肝切量的增加, MEGX的量明显减少, 术后A、B、C、D各组间比较(P<0.05)均有显著性差异. 实验组肝切后大鼠血清ICGR15的量较切肝前明显升高(P<0.05), ICGR15的量随着肝切量的增加均有不同程度的升高, 术后B、C、D组与A组比较(P<0.05)均有显著性差异, 但C组与D组之间比较无统计学差异(P>0.05, 表2).
以往建立大鼠肝硬化模型的方法是采用高脂低蛋白的食物, 300 g/L乙醇为唯一饮料. 每隔3 d 1次皮下或腹腔内注射400 mL/L CCl4油剂3 mL/kg. 但是此种方法需要时间较长, 约12 wk, 死亡率约为20%. 本实验大鼠采用逐渐增加乙醇及CCl4浓度的方法, 使大鼠有一个逐渐适应的过程[2]. 同时在饲料中混合猪油, 通过监测体质量, 发现大鼠早期体质量下降并不十分明显, 肝功能衰竭导致的死亡率11.7%.
测定利多卡因经肝细胞色素P450-ⅢA4 酶代谢的产物MEGX是最近国内外研究热点, MEGX试验的结果在肝移植领域得到较广泛的应用[3-4]. Ollerich et al[5]在研究中也发现MEGX试验优于咖啡因清除试验和Child分级. Addario et al[6]研究认为MEGX试验在患者肝硬化诊断方面优于Child-Pugh和终末期肝病模型(MELD)评分法.
吲哚氰绿试验是检测肝储备功能的指标. 有学者比较了肝细胞癌肝切除术前吲哚氰绿15 min潴留率(ICGR15)、氨基酸清除率及安替比林呼吸试验, 认为ICGR15是肝细胞癌患者术前肝储备功能评估的最佳指标[7].
测定MEGX浓度的方法既往多用FPIA法, 其方法有灵敏度高、快速、简捷等优点, 但不能有效区分MEGX与3-OH-MEGX, 尤其在啮齿类动物实验中有较大的影响[8], 且仪器昂贵和试剂盒的局限性, 测定成本高. 而HPLC法有专一性强、准确性高、成本低、分析速度快、分离效率高、易于实现操作自动化等优点[9-10]. 一般来说, 荧光偏振免疫法(FPIA法)和高效液相色谱法(HPLC法)的结果甚为符合. 然而, FPIA法测定会受到胆红素等内源性物质的影响, 使测定值偏高. 故本实验选择了HPLC法测定MEGX浓度.
麻醉药中有许多种在肝细胞色素P450-ⅢA4酶系统内代谢, 因此很可能影响利多卡因在肝内的代谢, 氯胺酮影响较小. 本实验中B、C、D组的术后血清MEGX水平与对照组之间差异有统计学意义(P<0.05), 且A、B、C、D各组组间差异有统计学意义(P<0.05), 随着肝硬化大鼠肝切量的增加, 血清MEGX水平逐渐降低, 即切除的肝量越多, 残余的肝细胞越少, 代谢利多卡因产生MEGX的量也相应降低, 与Druckenbrod et al[11]实验结果相类似. 可以说明MEGX试验是一项比较灵敏的检测肝脏储备功能的指标, 而在常规肝功能检测中, 随着肝切量的增加肝硬化大鼠血清TP逐渐下降, 各组转氨酶均有不同程度升高, 但B组、C组ALT、AST肝切前后及组间的差异无显著性(P>0.05), 只有D组肝切前后及与其他各组之间比较有明显差异(P<0.05). 说明常规肝功能检测指标在反映肝储备功能方面不够准确. 本实验中ICGR15的量随着肝切量的增加明显升高, 术后B、C、D组与A组比较均有显著性差异(P<0.05), 这证实了ICGR15试验具有定量评价肝功能损害的临床意义. 但C组与D组之间比较无统计学差异(P>0.05), 可能的原因是ICGR15对反映肝细胞数量减少方面欠敏感. 本实验显示血清MEGX浓度测定其敏感性、准确性均较ICGR15测定更有价值, 更能反映有功能肝细胞的总体数量及肝功能损害的程度[12-13].
总之, MEGX试验是一种准确、快捷的方法, 较敏感反映肝储备功能受损的程度, 优于常规肝功能检测及ICGR15试验. 适用于临床肝脏储备功能的检测, 尤其对临床合并肝硬化的肝细胞癌患者围手术期肝功能储备的评估有很好的指导价值.
肝细胞癌是我国常见的恶性肿瘤, 我国肝细胞癌伴肝硬化率高达72.1%-82.3%, 肝切除术后并发症发生率和手术死亡率分别为23.4%-40.0%和1.6%-7.5%. 正确评估肝硬化患者的肝功能损害程度和肝脏储备功能, 是肝脏外科的重要课题.
王鲁, 副教授, 复旦大学附属中山医院肝外科.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
Addario et al研究认为MEGX试验在患者肝硬化诊断方面优于Child-Pugh和终末期肝病模型(MELD)评分法.
MEGX试验能较灵敏反映肝储备功能受损的程度, 优于常规肝功能检测及ICGR15试验.
本文实验方法可靠, 对临床有一定参考意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | 吴 孟超. 肝脏外科学. 第2版, 上海: 上海科学技术文献出版社 2000; 305. |
| 3. | Kaneko H, Otsuka Y, Katagiri M, Maeda T, Tsuchiya M, Tamura A, Ishii T, Takagi S, Shiba T. Reassessment of monoethylglycinexylidide as preoperative liver function test in a rat model of liver cirrhosis and man. Clin Exp Med. 2001;1:19-26. [PubMed] [DOI] |
| 4. | Bhise SB, Dias RJ. Monoethylglycinexylidide (MEGX) as a liver function test in cirrhosis. Indian J Gastroenterol. 2007;26:167-169. [PubMed] |
| 5. | Oellerich M, Raude E, Burdelski M, Schulz M, Schmidt FW, Ringe B, Lamesch P, Pichlmayr R, Raith H, Scheruhn M. Monoethylglycinexylidide formation kinetics: a novel approach to assessment of liver function. J Clin Chem Clin Biochem. 1987;25:845-853. [PubMed] |
| 6. | Addario L, Scaglione G, Tritto G, Di Costanzo GG, De Luca M, Lampasi F, Galeota Lanza A, Picciotto FP, Tartaglione MT, Utech W. Prognostic value of quantitative liver function tests in viral cirrhosis: a prospective study. Eur J Gastroenterol Hepatol. 2006;18:713-720. [PubMed] [DOI] |
| 7. | Lau H, Man K, Fan ST, Yu WC, Lo CM, Wong J. Evaluation of preoperative hepatic function in patients with hepatocellular carcinoma undergoing hepatectomy. Br J Surg. 1997;84:1255-1259. [PubMed] [DOI] |
| 8. | Leclercq I, Saliez A, Wallemacq PE, Horsmans Y, Lambott L. The monoethylglycinexylidide test does not correctly evaluate lidocaine metabolism after ischemic liver injury in the rat. Hepatology. 1997;26:1182-1188. [PubMed] [DOI] |
| 9. | Streit F, Niedmann PD, Shipkova M, Armstrong VW, Oellerich M. Rapid and sensitive liquid chromatography-tandem mass spectrometry method for determination of monoethylglycinexylidide. Clin Chem. 2001;47:1853-1856. [PubMed] |
| 10. | Laroche N, Leneveu A, Roux A, Flouvat B. Capillary gas chromatographic method for the measurement of small concentrations of monoethylglycinexylidide and lidocaine in plasma. J Chromatogr B Biomed Sci Appl. 1998;716:375-381. [PubMed] [DOI] |
| 11. | Druckenbrod RW, Mendenhall CL, Myre SA, Stanberry EA, Schroeder TJ. Effects of controlled liver injury and ethanol pretreatment on monoethylglycine xylidide formation in the rat. Pharmacology. 1991;42:169-176. [PubMed] [DOI] |
| 12. | Lee WC, Chen MF. Assessment of hepatic reserve for indication of hepatic resection: how I do it. J Hepatobiliary Pancreat Surg. 2005;12:23-26. [PubMed] [DOI] |
| 13. | Oellerich M, Schutz E, Amstrong VW. Liver Transplantation: Assessment of liver function in both transplant candidates and recipients in Kleesiek K&Henbner A ads: Transplantrtion of organs and cells. Blackwell Wissenschafts-Verelag Berlin Vienna. 1997;22. |