修回日期: 2009-02-21
接受日期: 2009-02-23
在线出版日期: 2009-04-18
目的: 构建幽门螺杆菌(H. pylori)iceA基因突变株.
方法: 克隆iceA基因及两侧的部分序列至载体pBluescript SKⅡ(-)多克隆位点中. 运用基因重组方法将卡那霉素抗性基因(kam)插人iceA基因片段之间, 构建出带卡那霉素抗性标志的突变载体pBS-iceA-kam. 再将突变载体转化至H. pylori中国临床分离株MEL-H. pylori 27中, 用卡那霉素筛选iceA基因的突变株, 经PCR和DNA测序鉴定.
结果: 用PCR方法扩增突变株基因组DNA, 结果显示卡那霉素抗性基因已插入iceA基因片段中, 测序进一步证实已筛选获得H. pylori中国临床分离株iceA基因的突变株.
结论: 成功构建一株H. pylori iceA基因突变株.
引文著录: 马一君, 段广才, 张荣光, 范清堂, 张卫东. 幽门螺杆菌中国临床分离株iceA基因突变株的构建和鉴定. 世界华人消化杂志 2009; 17(11): 1098-1102
Revised: February 21, 2009
Accepted: February 23, 2009
Published online: April 18, 2009
AIM: To construct an iceA gene mutant strain of Chinese H. pylori.
METHODS: The iceA gene and its partial upper and downstream flank DNA fragments were cloned into plasmid pBluescript SK II (-). And kanamycin resistance gene from pEGFP-N2 was inserted into iceA gene to construct objective plasmid pBS-iceA-kam. Then pBS-iceA-kam was transformed into H. pylori cells by electroporation and the strains expressing kanamycin resistance genes were selected by kanamycin agar, which were identified by PCR and sequencing analysis.
RESULTS: The result of PCR amplified and sequencing analysis from the genome DNA of the constructed mutant strain showed that kanamycin resistance genes were inserted into iceA gene successfully.
CONCLUSION: The iceA mutant strain of H. pylori isolated from China is constructed successfully.
- Citation: Ma YJ, Duan GC, Zhang RG, Fan QT, Zhang WD. Construction and identification of iceA gene mutant strain of Helicobacter pylori isolated from Chinese patients. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1098-1102
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1098.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1098
幽门螺杆菌(H. pylori)是一种专寄生于人胃黏膜的革兰阴性微需氧菌, 是各地最常见的感染性病原之一, 世界上至少有50%人口感染H. pylori. 许多研究表明, H. pylori感染后可导致再发性腹痛、胃炎和消化性溃疡、胃癌等胃肠疾病的发生, 1994年国际癌症研究中心将其归为Ⅰ类致癌因子. H. pylori的感染和发病涉及多个毒力因子. 近年研究发现, H. pylori接触胃黏膜上皮后可诱导表达一种毒力相关因子-黏膜接触诱导因子, 由iceA(induced by contact with epithelium, iceA)基因编码, 可能通过调控相关毒素基因的表达等机制, 参与H. pylori的致病作用[1]. 也有研究发现, iceA与消化性溃疡及IL-8的黏膜浓度增高显著相关, 而IL-8在H. pylori相关性炎症和H. pylori相关性疾病中发挥着重要作用[2]. 虽然国内外研究人员针对iceA基因与H. pylori所致临床疾病的相关性进行了多项研究[3-6], 但iceA基因作为一毒力相关基因, 其生物学功能及其致病机制尚不十分清楚. 因此本研究拟利用中国临床分离株MEL-H. pylori 27进行研究, 根据同源重组原理, 利用分子克隆方法, 构建iceA基因的突变株, 为探讨iceA基因的作用提供重要的实验基础.
含iceA基因的H. pylori菌株MEL-H. pylori 27(H. pylori 27)由本教研室从郑州市慢性萎缩性胃炎患者体内分离并保种. 载体pBluescript SK Ⅱ(-)由中国人民解放军军事医学科学院韩聚强博士惠赠, 质粒pEGFP-N2(含卡那霉素抗性基因)由河南省医学科学研究所范天黎博士惠赠. 大肠杆菌DH5α为本室保存. PMD19-T载体、Pyrobest DNA聚合酶、T4 DNA连接酶、DNA Marker、各限制性内切酶等均为TaKaRa公司产品, 蛋白酶K、RNA酶A为Sigma公司产品, 胰蛋白胨、酵母提取物购自Oxoid公司, 胶回收试剂盒购自Xsigen公司.
1.2.1 PCR扩增: 参照GenBank公布的H. pylori菌株iceA基因及其上下游核苷酸序列设计引物, 用于扩增包括iceA基因在内的序列: F: 5'-GGGTGCGATTTGCGTGGGCGATGATGTG-3', R: 5'- GATCATGGCCTACAACCGCATGGATATT-3', 扩增片段长度约790 bp. 根据质粒pEGFP-N2全序列设计用于扩增抗性筛选标记基因卡那霉素的引物: K1: 5'-CCAAGCTTATGATT GAACAAGATGGATTG-3'(含Hind Ⅲ酶切位点), K2: 5'-CCAAGCTTCAGAAGAACTCGTCAAGAAG-3'(含Hind Ⅲ酶切位点), 扩增片段长度约800 bp. 引物设计软件为Primer 5.0. 所有引物均由北京赛百盛公司合成. 以H. pylori 27基因组DNA为模板, 用F、R引物扩增包括iceA基因及两侧部分序列; 以质粒pEGFP-N2为模板, 用K1、K2引物扩增卡那霉素抗性基因. 反应体系50 μL, 扩增条件为: 94 ℃ 3 min×1; 94 ℃ 50 s, 54 ℃ 50 s, 72 ℃ 50 s×30; 72 ℃ 8 min×1.
1.2.2 iceA基因的克隆: PCR产物回收并与pMD19-T载体连接并转化E. coli DH5α, 菌落PCR筛选阳性克隆, 送北京博尚生物技术有限公司测序并分析. 提取质粒, 将重组质粒pMD19-T-iceA及质粒pBluescript SK Ⅱ(-)分别用限制性内切酶HincⅡ、BamHⅠ酶切处理后纯化并连接, 构建重组质粒pBS-iceA, 转化E. coli DH5α, 筛选阳性克隆并鉴定.
1.2.3 突变载体的构建: 将重组质粒pBS-iceA和卡那霉素抗性基因扩增产物经Hind Ⅲ酶切后连接并转化大肠杆菌, 筛选并鉴定, 突变载体记作pBS-iceA-kam.
1.2.4 突变菌株的构建与鉴定: 参考黄志刚 et al[7]从固体培养基上刮取H. pylori菌落于1 mL 15 mL/L甘油-9 g/L蔗糖溶液中, 4 ℃ 5000 r/min离心10 min(重复3次), 沉淀重悬于50 μL甘油蔗糖溶液中, 4 ℃ 10 min后加入质粒pBS-iceA-kam, 冰上静置5 min, 移入-20 ℃预冷的电击杯中冰浴5 min. 电击后吸出电转液均匀涂布于普通H. pylori平板培养. 刮取菌落, 转涂于含25 mg/L卡那霉素H. pylori平板上, 培养3-5 d. 提取基因组DNA进行鉴定: 分别用F/R及K1/K2为引物进行PCR扩增, 并以野生株H. pylori 27作为对照. 将引物F/R的扩增产物克隆后, 送北京博尚生物技术有限公司测序并分析.
1.2.5 突变株与野生株尿素酶活性的比较: 实验在96孔板上进行, 分A、B、C三组, 每组6个复孔, 每孔内分别加入尿素酶检测试剂100 μL. 然后A组每孔分别加入含野生株H. pylori 27的PBS菌液10 μL, B组每孔分别加入含突变株的PBS菌液10 μL, C组每孔分别加入PBS液10 μL作为空白对照. A、B加入菌液浓度均为1×1011 CFU/L(A600nm = 1). 在不同时点用酶标仪检测各孔A492nm吸光度值.
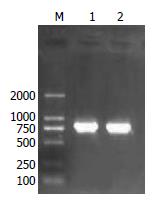
以H. pylori 27基因组DNA为模板, 用引物F、R扩增包括iceA基因及两侧部分序列, 扩增片段长约790 bp(图1).
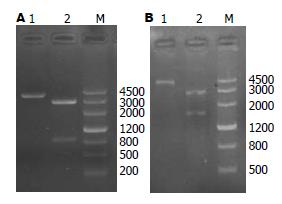
重组质粒pBS-iceA用BamHⅠ单酶切, 用HincⅡ、BamHⅠ双酶切进行鉴定, 单酶切产生约3820 bp片段, 双酶切产生约3000 bp和820 bp片段(图2A), 与预期相符.
构建的质粒pBS-iceA-kam用BamHⅠ单酶切, 用HincⅡ、BamHⅠ双酶切进行鉴定, 单酶切产生约4600 bp片段, 双酶切产生约3000 bp和1600 bp片段(图2B), 与预期相符.
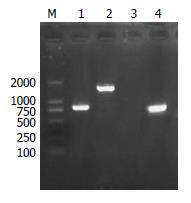
提取构建的突变株与野生株的基因组DNA, 分别用F/R、K1/K2为引物进行PCR扩增, 结果显示用F/R为引物突变株可以扩增出长约1600 bp的基因片段, 而野生株扩增片段长度约为780 bp; 用K1/K2为引物突变株可扩增出800 bp左右的卡那抗性基因片段, 而野生株不能扩增出(图3). 测序结果进一步证实突变株构建成功.
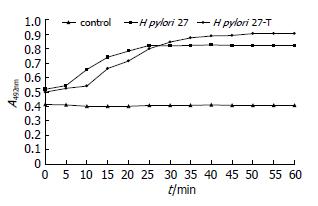
将构建的突变株和野生株分别与尿素酶试剂作用, 野生株组在25 min完全分解尿素酶试剂达到其最大吸光度值, 且在此之前其吸光度值均高于突变株组. 突变株组在50 min达到其最大吸光度值, 且在作用25 min后的吸光度值均高于野生株组(图4).
作为H. pylori接触胃黏膜上皮后诱导表达的一种毒力相关因子, iceA有两个不同的等位基因型,其侧翼序列上游是cysE(丝氨酸乙酰基转移酶的同源物), 下游是hpylM(DNA腺嘌呤甲基化酶). iceA1基因序列可能编码一个有功能的限制性内切酶, 而且iceA在大部分H. pylori菌株中并不是编码一个功能蛋白, 而是在转录水平调节腺嘌呤甲基转移酶基因hpyIM的表达, 通过DNA甲基化水平的改变来调控相关毒素基因的表达, 从而间接参与H. pylori的致病作用[1]. 也有研究发现, iceA还与消化性溃疡及IL-8的黏膜浓度增高显著相关[2]. 因此, 目前多数学者认为iceA可能是独立于cagA和vacA之外的又一毒力相关基因[1-2,8]. 根据各国研究人员的流行病学调查, 大部分认为iceA基因与H. pylori感染引起的消化道炎症具有明显的相关性[9-12]. 为了进一步研究iceA基因的功能, 本研究构建了iceA基因的插入失活突变株. 利用同源重组原理构建H. pylori中某基因失活的突变体一直是研究该基因在H. pylori中作用的一个非常有效和常用的手段, H. pylori许多重要的黏附、定植、毒力等相关基因功能都是通过这种技术得到了验证[13-16]. 由于质粒pBluescript SK Ⅱ(-)在大肠杆菌中能自主复制但不能在H. pylori中复制, 并且对H. pylori转化效率较高, 在相关基因功能研究中得到广泛应用. 因此本课题选择pBluescript SK Ⅱ(-)作为来源质粒, 采用卡那霉素抗性基因作为筛选标记, 构建重组打靶质粒. 本研究首先克隆MEL-H. pylori 27菌株iceA基因及两侧cysE和hpyIM的部分序列, 测序后发现在该基因读码框中间有一个较为合适的HindⅢ酶切位点, 直接在卡那霉素抗性基因两端添加该酶切位点, 采用基因重组的方法将卡那霉素抗性基因插入目的基因序列中, 从而大大简化了构建突变打靶载体的步骤. 通过电穿孔转化方法, 将突变载体转化进入野生株, 突变载体与野生株染色体之间发生同源重组, 卡那霉素抗性基因插至目的基因序列中, iceA基因的插入失活突变株得以构建. 结果表明用这种同源重组方式构建H. pylori的突变株行之有效.
为了检测突变株的构建是否成功, 本研究对突变株和野生株的基因组DNA进行PCR的检测, 用iceA基因两端序列设计引物分别扩增突变株和野生株, 结果突变株的扩增片段长度比野生株长约800 bp, 且突变株能扩增出卡那霉素抗性基因片段, 野生株则不能. 为进一步确定, 又用突变株基因组为模板, 以iceA基因两端序列所设计的引物进行扩增, 产物的测序结果表明卡那霉素抗性基因插入目的基因序列中.
由于产生高活性的尿素酶是H. pylori的重要特征之一, 本研究将构建的突变株和野生株H. pylori 27分别与尿素酶试剂作用, 二者均立即发生颜色改变, 由橘黄色变为紫红色, 吸光度值的变化趋势表现出一定的差异. 野生株组在25 min完全分解尿素酶试剂达到其最大吸光度值, 且在此之前其吸光度值均高于突变株组. 而突变株组在约50 min达到其最大吸光度值, 且在作用25 min后的吸光度值均高于野生株组. 其他性状的差异及其与iceA基因突变的相关性需进一步研究.
iceA基因作为一毒力相关基因, 其生物学功能尚不十分清楚. 近年来, 国内外研究人员虽然针对iceA基因的功能及与疾病的相关性进行了广泛研究, 但均是利用iceA基因阳性菌株进行的相关研究, 通过构建iceA基因突变株对其生物学功能进行研究尚未见报道, 对于iceA基因在疾病中的作用及其生物学功能仍缺乏直接的证据. 另外, 由于iceA等位基因在世界各地的分布不同, 具有明显的地区差异, 利用来源于西方国家的菌株研究的结果不一定能够反映中国分离菌株该基因的特征和作用.
本研究利用本实验室保存的中国临床分离株首次构建iceA基因突变株, 为进一步研究H. pylori iceA基因的生物学功能及其与消化性炎症相关的致病机制奠定了实验基础, 对于探讨iceA基因的地位和作用具有重要意义, 也将为H. pylori感染相关疾病的基因诊断提供新的依据. 目前, 有关MEL-H. pylori 27野生株与MEL-H. pylori 27菌株iceA基因突变株的相关功能差异研究正在进行当中.
H. pylori感染后可以导致再发性腹痛、胃炎和消化性溃疡、胃癌等胃肠疾病的发生. 但不同人群H. pylori的感染率和发病情况不尽相同, 这种差异除因宿主因素外, 还与H. pylori菌株的多样性有关. H. pylori的致病机制的阐明是从根本上解决各种问题的关键, H. pylori的感染和发病涉及多个毒力因子, 各致病因子对胃黏膜的损伤机制至今尚未完全明了.
喻荣彬, 副教授, 南京医科大学公共卫生学院流行病与卫生统计学系.
H. pylori的致病因子及其致病机制一直受到国内外研究人员的广泛关注. iceA是独立于cagA和vacA之外的毒力相关基因, 根据各国研究人员的流行病学调查, 大部分认为iceA基因与消化道炎症具有明显的相关性. 但是, 迄今为止, 对于iceA基因在疾病中的作用及其生物学功能尚缺乏直接的证据.
Figueiredo et al在来自感染患者的胃黏膜活检标本上成功转录出iceA1, 体外实验中也成功诱导了iceA1的表达. Peek et al研究发现, H. pylori菌株CH4的iceA1基因序列有一全长的nlaⅡR开放阅读框架(0RF)的同源物, 表明该序列可能编码一个有功能的限制性内切酶. 研究人员从人的胃黏膜中也已成功转录出iceA2, 并从所研究的基因序列中发现了明显的高度保守的盒式结构.
本文根据同源重组原理, 应用插入失活方法, 用中国临床分离株构建基因突变株, 为探讨iceA基因的生物学功能及其与疾病的关系奠定了重要的实验基础.
同源重组技术: 原理是将一段与靶基因两翼同源序列的PCR片段导入宿主菌细胞, 使导入细胞的线性DNA片段与染色体的特定靶序列进行同源重组, 靶基因被标记基因置换. 细菌同源重组可发生在转化或转导过程中, 即只要两条DNA序列相同或接近, 可以发生重组.
本研究选题新颖, 方法科学、规范, 论文撰写认真, 语言流畅, 推理逻辑性强, 对临床医师有重要参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Xu Q, Morgan RD, Roberts RJ, Xu SY, van Doorn LJ, Donahue JP, Miller GG, Blaser MJ. Functional analysis of iceA1, a CATG-recognizing restriction endonuclease gene in Helicobacter pylori. Nucleic Acids Res. 2002;30:3839-3847. [PubMed] [DOI] |
| 2. | Nishiya D, Shimoyama T, Fukuda S, Yoshimura T, Tanaka M, Munakata A. Evaluation of the clinical relevance of the iceA1 gene in patients with Helicobacter pylori infection in Japan. Scand J Gastroenterol. 2000;35:36-39. [PubMed] [DOI] |
| 3. | Ladeira MS, Bueno RC, Dos Santos BF, Pinto CL, Prado RP, Silveira MG, Rodrigues MA, Bartchewsky W Jr, Pedrazzoli J Jr, Ribeiro ML, Salvadori DM. Relationship among oxidative DNA damage, gastric mucosal density and the relevance of cagA, vacA and iceA genotypes of Helicobacter pylori. Dig Dis Sci. 2008;53:248-255. [PubMed] [DOI] |
| 4. | Linpisarn S, Suwan W, Lertprasertsuk N, Koosirirat C, Steger HF, Prommuangyong K, Phornphutkul K. Helicobacter pylori cagA, vacA and iceA genotypes in northern Thai patients with gastric disease. Southeast Asian J Trop Med Public Health. 2007;38:356-362. [PubMed] |
| 6. | Chomvarin C, Namwat W, Chaicumpar K, Mairiang P, Sangchan A, Sripa B, Tor-Udom S, Vilaichone RK. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA and babA2 genotypes in Thai dyspeptic patients. Int J Infect Dis. 2008;12:30-36. [PubMed] [DOI] |
| 8. | Caner V, Yilmaz M, Yonetci N, Zencir S, Karagenc N, Kaleli I, Bagci H. H. pylori iceA alleles are disease-specific virulence factors. World J Gastroenterol. 2007;13:2581-2585. [PubMed] |
| 9. | 林 燕芬, 龚 四堂, 区 文玑, 潘 瑞芳, 王 风华, 周 荣, 何 婉儿, 黄 海, 陈 佩瑜, 陈 宝心. 广州地区儿童感染幽门 螺杆菌iceA基因亚型与胃炎的相关性研究. 广东医学. 2007;28:213-215. |
| 10. | Erzin Y, Koksal V, Altun S, Dobrucali A, Aslan M, Erdamar S, Dirican A, Kocazeybek B. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA, babA2 genotypes and correlation with clinical outcome in Turkish patients with dyspepsia. Helicobacter. 2006;11:574-580. [PubMed] [DOI] |
| 11. | Dharne MS, Munot H, Pujari R, Kakrani AL, Patole MS, Shouche YS. Helicobacter pylori cagA, vacA and iceA genotypes in western Indian population of Maharashtra with varied gastroduodenal diseases. Indian J Pathol Microbiol. 2007;50:740-748. [PubMed] |
| 12. | Momenah AM, Tayeb MT. Helicobacter pylori cagA and iceA genotypes status and risk of peptic ulcer in Saudi patients. Saudi Med J. 2007;28:382-385. [PubMed] [DOI] |
| 13. | Chandan V, Logan SM, Harrison BA, Vinogradov E, Aubry A, Stupak J, Li J, Altman E. Characterization of a waaF mutant of Helicobacter pylori strain 26695 provides evidence that an extended lipopolysaccharide structure has a limited role in the invasion of gastric cancer cells. Biochem Cell Biol. 2007;85:582-590. [PubMed] |
| 14. | Loh JT, Torres VJ, Algood HM, McClain MS, Cover TL. Helicobacter pylori HopQ outer membrane protein attenuates bacterial adherence to gastric epithelial cells. FEMS Microbiol Lett. 2008;289:53-58. [PubMed] |
| 15. | Hong Y, Wang G, Maier RJ. A Helicobacter hepaticus catalase mutant is hypersensitive to oxidative stress and suffers increased DNA damage. J Med Microbiol. 2007;56:557-562. [PubMed] [DOI] |
| 16. | G M, Tiwari SK, Sharma V, Habeeb MA, Khan AA, Cm H. Association of Helicobacter pylori restriction endonuclease- replacing gene, hrgA with overt gastrointestinal diseases. Arq Gastroenterol. 2008;45:225-229. [PubMed] |