修回日期: 2009-02-01
接受日期: 2009-02-09
在线出版日期: 2009-04-18
目的: 探讨双歧杆菌在改善食物过敏动物肠道屏障功能、调整肠道菌群结构以及对免疫功能调节方面的作用及其机制.
方法: 无受试蛋白喂养BALB/c小鼠40只, 随机分为4组: 分别于0、3、9 d腹腔注射生理盐水, 金黄色葡萄球菌肠毒素B(SEB), 卵清蛋白(OVA), SEB+OVA; 并于第7、14天给予OVA灌胃. 在SEB+OVA致敏组的基础上设立自然恢复组、双歧杆菌作用组、思密达作用组、双歧杆菌+思密达共同作用组, 第15天开始分别经灌胃给予不同的药物, 连续7 d, 每日1次. 培养法分析粪便菌群, 检测血清二胺氧化酶(DAO)含量, ELISA法测定血清IgE、IL-4、INF-γ含量. 对肠系膜淋巴结(MLN)及肝、肾、肺组织进行培养以探讨有无细菌移位(BT)发生. 同时, 采用流式细胞术分析其脾细胞悬液中CD4+CD25+调节性T细胞的数量变化.
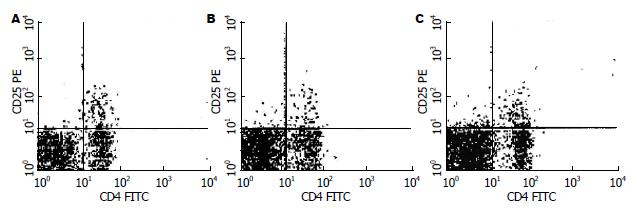
结果: 与SEB+OVA实验组相比, 双歧杆菌作用组小鼠血清IgE、DAO含量(A值)、血清IL-4(51.314±3.785 ng/L vs 69.980±9.103 ng/L, P<0.05)含量显著降低; 血清INF-γ水平显著升高(194.281±12.144 ng/L vs 133.875±33.822 ng/L, P<0.05); 脾细胞悬液中CD4+CD25+T细胞数量显著升高(5.778%±0.773% vs 4.216%±0.439%, P<0.05); 肠道固有菌群中益生菌乳酸杆菌的含量(6.670±0.443 vs 5.654±0.289, P<0.05)、双歧杆菌的含量(8.611±0.295 vs 7.491±0.339, P<0.05)显著升高, 条件致病菌大肠杆菌的含量(5.364±0.537 vs 6.718±0.267, P<0.05)、类杆菌的含量(7.427±0.544 vs 8.606±0.317, P<0.05)显著降低; MLN及外周器官细菌移位率显著降低(12.5% vs 37.5%, P<0.05).
结论: 双歧杆菌可以有效调节机体免疫功能、调整肠道菌群失调及保护肠道黏膜屏障功能.
引文著录: 张利利, 郑鹏远, 罗予, 王新亭, 刘志强, 黄煌. 双歧杆菌对食物过敏小鼠肠道屏障功能及Th1/Th2细胞因子的影响. 世界华人消化杂志 2009; 17(11): 1091-1097
Revised: February 1, 2009
Accepted: February 9, 2009
Published online: April 18, 2009
AIM: To investigate the effect of the Bifidobacterium on the gut barrier function, intestinal flora and immunologic function in allergic mice.
METHODS: Forty BALB/c mice fed on the OVA-free diet were randomly divided into four groups with ten mice in each group. Mice in A group were sensitized by intraperitoneal injection with SEB+OVA and mice in the other three groups were separately induced with normal saline (NS), SEB or OVA on the 0, 3rd and 9th days; and all of the mice were challenged by means of intragastric gavage with OVA on the 7th and 14th days. Then the natural recovery group, intervention by Bifidobacterium group, intervention by smcta group and intervention by both Bifidobacterium and smcta group were set on the base of SEB+OVA experimental group. From the 15th day after sensitization, all mice were induced with different contents by means of intragastric gavage 7 times, 24 h apart. The intestinal microbial flora was detected by culturing the feces. The serum levels of IgE, IL-4, INF-γ and diamine oxidase (DAO) were analyzed by ELISA. The mesenteric lymph nodes (MLN), homogenated tissues of the livers, kidneys and lungs were cultured to determine for bacterial translocation. The number of CD4+CD25+ regulatory T cells (CD4+CD25+ Treg cells) in spleens was measured using flow cytometry.
RESULTS: The levels of IgE(A), DAO(A), IL-4 (51.314 ± 3.785 ng/L vs 69.980 ± 9.103 ng/L, P < 0.05) decreased significantly in Bifidobacterium intervention group compared with those of SEB+OVA group, but the INF-γ increased significantly (194.281 ± 12.144 ng/L vs 133.875 ± 33.822 ng/L, P < 0.05). The number of CD4+CD25+ Treg cells increased significantly in Bifidobacterium intervention group (5.778% ± 0.773% vs 4.216% ± 0.439%, P < 0.05). The numbers of Lactobacillus and Bifidobacterium in Bifidobacterium intervention group increased significantly compared with those of SEB+OVA group (6.670 ± 0.443 vs 5.654 ± 0.289, 8.611 ± 0.295 vs 7.491 ± 0.339, both P < 0.05). In contrast, the numbers of Escherichia col and Bacteroideae in Bifidobacterium intervention group decreased significantly compared with those of SEB+OVA group (5.364 ± 0.537 vs 6.718 ± 0.267, 7.427 ± 0.544 vs 8.606 ± 0.317, both P < 0.05). The frequency of bacteria translocation of MLNs, livers, kidneys and lungs in Bifidobacterium intervention group decreased significantly compared with that of the SEB+OVA group (12.5% vs 37.5%, P < 0.05).
CONCLUSION: Bifidobacterium could coordinate the immunologic function, cure the alteration of intestinal flora, and protect the intestinal tract mucosa barrier function.
- Citation: Zhang LL, Zheng PY, Luo Y, Wang XT, Liu ZQ, Huang H. Influence of Bifidobacterium on gut barrier function and Th1/Th2 cytokine in food allergic mice. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1091-1097
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1091.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1091
随着新型抗生素和疫苗的发展及其在临床上的应用, 感染性疾病的治疗已取得巨大成功, 但是在过去的几十年中, 过敏性疾病却呈现出明显上升趋势[1], 食物过敏在世界上广泛存在, 食物过敏的症状轻者仅表现为轻度不适, 如进食过敏食物后出现呕吐、腹痛、腹泻, 严重者会发热、呕血、便血, 重则表现为威胁生命的过敏性休克[2]. Fuller[3]研究证实摄入益生菌例如乳酸杆菌和双歧杆菌与预防各种过敏性疾病有关. 相关报道提示应用益生菌在调节和控制免疫反应方面的必要性. Herz et al[4], Kim et al[5-6]研究证实益生菌在人和小鼠模型上均有表现出抗过敏的作用. 在种类繁多的益生菌中双歧杆菌作为人类正常肠道的原籍菌群, 极具研究价值. 由于益生菌所独有的生物学特点和肠道黏膜免症反应的特异性, 使肠道益生菌疗法作为治疗食物过敏的一种新疗法, 日益受到重视. 益生菌可能参与调节肠道免疫失衡, 其机制需要进一步研究[7]. 食物过敏是以Th2极化为特征的免疫反应, 然而, 还没有满意的方法来抑制失常的Th2型细胞反应[8]. 抗原特异性CD4+CD25+调节性T细胞(CD4+CD25+ regulatory T cells, CD4+CD25+ T)细胞能够调节失衡的Th1或Th2反应[9]. 人类肠道致敏的起始过程仍不清楚. 可能同时暴露于微生物感染和食物抗原可以协同作用使静息型T细胞分化为抗原特异性Th2型T细胞, 随后损害免疫耐受而导致肠道致敏. 金黄色葡萄球菌通常存在于人体肠道内, 许多证据表明金黄色葡萄球菌肠毒素B(staphylococcal enterotixn B, SEB)与过敏性疾病的发病有关[10], SEB被用作有代表性的微生物产物; 卵清蛋白(ovalbvmin, OVA)因具有可靠的抗原性而被认为是一种理想的食物抗原模型, 经常用于研究食物过敏症和食物抗原相关性炎症. 本文选用SEB+OVA共同作用于BALB/c小鼠构建动物模型, 对其肠道菌群、肠通透性进行全面评价, 探讨在食物过敏中是否存在细菌移位现象并检测其血清IL-4、INF-γ水平, 分析CD4+CD25+Treg细胞的变化. 使用双歧杆菌进行干预, 探讨益生菌在改善食物过敏动物肠道屏障功能、调整肠道菌群结构以及对Th1/Th2免疫反应调节方面的作用及其机制. 思密达是临床常用的治疗腹泻的肠道黏膜保护剂, 我们将思密达和双歧杆菌联合使用, 观察两者在保护肠道黏膜屏障功能有无协同作用.
卵清蛋白(OVA, Sigma公司), 青春型双歧杆菌(由金双歧胶囊分离, 郑州金百合生物工程公司), 思密达蒙脱石散(博福-益普生天津制药公司), 小鼠IgE、IL-4、INF-γ ELISA定量试剂盒(美国ADL公司), 邻连茴香胺(O-dianisidine), 辣根过氧化物酶(peroxidase-horseradish), 盐酸戊二胺(cadaverine dihydrochloride), 二胺氧化酶标准品(diamine oxidase)均为Sigma公司产品. FITC-抗鼠CD4、PE-抗鼠CD25(美国eBioscience公司), SEB由郑州大学生物工程系提供, BALB/c小鼠购于北京维通利华实验动物技术有限公司(合格证号SCXK(京)2007-0001).
1.2.1 动物模型实验: 无受试蛋白喂养BALB/c小鼠40只, 体质量18-22 g, ♀, 随机分为4组: 空白对照组(A)、SEB作用组(B)、OVA作用组(C)、SEB+OVA共同作用组(D), 每组10只. 按照文献[11]方法进行造模, D组小鼠的致敏和激发过程如下:取BALB/c小鼠10只, 第0、3、9天使用10 μg SEB及20 μg OVA无菌生理盐水(NS)溶液0.2 mL ip进行基础致敏; 于第7、14 d以OVA生理盐水溶液0.25 mL(含OVA 20 μg)对D组小鼠进行灌胃激发; A、B、C组小鼠(每组10只)分别以等体积的生理盐水、SEB(10 μg)、OVA(20 μg) ip和OVA ig, 以腹泻为造模成功标志, 如果被致敏小鼠未出现明显腹泻, 可观察处死后小鼠的肠道内容物, 相对于正常小鼠结肠中的球样大便, 水样粪便亦可被视为腹泻. 第15天处死小鼠, 留取血清标本.
1.2.2 益生菌干预实验: 无受试蛋白喂养BALB/c小鼠60只, 体质量18-22 g, ♀, 随机分为6组: 空白对照组(A)、SEB+OVA实验组(D)、自然恢复组(E)、双歧杆菌作用组(F)、思密达作用组(G)、双歧杆菌思密达共同作用组(H), 每组10只. E、F、G、H组按照D组的方法造模, 造模成功后分别予以含以下试剂的溶液0.4 mL ig: 生理盐水、双歧杆菌1×1011 CFU/L、思密达0.6 g/kg、双歧杆菌1×1011 CFU/L+思密达0.6 g/kg, 每天1次, 共7 d, 第8天处死动物, 留取血清标本. 益生菌实验与动物模型实验同时进行, 可不设空白对照组(A)、SEB+OVA共同作用组(D)两组对照.
1.2.3 血清IgE、IL-4、INF-γ、二胺氧化酶(DAO)测定: 造模第15天, 摘眼球取血并处死小鼠. 全血37 ℃静止1 h后, 4 ℃低温离心取血清. 按试剂盒说明进行血清总IgE、IL-4、INF-γ测定, 于酶标仪450 nm处读出A值. 取血清按照黎君有 et al[12]方法使用分光光度计进行血清DAO测定, 436 nm处读出吸光度A值.
1.2.4 流式细胞仪测定脾脏单个核细胞悬液: CD4+CD25+T细胞: 无菌取脾, 置于缚有200目筛网的平皿上细细剪碎, 以预冷的Hank's液收集细胞, 1500 r/min 10 min离心, 弃上清. 取Tris-NHCl4溶液3 mL吹匀细胞, 静置5 min裂解红细胞, 加入PBS缓冲液至10 mL, 1500 r/min 10 min, 弃上清. PBS液洗涤3次, 使用含100 mL/L胎牛血清的RPMI 1640培养液重悬细胞. 调整细胞浓度至(1-2)×106/L. 将FITC-抗鼠CD4 0.2 μL、PE-抗鼠CD25 0.25 μL加入流式样管底部, 加入500 μL(细胞总数为5×105-1×106)细胞悬液混匀, 避光静置30 min后1 mL PBS洗涤2次, 500 μL PBS重悬细胞上机检测.
1.2.5 粪便菌群分析: 造模第15天, 取小鼠新鲜粪便, 制成101-106稀释倍数的混悬液. 分别接种于相应的培养基上培养大肠杆菌(伊红美兰培养基)、类杆菌(Bds培养基)、乳酸杆菌(Lbs培养基)、双歧杆菌(Blb培养基). 大肠杆菌需氧培养24 h, 其余三菌置于厌氧罐中厌氧培养48 h. 根据菌落形态、涂片分析及耐氧实验结果计算各个菌种每克粪便中菌落形成单位(CFU/g) .
1.2.6 细菌移位研究: 小鼠处死后以750 mL/L乙醇浸泡1 h, 于超净台内无菌取肠系膜淋巴结(mesenteric lymph node, MLN)、肝脏、肾脏、肺脏于增菌液中分别进行培养. 需氧35 ℃ 24 h后或厌氧48 h后观察是否有细菌生长. 增菌阳性标本进行涂片观察并分别接种于伊红美兰平板及厌氧基础平板上培养, 24 h或48 h后观察并涂片鉴定. 有大肠杆菌(G-兼性厌氧菌)及类杆菌(G-专性厌氧菌)生长者记为阳性. 移位率 = 阳性器官个数/(小鼠个数×4).
统计学处理 实验结果采用SPSSl3.0统计软件包分析. 组间均数比较选用单因素方差分析, 移位率的比较采用行×列表χ2检验. 采用α = 0.05为假设检验标准.
正常对照组小鼠的平均IgE为0.426±0.249, SEB+OVA实验组的平均IgE为0.634±0.220, SEB+OVA实验组较其他3组对照的平均IgE明显升高, 与正常对照组相比组间有显著性差异(P = 0.044), 双歧杆菌治疗后, 血清总IgE明显下降(P = 0.035, 表1). DAO是一种具有高度活性的细胞内酶, 存在于哺乳类动物的黏膜或绒毛上层, 当小肠黏膜机械屏障受损导致通透性增高时, DAO将释放入血导致外周血中DAO含量升高. 正常对照组小鼠的平均DAO为0.145±9.462E-02, SEB+OVA实验组的平均DAO为0.385±0.186, SEB+OVA实验组较其他3组对照的平均DAO明显升高, 与正常对照组相比组间有显著性差异(P = 0.000), 经双歧杆菌治疗后, 血清DAO含量(A值)明显下降(P = 0.035); 双歧杆菌+思密达组IgE、DAO水平与双歧杆菌组无明显差异(表1).
| 分组 | IgE(A) | DAO(A ) | CD4+CD25+ T细胞(%) |
| 正常对照组 | 0.426±0.249ce | 0.145±9.462E-02ce | 5.969±0.469ce |
| 实验组 | 0.634±0.220a | 0.385±0.186a | 4.216±0.439a |
| 自然恢复组 | 0.629±0.196a | 0.344±0.106a | 4.752±0.875a |
| 双歧杆菌组 | 0.440±0.126ce | 0.157±7.126E-02ce | 5.778±0.773ce |
| 思密达组 | 0.624±0.122a | 0.150±5.984E-02ce | 4.933±0.738a |
| 双歧杆菌+思密达组 | 0.431±0.247ce | 0.137±7.883E-02ce | 5.869±1.793ce |
流式细胞仪测定各组小鼠CD4+CD25+ T细胞占脾脏单个核细胞的百分比, SEB+OVA实验组较其他3组对照的CD4+CD25+ T细胞水平明显降低, 与正常对照组相比组间有显著性差异(4.216%±0.439% vs 5.969%±0.469%, P = 0.000, 图1), 经双歧杆菌治疗后CD4+CD25+T细胞水平明显升高(5.778%±0.773% vs 4.216%±0.439%, P = 0.000); 双歧杆菌+思密达组CD4+CD25+T细胞水平与双歧杆菌组无明显差异(表1).
血清IL-4(ng/L)水平: 正常对照组小鼠的平均IL-4为45.877±2.804, SEB+OVA实验组的平均IL-4为69.980±9.103, SEB+OVA实验组较其他3组对照的平均IL-4明显升高, 与正常对照组相比组间有显著性差异(P = 0.000), 经双歧杆菌治疗后, 血清IL-4含量明显下降(P = 0.000, 表2); 血清INF-γ(ng/L)水平正常对照组小鼠的平均INF-γ为204.018±32.031, SEB+OVA实验组的平均INF-γ为133.875±33.822, SEB+OVA实验组较其他3组对照的平均INF-γ明显下降, 与正常对照组相比组间有显著性差异(P = 0.000), 经双歧杆菌治疗后, 血清INF-γ含量明显升高(P = 0.000); 双歧杆菌+思密达组IL-4、INF-γ水平与双歧杆菌组无明显差异(表2).
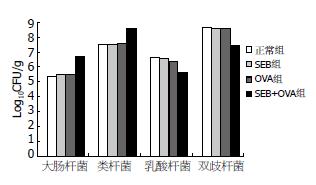
SEB+OVA实验组大肠杆菌(P = 0.000)和类杆菌(P = 0.000)Log10CFU/g较正常对照组的平均值明显升高, 与正常对照组相比组间有显著性差异; SEB+OVA实验组双歧杆菌(P = 0.000)和乳酸杆菌(P = 0.000)的Log10CFU/g较正常对照组的平均值明显下降, 与正常对照组相比组间有显著性差异(图2); 经双歧杆菌治疗后, 大肠杆菌(P = 0.000)和类杆菌(P = 0.000)的Log10CFU/g均明显下降, 双歧杆菌(P = 0.000)和乳酸杆菌(P = 0.000)Log10CFU/g均明显回升; 双歧杆菌+思密达组大肠杆菌、类杆菌、乳酸杆菌、双歧杆菌Log10CFU/g水平与双歧杆菌组无明显差异(表3).
| 分组 | 大肠杆菌 | 类杆菌 | 双歧杆菌 | 乳酸杆菌 |
| 正常对照组 | 5.368±0.329ce | 7.518±0.326ce | 8.706±0.153ce | 6.649±0.231ce |
| 实验组 | 6.718±0.267ae | 8.606±0.317ae | 7.491±0.339ae | 5.654±0.289ae |
| 自然恢复组 | 5.876±0.491ac | 8.053±0.340ac | 7.745±0.334ac | 6.277±0.396ac |
| 双歧杆菌组 | 5.364±0.537ce | 7.427±0.544ce | 8.611±0.295ce | 6.670±0.443ce |
| 思密达组 | 5.465±0.282ce | 7.576±0.318ce | 8.568±0.280ce | 6.639±0.355ce |
| 双歧杆菌+思密达 | 5.392±0.494ce | 7.599±0.376ce | 8.598±0.340ce | 6.691±0.336ce |
食物过敏症和相关疾病在全球范围内迅速增加[13], 大约4%-8%的儿童和1%-2%的成年人对食物抗原具有IgE介导的高反应性[14]. "卫生假设"(hygiene hypothesis)提出幼年时期过少暴露于细菌和病毒等病原体导致对Th1细胞克隆的不充分刺激, 从而不能与Th2细胞克隆的扩增相平衡, 最终导致一种敏感症易患体质[15]. 最近几年有关食物过敏领域的研究进展迅速, 一般认为, 口服耐受的打破或诱导口服耐受失败会导致食物过敏, 口服耐受状态与肠上皮细胞的各组成部分的完整性、树突状细胞(dendritic cell, DC)的提呈作用、CD4+CD25+Treg细胞的作用等因素密切相关[16]. 我们前期研究发现SEB在食物过敏反应中发挥重要作用[17], SEB在免疫调控过程中发挥多方面作用: SEB是一种超抗原, 它可以强有力地诱导能表达特异性TCR Vβ链的T细胞活化增殖和产生细胞因子. 由于益生菌所独有的生物学特点和肠道黏膜炎症反应的特异性, 使肠道益生菌疗法作为治疗食物过敏的一种新兴疗法日益受到人们的重视.
本研究显示食物过敏小鼠肠道内正常菌群发生明显改变, 条件致病菌大肠杆菌、类杆菌的数量高于空白对照组小鼠, 益生菌双歧杆菌、乳酸杆菌数量的则明显减少. 经双歧杆菌治疗后, 肠道内条件致病菌数量下降, 益生菌明显回升. 益生菌可以通过占位效应、营养竞争及其分泌的各种代谢产物及细菌素等抑制条件致病菌的过度生长及外来致病菌的入侵, 维持肠道益生菌生长优势, 维持肠道的微生态平衡[18]. 致敏组小鼠血清DAO结果增高提示FA小鼠小肠通透性增高, 肠道屏障遭到破坏. 研究发现, 当肠黏膜屏障被破坏, 上皮通透性增高时, 食物抗原的经上皮转运会明显加强, 肠道免疫系统对微生物产物和食物大分子抗原摄取增多, 这样会加剧机体对食物抗原的Th2极化, 发生食物过敏[19]. 通过对MLN、肝脏、肾脏、肺脏的细菌培养, 本研究证实了食物过敏过程中细菌移位的存在, MLN更易发生细菌移位. 本实验同时表明, 双歧杆菌能有效治疗细菌移位的发生发展, 说明双歧杆菌能帮助机体清除细菌及毒素.
致敏组小鼠血清IL-4升高、IFN-γ降低, IL-4/IFN-γ比值升高, 说明食物过敏以Th2型细胞占优势, 食物过敏时Th2型细胞活化增加, 产生高水平IL-4, 进而诱导B细胞生成大量sIgE, 并诱发机体产生过敏性炎症反应. 研究[20]发现牛奶过敏儿童血CD4+T细胞数量与对照组无差异, 而产生INF-γ的CD4+ T细胞数量明显减少, 提示在牛奶过敏儿童中CD4+ T细胞表达INF-γ功能低下; 表明机体对食物或环境中的过敏原发生Th2型反应时, 易发生过敏症, 本研究结果与之接近. 本实验发现, 双歧杆菌能有效降低血清IL-4, 抑制增强的Th2反应.
CD4+CD25+T细胞是具有免疫抑制功能的T细胞亚群, 在维持机体内环境的稳定、抗感染、诱导移植耐受及自身免疫性疾病等方面发挥重要作用[21]. 本研究发现致敏小鼠CD4+CD25+T细胞数量显著低于对照组, 证实了CD4+CD25+T细胞的下降有可能打破口服耐受或诱导口服耐受失败, 诱发食物过敏. 体外实验和动物疾病模型均证实, CD4+CD25+T可抑制初始T细胞向Th2型分化[22]. 过敏症患者CD4+CD25+ T细胞的这种抑制作用大大降低[23].
食物过敏时肠道菌群紊乱、肠道屏障功能受损、Th2反应增强, 经双歧杆菌治疗, 上述现象得到有效纠正, 提示我们可以使用益生菌治疗食物过敏. 根据我们前期研究, 食物过敏小鼠存在肠道菌群失调与肠道通透性增高并存的现象[24], 本文中我们将双歧杆菌及思密达联合使用, 结果表明两者均能有效保护肠道屏障功能, 预防及治疗细菌移位, 并减轻食物过敏引起的腹泻等肠道症状, 但两者联合与单独使用双歧杆菌, 小鼠的肠道菌群、细菌移位现象及相关免疫学指标无明显差异, 表明双歧杆菌和思密达之间无协同作用. 结果提示我们应用双歧杆菌可以有效治疗食物过敏, 二者联合使用没有应用意义.
近年来食物过敏和相关疾病在全球范围内迅速增加. 有关食物过敏领域的研究进展迅速, 但其发病机制还不清楚, 其治疗策略仍是以排除致敏食物为主, 但效果欠佳. 由于益生菌如乳酸菌、双歧杆菌等所独有的生物学特点和肠道黏膜炎症反应的特异性, 使肠道益生菌疗法作为治疗食物过敏的一种新兴疗法日益受到人们的重视.
王炳元, 教授, 中国医科大学附属第一医院消化内科.
食物过敏的发生机制尚不清楚, 日前的研究多集中在Th1/Th2细胞失衡与卫生假说、细菌毒素及食物蛋白的共同作用、口服耐受受损等方面. 其中, CD4+CD25+调节性T细胞作为贯穿各个假说的线索备受研究者的关注.
Hirofumi et al研究表明过敏小鼠Th1/Th2异常偏向Th2漂移. 喻晓辉 et al认为, 益生菌能通过调节机体的免疫应答, 使免疫系统处于一个健康和稳定的状态, 抑制过敏的发生.有研究者证实在哮喘等过敏性疾病的动物模型中. CD4+CD25+T细胞的数量显著下降. 诱导口服耐受失败的牛奶过敏儿童的外周血单个核细胞中CD4+CD25+T细胞的数量显著降低.
本文探讨微生物产物和食物抗原协同作用损害肠道免疫耐受和诱导肠道高敏感性的分子机制, 即微生物产生的SEB和食物抗原OVA交互作用于机体的免疫系统, 抑制免疫耐受从而有益于Th2细胞的分化.
双歧杆菌可以有效治疗食物过敏, 其与思密达联合使用没有意义, 提示在临床实践中, 可以使用益生菌治疗食物过敏.
本研究立题新颖, 结果丰富, 结论明确, 具有很好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Herz U, Petschow B. Perinatal events affecting the onset of allergic diseases. Curr Drug Targets Inflamm Allergy. 2005;4:523-529. [PubMed] [DOI] |
| 2. | Sampson HA. Food allergy--accurately identifying clinical reactivity. Allergy. 2005;60 Suppl 79:19-24. [PubMed] [DOI] |
| 3. | Fuller R. Probiotics in man and animals. J Appl Bacteriol. 1989;66:365-378. [PubMed] |
| 4. | Herz U, Lacy P, Renz H, Erb K. The influence of infections on the development and severity of allergic disorders. Curr Opin Immunol. 2000;12:632-640. [PubMed] [DOI] |
| 5. | Kim H, Kwack K, Kim DY, Ji GE. Oral probiotic bacterial administration suppressed allergic responses in an ovalbumin- induced allergy mouse model. FEMS Immunol Med Microbiol. 2005;45:259-267. [PubMed] [DOI] |
| 6. | Kim H, Lee SY, Ji GE. Timing of bifidobacterium administration influences the development of allergy to ovalbumin in mice. Biotechnol Lett. 2005;27:1361-1367. [PubMed] [DOI] |
| 7. | Jonkers D, Stockbrugger R. Review article: Probiotics in gastrointestinal and liver diseases. Aliment Pharmacol Ther. 2007;26 Suppl 2:133-148. [PubMed] |
| 8. | Adel-patient K, Bernard H, Ah-Leung S, Creminon C, Wal JM. Peanut- and cow's milk-specific IgE, Th2 cells and local anaphylactic reaction are induced in Balb/c mice orally sensitized with cholera toxin. Allergy. 2005;60:658-664. [PubMed] [DOI] |
| 9. | Mucida D, Park Y, Kim G, Turovskaya O, Scott I, Kronenberg M, Cheroutre H. Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid. Science. 2007;317:256-260. [PubMed] [DOI] |
| 10. | Kedzierska A, Kaszuba-Zwoinska J, Slodowska-Hajduk Z, Kapinska-Mrowiecka M, Czubak M, Thor P, Wojcik K, Pryjma J. SEB-induced T cell apoptosis in atopic patients--correlation to clinical status and skin colonization by Staphylococcus aureus. Arch Immunol Ther Exp (Warsz). 2005;53:63-70. [PubMed] |
| 11. | Yang PC, Xing Z, Berin CM, Soderholm JD, Feng BS, Wu L, Yeh C. TIM-4 expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy. Gastroenterology. 2007;133:1522-1533. [PubMed] [DOI] |
| 13. | Bischoff S, Crowe SE. Gastrointestinal food allergy: new insights into pathophysiology and clinical perspectives. Gastroenterology. 2005;128:1089-1113. [PubMed] [DOI] |
| 14. | Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects. J Allergy Clin Immunol. 2005;116:153-163. [PubMed] [DOI] |
| 15. | Vandenbulcke L, Bachert C, Van Cauwenberge P, Claeys S. The innate immune system and its role in allergic disorders. Int Arch Allergy Immunol. 2006;139:159-165. [PubMed] [DOI] |
| 16. | Sampson HA. Food allergy--accurately identifying clinical reactivity. Allergy. 2005;60 Suppl 79:19-24. [PubMed] [DOI] |
| 17. | Yang PC, Liu T, Wang BQ, Zhang TY, An ZY, Zheng PY, Tian DF. Rhinosinusitis derived Staphylococcal enterotoxin B possibly associates with pathogenesis of ulcerative colitis. BMC Gastroenterol. 2005;5:28. [PubMed] [DOI] |
| 18. | Vinderola G, Matar C, Perdigon G. Role of intestinal epithelial cells in immune effects mediated by gram-positive probiotic bacteria: involvement of toll-like receptors. Clin Diagn Lab Immunol. 2005;12:1075-1084. [PubMed] |
| 19. | McHugh RS, Shevach EM. The role of suppressor T cells in regulation of immune responses. J Allergy Clin Immunol. 2002;110:693-702. [PubMed] [DOI] |
| 21. | Wiest R, Rath HC. Gastrointestinal disorders of the critically ill. Bacterial translocation in the gut. Best Pract Res Clin Gastroenterol. 2003;17:397-425. [PubMed] |