修回日期: 2009-03-12
接受日期: 2009-03-23
在线出版日期: 2009-04-18
目的: 探讨siRNA干扰Slug基因表达对BxPC-3细胞γ射线敏感性的影响.
方法: 制备携带有绿色荧光蛋白(GFP)报告基因的siRNA-Slug质粒载体, 用脂质体转染法将siRNA-Slug(实验组)、pGCL-GFP(阴性对照)导入BxPC-3细胞(空白对照组), G418筛选阳性细胞, 获得稳定转染的阳性克隆. 将转染载体的BxPC-3阳性克隆细胞和未转染载体的BxPC-3细胞采用60Co γ射线对其进行照射3 Gy. RT-PCR和Western blot检测不同组细胞经γ射线后的Slug、PUMA表达, MTT检测细胞生长抑制, 流式细胞仪(FCM)检测细胞凋亡.
结果: 实验组细胞内Slug基因被有效沉默; 实验组细胞内PUMA蛋白和PUMA mRNA的相对值明显高于对照组(0.98±0.15 vs 0.32±0.08, 1.03±0.16 vs 0.38±0.08, 均P<0.05). 实验组细胞生长抑制率和凋亡率分别高于对照组(37.46%±9.63% vs 2.13%±0.12%, 32.4%±9.5% vs 3.47%±0.18%, 均P<0.05). 实验组细胞受到γ射线作用后, PUMA mRNA和PUMA蛋白表达明显增加, 分别为1.26±0.18和1.23±0.18, 生长抑制率和凋亡率增加, 分别为78.4%±18.5%和73.3%±17.4%, 与射线作用的对照组和阴性对照组比, 差异均有统计学意义(均P<0.01).
结论: siRNA干扰Slug基因后, 解除Slug对PUMA基因的抑制, 增强BxPC-3对γ射线的敏感性.
引文著录: 王齐全, 魏小斌, 郑健超. siRNA干扰Slug基因表达对胰腺癌BxPC-3细胞放射敏感性的影响. 世界华人消化杂志 2009; 17(11): 1079-1084
Revised: March 12, 2009
Accepted: March 23, 2009
Published online: April 18, 2009
AIM: To study the effect of RNA interference (RNAi) on Slug gene mRNA expression and on radiosensitivity of the BxPC-3 cells line of pancreatic cancer.
METHODS: A Slug short hairpin RNA (shRNA) plasmid vector labeled with green fluorescent protein was contructed. siRNA-Slug and pGCL-GFP-were transfected into BxPC-3 cells using Lipofectamine 2000 methods. Stable transfected clony was chosen through G418. BxPC-3 cells were divided into three groups: transfected siRNA-Slug, transfected pGCL-GFP and control group without transfection. BxPC-3 cells (three groups) were treated with 3Gy γ-ray. MTT assay was used to observe the inhibitory actions of γ-ray on BxPC-3 cells. The apoptotic rate of the cells were detected by flow cytometry. The expression of PUMA and Slug was detected by Western blot and RT-PCR.
RESULTS: siRNA-Slug effectively inhibited Slug mRNA and protein expression, induced PUMA mRNA and protein expression (0.98 ± 0.15 vs 0.32 ± 0.08, 1.03 ± 0.16 vs 0.38 ± 0.08, all P < 0.05), and inhibited the proliferation of BxPC-3 cells (37.46% ± 9.63%, P < 0.05), and induced apoptosis (32.4% ± 9.5% vs 3.47% ± 0.18%, P < 0.05). PUMA mRNA and protein expression was significantly up-regulated in siRNA-Slug cells treated with γ-ray (1.26 ± 0.18, 1.23 ± 0.18); apoptosis rate and inhibition rate were significantly increased compared with control groups (73.3% ± 17.4%, 78.4% ± 18.5%).
CONCLUSION: RNA interference (RNAi) on Slug gene enhances the radiosensitivity of the cell line BxPC-3 of pancreatic cancer via eliminating puma gene expression.
- Citation: Wang QQ, Wei XB, Zheng JC. Effect of silencing Slug by RNA interference on the radiosensitivity of the pancreatic cancer BxPC-3 cell line. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1079-1084
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1079.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1079
放射是胰腺癌治疗的重要方法, 但胰腺癌最终会对放射不敏感. 如何提高放射敏感性是胰腺癌研究的一个重要课题. Slug是转录因子家族中编码锌指蛋白的基因, 与肿瘤转移和血管生成密切相关, 并在多数恶性肿瘤中过度表达[1-5]. Wu et al[6]研究报道, Slug显著抑制P53引起的PUMA表达上调, 保护造血祖细胞免受γ-射线损伤. 由于放射通过上调PUMA蛋白发挥促肿瘤细胞凋亡作用的[7], 在Slug表达细胞, Slug可能抵抗放射引发的PUMA上调. 因此, 干扰Slug基因表达后可解除Slug对PUMA的抑制, 增强肿瘤细胞对放射的敏感性. 本实验旨在研究转染靶向抑制Slug表达质粒的胰腺癌BxPC-3细胞是否增强γ射线照射的敏感性.
Western blot和RT-PCR试剂盒(TaKaRa), Lipofectamine 2000, pGCL-GFP(北京本元正阳基因公司), Plasmid Maxi Kit(QIAGEN), XhoⅠ, HpaⅠ, T4 DNA连接酶(NEB公司); PUMA抗体(Cell Signaling), Slug多克隆抗体及G3PDH抗体(Santa Cruz), MTT(Sigma), RPMI 1640培养基, 小牛血清为Gibco公司产品. 其他为国产试剂. 胰腺癌细胞株BxPC-3购自中科院上海细胞所, 细胞用含100 mL/L胎牛血清的RPMR 1640培养基培养, 细胞培养条件为37 ℃恒温, 饱和湿度和50 mL/L CO2, 指数生长的细胞为实验对象.
1.2.1 siRNA的设计及载体插入片断的合成: 根据GenBank中Slug的基因序列, 利用在线设计软件, 按照RNA干扰序列设计原则, 设计三个以G开始、GC含量在30%-50%的19 nt的核苷酸序列作为siRNA靶点. 将选出的序列应用Blast在EST数据库查询, 确认与其他基因无同源序列. 根据上述序列合成55 nt的寡核苷酸链, 5'和3'端分别引入XhoⅠ和HpaⅠ酶切位点, 5'端19 nt编码siRNA正义链, 3'端19 nt与5'端19 nt反向重复, TTTTT为转录终止信号. 将下述序列退火, 然后以12%非变性PAGE凝胶检测双链DNA片段. 具体序列如下: 1: GCAAATGTACCCAATGATA; 2: GCCCTCCTCACAATAGTCT; 3: GACCAATGCAGTACCCAGA; DNA合成片段: Slug-1sense: 5-TGCAAATGTACCCAATGATATTCAAGAGATATCATTGGGTACATTTGCTTTTTTC-3; Slug-1 antisense: 5-TCGAGAAAAAAGCAAATGTACCCAATGATATCTCTTGAATATCATTGGGCATTTGCA-3; Slug-2sense: 5-TGCCCTCCTCACAATAGTCTTTCAAGAGAAGACTATTGTGAGGAGGGCTTTTTTC-3; Slug-2 antisense: 5-TCGAGAAAAAAGCCCTCCTCACAATAGTCTTCTCTTGAAAGACTTGGAGGAGGGCA-3; Slug-3 sense: 5-TGACCAATGCAGTACCCAGATTCAAGAGATCTGGGTACTGCATTGGTCTTTTTTC-3; Slug-3 antisense: 5-TCGAGAAAAAAGACCAATGCAGTACCCAGATCTCTTGAATCTGACTGCATTGGTCA-3.
1.2.2 VshRNA重组质粒载体的构建: 线性化pGCL-GFP载体, 并与DNA合成片段连接, 转化大肠杆菌感受态细胞. 将已知插入片段的载体设为阳性对照以确定含有引物要钓的目的基因的载体作为模板. 上游引物5'-GCCCCGGTTAATTTGCATAT-3', 下游引物5'-GTAATACGGTTATCCACGCG-3'. 连接入vshRNA片段的阳性克隆PCR片段大小为352 bp, 没有连接入vshRNA片段的空载体克隆PCR片段大小为299 bp. 扩增条件: 94 ℃ 30 s; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共30个循环; 72 ℃ 6 min. 产物经15 g/L琼脂糖凝胶10 V/cm电泳, 紫外成像. 取PCR鉴定正确的重组质粒菌液送Invitrogen公司ABI 3730型测序仪进行测序. 测序引物为5'-CAAGGTCGGGCAGGAAGAG-3'. 将测序鉴定正确的重组质粒菌液接种于抗性(Amp)LB培养基中培养, 然后扩大培养于抗性LB中. 利用QIAGEN Plasmid Maxi Kit抽提质粒, 阳性克隆质粒经10 g/L琼脂糖凝胶电泳, 紫外线照相. 取PCR鉴定正确的重组质粒菌液送Invitrogen公司ABI 3730型测序仪进行测序. 测序引物为5'-CAAGGTCGGGCAGGAAGAG-3'.
1.2.3 shRNA功能筛选: 人胰腺癌细胞株BxPC-3常规培养, 待细胞长满培养瓶瓶底70%时用2.5 g/L Trypsin-EDTA消化细胞传代. 按照说明书方法将质粒转染BxPC-3细胞. 转染48 h后细胞按1:4传代, G418筛选稳转细胞, 流式细胞仪检测转染效率. 将实验分为空白对照、阴性对照、鉴定1、鉴定2、鉴定3, 共5组. 其中空白对照是未转染质粒的BxPC-3, 阴性对照是转染空质粒的BxPC-3. 接种48 h后, 待细胞完全贴壁并呈指数生长时, 收集各组细胞行RT-PCR和Western blot检测Slug基因的表达, 以Slug抑制最明显的质粒作为以下的实验.
1.2.4 BxPC-3细胞射线照射: 在室温条件下,将BxPC-3三组细胞(对照组、阴性对照组和实验组)以3 Gy γ射线照射, 之后继续孵箱中培养24 h并行相应的检测.
1.2.5 噻唑蓝(MTT)比色法检测细胞生长抑制率: 2.5 g/L胰蛋白酶消化单层经γ射线照射后已转染病毒的细胞, 然后按照文献方法进行操作[8].
1.2.6 流式细胞仪分析细胞凋亡率: 分别收取γ射线照射后的三组细胞, 用pH7.4的0.01 mol/L PBS洗涤后, 体积分数为700 mL/L冰乙醇4 ℃固定24 h后, 然后按照文献方法检测细胞凋亡率[9].
1.2.7 Western blot检测PUMA及Slug蛋白表达: 按照文献方法[10]提取细胞总蛋白进行Western blot检测.
1.2.8 RT-PCR检测PUMA及Slug mRNA表达: 按TRIzol试剂盒(Invitrogen公司)说明书操作提取药物作用72 h的不同组细胞总RNA,取1 μg RNA模按RT试剂盒(TaKaRa公司)说明书反转录得到cDNA. 引物序列: Slug(241bp)R: 5'-AGA TGCATA TTC GGA CCC ACA-3-3', F: 5'-CCTCAT GTT TGT GCA GGA GAG-3'. PUMA(285 bp): R: 5'-CCTCAT GTT TGT GCA GGA GAG-3', F: 5'-ACA GTA TCT TAC AGG CTG CC-3', G3PDH(500 bp): R: 5'-TCCACCACCCTGT TGCTGTA-3'; F: 5'-ACCACAGTCCATGCCATCAC-3'. 反应条件: 50 ℃ 30 min; 94 ℃ 2 min, 94 ℃ 30 s, 55 ℃ 30 s; 72 ℃ 1 min, 72 ℃延伸7 min, 28循环. 以上引物由赛百盛公司合成. 取5 μL反应产物在含EB的15 g/L琼脂糖凝胶上电泳, 用SYNGENE型凝胶成像系统照相, 以目的基因条带和内参G3PDH条带扫描峰下面积之比作为目的基因的相对表达量[11]. 实验重复3次.
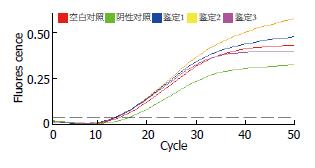
1.2.9 RQ-PCR: 收集约2×106个细胞于1.5 mL的EP管中, 用1×PBS洗涤1次, 总RNA提取、RNA逆转录为cDNA步骤同第一部分. 在MJ DNA Engine OPTICONTM2荧光定量PCR仪检测Slug, GAPDH基因的表达. 按以下公式计算: 相对量 = 2-△C(T), △C(T) = 目的基因C(T)-内参基因C(T). 实验组: 对照组的相对量 = 2-△△C(T), △△C(T) = 实验组△C(T)-对照组△.
统计学处理 采用SAS 9.0统计软件进行统计学处理, 数据以mean±SD表示. 组间均数的比较采用SNK-q检验或配对t检验, 检验水准α = 0.05.
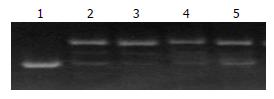
第3-5泳道均可见明显条带, 与双链对照条带在同一水平, 滞后于单链对照条带, 在相当于单链对照水平未见条带, 证明双链退火正确(图1).
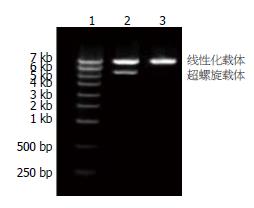
酶切后的载体质粒没有超螺旋形式, 全部为线性化载体, 电泳证实酶切成功(图2).
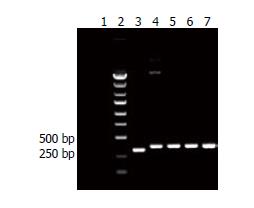
仅加ddH2O的阴性对照未见条带, 加入空载体的阴性对照可见条带, 大小约为300 bp左右, 加入插入片段载体的阳性对照和加入插入vshRNA片段的载体的鉴定组可见条带, 大小约为350 bp左右, 略大于阴性对照的条带. 结论: 编码vshRNA的双链DNA片段已正确插入到pGCL-GFP质粒载体中(只显示Slug-shRNA-1质粒, 其他无列出)(图3).
1-4泳道的条带在7 kb以下, 小于线性化质粒的7.5 kb, 证明抽提出的质粒主要以超螺旋形式存在, 质粒构建成功, 经测序, 序列完全正确(图4).
流式细胞仪检测显示各质粒转染组的转染率均>70%, 可以进行下一步的功能筛选.
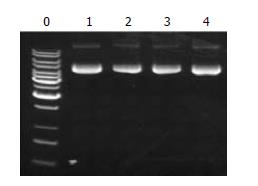
对照组1、2、3 mRNA的表达均有不同程度的抑制(抑制率分别为67.5%、46.8%、47.9%), 其中以鉴定1的抑制最明显(P<0.05, 图5).
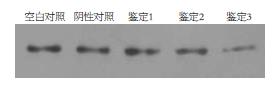
Western blot显示, 相对于空白对照和阴性对照, 鉴定1、2、3蛋白的表达均有不同程度的抑制(抑制率分别为48.8%、18.9%、28.9%), 其中以鉴定1的抑制效果最明显, 差异有统计学意义(P<0.05, 图6).
与γ射线照射的对照组和阴性对照组相比, 实验组(siRNA-Slug)细胞受到γ射线照射后, 细胞的存活率明显降低(P<0.01), 细胞凋亡率明显提高(P<0.01); 而对照组与相应阴性对照组比无明显差异(P>0.05). 与非照射的对照组和阴性对照组相比, 非照射的实验组细胞存活率明显降低(P<0.05), 细胞凋亡率明显提高(P<0.05, 表1).
| 分组 | 抑制率(%) | 凋亡率(%) | Slug(相对值) | PUMA(相对值) | ||
| 蛋白质 | mRNA | 蛋白质 | mRNA | |||
| 对照组 | 2.13±0.12 | 3.47±0.18 | 0.94±0.1 | 1.24±0.14 | 0.32±0.08 | 0.38±0.08 |
| 对照组+放射 | 14.62±2.41 | 13.82±2.60 | 0.95±0.1 | 1.20±0.14 | 0.53±0.09 | 0.51±0.09 |
| 阴性对照 | 2.43±0.17 | 2.50±0.22 | 0.94±0.1 | 1.24±0.13 | 0.30±0.08 | 0.37±0.08 |
| 阴性对照+放射 | 15.80±2.65 | 14.3±3.12 | 0.93±0.1 | 1.23±0.14 | 0.57±0.09 | 0.53±0.09 |
| 实验组 | 37.46±9.63a | 32.4±9.5a | 0.16±0.01a | 0.18±0.06a | 0.98±0.15a | 1.03±0.16a |
| 实验组+放射 | 78.40±18.50b | 73.3±17.4b | 0.17±0.05b | 0.19±0.06b | 1.23±0.18b | 1.26±0.18b |
实验组细胞内Slug蛋白和Slug mRNA表达明显降低, 而PUMA蛋白和PUMA mRNA表达明显升高; 实验组细胞受到γ射线照射后, PUMA蛋白和PUMA mRNA表达升高更明显.
胰腺癌具有隐匿性和高度侵袭性特点, 因此早期即可发生转移, 而胰腺癌早期症状不典型, 确诊时大多已处于晚期. 大多数患者是外科手术不能治愈的, 3年生存率不足10%, 5年生存率低于5%, 迄今为止, 胰腺癌仍然是临床治疗最为困难的消化系恶性肿瘤之一[12-14]. 放射是胰腺癌治疗的重要方法, 但除放射的不良反应外, 胰腺癌最终会对放射不敏感. 如何提高放射敏感性是胰腺癌研究的一个重要课题.
Slug是转录因子SNAIL家族中编码锌指蛋白的基因, 一般在背部神经管表达, 参与神经胚的形成和神经干的正常发育有关[15]. Wu et al[6]最近发现, 缺失Slug蛋白的小鼠, 对γ-射线非常敏感, 很快死于造血祖细胞的耗竭, 把PUMA基因从缺失Slug的小鼠中剔除后, 这些小鼠就重新拥有了对γ-射线的抵抗力, 他们体内的造血系统也能恢复正常工作. 进一步研究证明, Slug保护γ-射线引起的细胞损伤是由于Slug抑制P53引起的PUMA表达上调有关.
由于放射治疗可通过上调PUMA促进细胞凋亡, 因此, 在Slug高表达的细胞, Slug可对抗PUMA的作用[16], 因此干扰Slug表达可增强放射治疗效果. 由于大多数肿瘤细胞存在Slug过度上调, 因此, 表达Slug的细胞可以对抗放射治疗引起的PUMA上调, 降低细胞对放射治疗的敏感性. RNA干扰(RNA interference, RNAi)技术由于可以高效、特异地抑制目的基因的表达, 在肿瘤靶向治疗中展示出了其不可比拟的优势, 具有巨大的潜在应用价值[17-23].
基于上述理论, 我们利用干扰技术成功构建了携带编码靶向Slug的小发夹状干扰RNA的三种真核表达质粒. 其中编码1号序列的真核表达质粒稳定转染人胰腺癌细胞株BxPC-3后产生的小片段干扰RNA抑制Slug mRNA和蛋白表达最显著, 该序列为有效序列.
本研究通过干扰技术抑制Slug基因表达后, BxPC-3细胞内的PUMA蛋白和mRNA表达明显升高, 细胞存活率下降, 细胞凋亡率明显提高, 提示抑制SLUG可解除对PUMA的抑制作用, 发挥PUMA的生长抑制作用. 实验还发现: 细胞经过放射作用后, PUMA在不同细胞中表达增加, 而在经过放射作用的实验组细胞, PUMA增加更加明显, 与经过放射作用的对照组比有明显的差异, 与此同时, 细胞生存率在经过放射作用的实验组下降最明显. 所以, 干扰细胞内Slug表达后, 可解除Slug对PUMA的抑制, 增加放射引起的PUMA表达, 增加细胞对放射治疗的敏感性.
本研究显示Slug干扰与放射治疗结合, 提高胰腺癌细胞的放射治疗敏感性, 这为胰腺癌的基因治疗与放射治疗提供了实验基础.
放射可引起Slug基因表达的增加,而后者明显引起PUMA表达的抑制. PUMA增强胰腺癌对放射的敏感性. 因此, 干扰Slug基因表达后可解除Slug对PUMA的抑制, 增强肿瘤细胞对放射的敏感性.
魏经国, 教授, 中国人民解放军第四军大学唐都医院放射科.
放射是胰腺癌治疗的重要方法, 如何提高放射敏感性是胰腺癌研究的一个重要课题.
Wu et al最近发现, 缺失Slug蛋白的小鼠, 对γ-射线非常敏感, 很快死于造血祖细胞的耗竭, 把PUMA基因从缺失Slug的小鼠中剔除后, 这些小鼠就重新拥有了对γ-射线的抵抗力, 他们体内的造血系统也能恢复正常工作.
本研究显示Slug干扰与放射治疗结合, 提高胰腺癌细胞的放射治疗敏感性, 这为胰腺癌的基因治疗与放射治疗提供了实验基础.
本研究立题较好, 实验设计较完善, 结果可信, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Hajra KM, Chen DY, Fearon ER. The SLUG zinc-finger protein represses E-cadherin in breast cancer. Cancer Res. 2002;62:1613-1618. [PubMed] [DOI] |
| 2. | Tripathi MK, Misra S, Chaudhuri G. Negative regulation of the expressions of cytokeratins 8 and 19 by SLUG repressor protein in human breast cells. Biochem Biophys Res Commun. 2005;329:508-515. [PubMed] [DOI] |
| 3. | Martin TA, Goyal A, Watkins G, Jiang WG. Expression of the transcription factors snail, Slug, and twist and their clinical significance in human breast cancer. Ann Surg Oncol. 2005;12:488-496. [PubMed] [DOI] |
| 4. | Uchikado Y, Natsugoe S, Okumura H, Setoyama T, Matsumoto M, Ishigami S, Aikou T. Slug Expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma. Clin Cancer Res. 2005;11:1174-1180. [PubMed] |
| 5. | Shioiri M, Shida T, Koda K, Oda K, Seike K, Nishimura M, Takano S, Miyazaki M. Slug expression is an independent prognostic parameter for poor survival in colorectal carcinoma patients. Br J Cancer. 2006;94:1816-1822. [PubMed] [DOI] |
| 6. | Wu WS, Heinrichs S, Xu D, Garrison SP, Zambetti GP, Adams JM, Look AT. Slug antagonizes p53-mediated apoptosis of hematopoietic progenitors by repressing puma. Cell. 2005;123:641-653. [PubMed] [DOI] |
| 7. | Wang R, Wang X, Li B, Lin F, Dong K, Gao P, Zhang HZ. Tumor-specific adenovirus-mediated PUMA gene transfer using the survivin promoter enhances radiosensitivity of breast cancer cells in vitro and in vivo. Breast Cancer Res Treat. 2008; Sep 13. [Epub ahead of print]. [PubMed] |
| 10. | 张 克君, 李 德春, 朱 东明. PUMA基因转染胰腺癌AsPC-1细胞增强对5-FU致凋亡的敏感性. 中国肿瘤生物治疗杂志. 2008;15:139-141. |
| 11. | 张 克君, 李 德春. p53正向凋亡调节因子(PUMA)重组腺病毒载体的构建及对体内外胰腺癌的作用. 中华微生物学和免疫 学杂志. 2009;25:12-15. |
| 12. | Löhr JM. Medical treatment of pancreatic cancer. Expert Rev Anticancer Ther. 2007;7:533-544. [PubMed] [DOI] |
| 13. | Flandin I, Mornex F, Claude L, Kubas A, Khodri M, Wautot V, Mazeron R, Partensky C. [Chemoradiation for pancreatic adenocarcinoma]. Cancer Radiother. 2004;8 Suppl 1:S80-S87. [PubMed] |
| 14. | Yeh JJ, Der CJ. Targeting signal transduction in pancreatic cancer treatment. Expert Opin Ther Targets. 2007;11:673-694. [PubMed] [DOI] |
| 15. | Bolós V, Peinado H, Pérez-Moreno MA, Fraga MF, Esteller M, Cano A. The transcription factor Slug represses E-cadherin expression and induces epithelial to mesenchymal transitions: a comparison with Snail and E47 repressors. J Cell Sci. 2003;116:499-511. [PubMed] [DOI] |
| 16. | Vannini I, Bonafe M, Tesei A, Rosetti M, Fabbri F, Storci G, Ulivi P, Brigliadori G, Amadori D, Zoli W. Short interfering RNA directed against the SLUG gene increases cell death induction in human melanoma cell lines exposed to cisplatin and fotemustine. Cell Oncol. 2007;29:279-287. [PubMed] |
| 17. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 18. | Nykanen A, Haley B, Zamore PD. ATP requirements and small interfering RNA structure in the RNA interference pathway. Cell. 2001;107:309-321. [PubMed] [DOI] |
| 19. | Sijen T, Fleenor J, Simmer F, Thijssen KL, Parrish S, Timmons L, Plasterk RH, Fire A. On the role of RNA amplification in dsRNA-triggered gene silencing. Cell. 2001;107:465-476. [PubMed] [DOI] |
| 20. | Gong H, Liu CM, Liu DP, Liang CC. The role of small RNAs in human diseases: potential troublemaker and therapeutic tools. Med Res Rev. 2005;25:361-381. [PubMed] [DOI] |
| 21. | van Noesel MM, Versteeg R. Pediatric neuroblastomas: genetic and epigenetic 'danse macabre'. Gene. 2004;325:1-15. [PubMed] [DOI] |
| 22. | Filleur S, Courtin A, Ait-Si-Ali S, Guglielmi J, Merle C, Harel-Bellan A, Clézardin P, Cabon F. SiRNA-mediated inhibition of vascular endothelial growth factor severely limits tumor resistance to antiangiogenic thrombospondin-1 and slows tumor vascularization and growth. Cancer Res. 2003;63:3919-3922. [PubMed] |
| 23. | Verma UN, Surabhi RM, Schmaltieg A, Becerra C, Gaynor RB. Small interfering RNAs directed against beta-catenin inhibit the in vitro and in vivo growth of colon cancer cells. Clin Cancer Res. 2003;9:1291-1300. [PubMed] |