修回日期: 2009-03-20
接受日期: 2009-03-23
在线出版日期: 2009-04-18
目的: 探讨脂肪间质干细胞经门静脉及尾静脉移植后, 对CCl4诱导的大鼠肝硬化模型的治疗作用.
方法: SD♂大鼠45只随机分为对照组、门脉移植组及尾静脉移植组. 所有大鼠经腹腔皮下注射CCl4混合物8 wk. 第6周时门静脉组及尾静脉组分别从肠系膜上静脉及尾静脉注射大鼠脂肪间质干细胞悬液每只2 mL(细胞数量为2×106个), 对照组自尾静脉注射等容量的细胞培养液. 细胞移植前后取血检测肝功能指标. 取肝脏标本并行包埋切片, HE染色后显微镜下观察各标本肝细胞变性坏死及肝硬化程度并进行病理评分. 对所有实验数据行统计学分析.
结果: 门静脉及尾静脉移植组大鼠的肝功能指标(AST、ALT、ALB)较对照组有明显改善(142.2±31.2 U/L, 167.9±28.3 U/L vs 354.2±26.4 U/L; 79.4±18.9 U/L, 85.8±21.4 U/L vs 456.7±35.3 U/L; 26.3±2.0 g/L, 24.5±2.2 g/L vs 17.2±1.7 g/L, 均P<0.05), 但TBIL没有明显改善. 与对照组相比, 脂肪干细胞移植能抑制肝组织的变性坏死和纤维化形成. 病理评分对比差异有统计学意义(P<0.05).
结论: 经门静脉及尾静脉移植脂肪间质干细胞对大鼠肝硬化模型有治疗作用, 能改善肝功能及肝硬化程度.
引文著录: 谭国胜, 向贤宏, 王于, 范文哲, 陈伟, 杨建勇. 脂肪间质干细胞移植对大鼠肝硬化模型的治疗作用. 世界华人消化杂志 2009; 17(11): 1074-1078
Revised: March 20, 2009
Accepted: March 23, 2009
Published online: April 18, 2009
AIM: To evaluate the therapeutic effect of adipose tissue-derived mesenchymal stem cells transplanted through caudal or portal vein for the hepatic cirrhosis model of rats induced by CCl4.
METHODS: Forty-five healthy SD rats were randomly divided into control group, portal-vein group and caudal-vein group. All rats were subcutaneously injected carbon tetrachloride oily mixture continuously for 8 weeks. At the sixth week, portal-vein group and caudal-vein group were transplanted with rat adipose tissue-derived mesenchymal stem cells 2×106 each rat, respectively from superior mesenteric vein and caudal vein. The control group was injected isometric cell culture media. Liver function of rat was examined before and after cell transplantation. HE staining was performed on all liver specimen slices. The degeneration and necrosis of hepatic cells and the degree of liver fibrosis were observed under microscope, and further pathological evaluation was made according to observation results. All experiment data were analyzed by statistics.
RESULTS: The liver function of portal-vein group and caudal-vein group was improved significantly in comparison with that of control group (AST: 142.2 ± 31.2 U/L, 167.9 ± 28.3 U/L vs 354.2 ± 26.4 U/L; ALT: 79.4 ± 18.9 U/L, 85.8 ± 21.4 U/L vs 456.7 ± 35.3 U/L; ALB: 26.3 ± 2.0 g/L, 24.5 ± 2.2 g/L vs 17.2 ± 1.7 g/L, all P < 0.05), but the level of TBIL wasn't improved. The transplantation of adipose tissue-derived mesenchymal stem cells inhibited the degeneration and necrosis of hepatic tissue and improved liver fibrosis of the rats. The difference of pathological evaluation between cell-transplanted group and control group was statistically significant (P < 0.05).
CONCLUSION: The transplantation of adipose tissue-derived mesenchymal stem cells through portal and caudal vein has therapeutic effect for the hepatic cirrhosis model of rats. It can improve liver function and inhibit liver fibrosis.
- Citation: Tan GS, Xiang XH, Wang Y, Fan WZ, Chen W, Yang JY. Therapeutic effect of adipose tissue-derived mesenchymal stem cells transplantation for rat model of hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1074-1078
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1074.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1074
目前有众多文献报道[1-5], 从人和动物脂肪组织中可分离得到脂肪间质干细胞(adipose tissue-derived mesenchymal stem cells, ADMSCs). 在一定培养条件下, ADMSCs表现出与骨髓间质干细胞相类似的分化能力. 国内外有研究表明[6-9], 在适合的条件下, ADMSCs可在体外被诱导分化成形态、表型及功能与肝细胞相似的细胞. 目前对ADMSCs的研究主要集中在体外基础实验上, 而对其在活体肝硬化模型的应用研究则鲜有报道. 本文旨在通过将ADMSCs移植至活体肝硬化大鼠中, 以探索其对肝硬化的治疗作用.
含100 mL/L胎牛血清的DMEM (dulbecco's modified eagle's medium)培养液(100 mL/L FBS+DMEM), 磷酸盐缓冲液(PBS), 100 g/L胰酶消化液, 倒置相差显微镜, CD44、CD29及CD45单克隆抗体试剂盒.
1.2.1 ADMSCs的分离培养: 无菌条件下从健康SD大鼠获取其腹股沟皮下脂肪组织, 剪碎加入1 g/L胶原酶消化, 振荡摇匀. 下层液体用筛网过滤, 滤液以800 r/min离心3 min, 沉积的细胞用培养基制成混合均匀的细胞悬液, 再加入红细胞裂解液并重新悬浮, 静止15 min后再次离心以充分去除残余杂质. 弃去上清后加入含100 mL/L FBS的DMEM培养液, 吹打均匀并接种于培养皿中, 37 ℃, 50 mL/L CO2孵箱中培养24 h. 24 h后首次换液, 未贴壁细胞和残渣被清除, 新鲜培养液加至贴壁细胞, 后每2-3 d换液1次. 待细胞增殖融合至培养皿底80%时, 胰酶消化按1:1比例传代. 取第三代细胞, 用免疫荧光染色方法检测ADMSCs相对特异细胞表面标志CD44、CD29及CD45. 将第3-5代所得贴壁细胞制成细胞悬液, 标定浓度1.0×106, 每试管2 mL, 置于孵箱中以备动物细胞移植用.
1.2.2 肝硬化大鼠模型制备: SD♂大鼠45只, 体质量200-250 g, 随机分3组(对照组、门脉移植组及尾静脉移植组), 每组15只. CCl4与食用石蜡油按1:1混合配成500 mL/L的CCl4溶液, 以2 mL/kg剂量从大鼠右侧腹部皮下注射, 每周2次, 共注射8 wk. 第8周后停止诱导大鼠肝损伤处理.
1.2.3 ADMSCs移植治疗: CCl4诱导肝损伤后第6周, 门静脉组大鼠用100 mg/L水合氯醛1 mL腹腔注射麻醉, 取腹部正中切口3 cm, 分离肠系膜上静脉, 用26G细针穿刺血管, 确定针头于血管内后将备用的大鼠ADMSCs悬液2 mL(细胞数量为2×106)缓慢注入血管内. 拔除细针, 穿刺点敷以明胶海绵止血后关腹. 尾静脉组大鼠从尾静脉注入同量ADMSCs悬液. 对照组则经尾静脉注射等量的细胞培养液.
1.2.4 肝功能指标的检测: 细胞移植治疗前(注射CCl4后第6周)各组别大鼠从尾静脉取血1.5-2 mL, 细胞移植治疗后6 wk处死动物时从右心室取血2-3 mL. 所取血液注入肝素抗凝管. 在生化自动分析仪上检测治疗前后各组大鼠血浆中天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)及总胆红素(TBIL)的水平, 并对结果行统计学分析.
1.2.5 组织病理学检查: 细胞移植治疗后4 wk处死所有大鼠, 取出肝脏, 生理盐水冲洗后对肝脏整体进行检查, 观察肝硬化大体标本情况. 标本用100 g/L甲醛溶液固定72 h, 石蜡包埋切片, 常规HE染色. 光学显微镜下观察各组标本肝假小叶形成及肝细胞坏死情况, 并参照文献对纤维化程度、肝细胞坏死及脂肪变性程度进行病理分级评分. 肝细胞坏死程度分级: 0分为无, 1分为少量, 2分为轻度, 3分为中度, 4分为重度; 纤维化分级: 正常肝脏0级; 胶原增多而无间隔形成为1级; 不完全间隔形成为2级; 完全间隔形成(假小叶形成)但间隔较细为3级; 较厚的完全间隔形成, 假小叶明显为4级; 脂肪变性评分: 0分, 无脂肪变性; 1分, 有少量脂肪变细胞; 2分, 脂肪变性占小叶比例<1/3; 3分, 脂肪变性占小叶比例1/3-2/3; 4分脂肪变性占小叶比例>2/3. 对病理分级评分行统计学分析.
统计学处理 数据以mean±SD表示, 以SPSS11.0软件进行统计学分析, 两组间样本均数比较采用T检验.
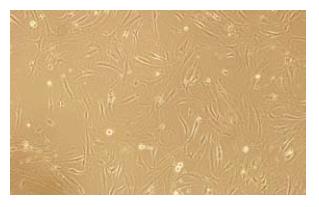
分离所得细胞种植入培养皿48 h后, 有梭形细胞贴壁, 细胞形态不一, 有短突起, 细胞核居中. 3-5 d后, 细胞生长旺盛, 显微镜下细胞呈梭形融合聚集, 紧密排列有一定方向性, 呈螺旋状(图1). 常规免疫荧光染色显示细胞CD29、CD44均为阳性, CD45为阴性.
对照组、门脉组及尾静脉组于诱导肝损伤制备肝硬化模型过程中, 动物死亡只数分别为2、1、2; 干细胞移植治疗过程顺利, 门脉组大鼠于细胞移植后1、2 d各死亡1只; 其余的大鼠处死解剖前均未出现死亡.
对照组及尾静脉组大鼠肝脏质地较硬, 肝叶不同程度萎缩变小, 肝脏颜色灰暗, 表面可见大小不等的硬化节结分布, 节结形成以对照组尤为明显; 门脉组肝脏标本肝脏边缘变钝, 表面纹理增粗, 局部可见细小颗粒样突起, 节结形成较前两组明显减少(图2).
细胞移植前各组别大鼠肝功能指标(AST、ALT、ALB及TBIL)差异无统计学意义(P>0.05). 细胞移植后6 wk, 门静脉组、尾静脉组分别与对照组作统计学对比, 其肝功能指标(AST、ALT、ALB)差异有统计学意义(P<0.05), 而TBIL各组别间差异无统计学意义(P>0.05). 细胞移植组大鼠AST、ALT较对照组有明显降低; 而ALB的表达水平较对照组增高. 门脉组与尾静脉组间肝功能各指标差异均无统计学意义(P>0.05, 表1).
| 分组 | 治疗前 | 治疗后 | ||||||
| AST(U/L) | ALT(U/L) | ALB(g/L) | TBIL(μmol/L) | AST(U/L) | ALT(U/L) | ALB(g/L) | TBIL(μmol/L) | |
| 对照组 | 398.2±29.7 | 603.4±58.6 | 18.6±2.0 | 14.3±2.2 | 354.2±26.4 | 456.7±35.3 | 17.2±1.7 | 15.3±3.1 |
| 门脉组 | 371.5±25.7 | 617.6±64.6 | 20.1±1.8 | 16.0±1.9 | 142.2±31.2 | 79.4±18.9 | 26.3±2.0 | 17.1±2.5 |
| 尾静脉组 | 401.2±28.3 | 598.9±61.5 | 19.1±2.1 | 15.2±2.3 | 167.9±28.3 | 85.8±21.4 | 24.5±2.2 | 15.9±3.0 |
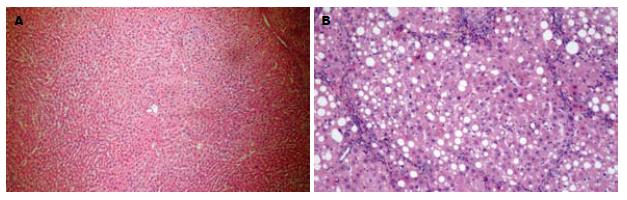
对照组肝脏标本显微镜下可见重度纤维化, 纤维间隔粗厚, 假小叶形成明显; 肝细胞不同程度变性及坏死, 胞质疏松化, 并可见多量透明脂肪液滴分布, 肝细胞脂肪变性占小叶比例2/3以上. 与对照组相比, 尾静脉组大鼠肝脏呈中度纤维化, 亦可假小叶形成, 但平均视野下数量较对照组少, 细胞变性及脂肪变也较前者轻微. 门脉组大鼠肝脏纤维化程度最轻, 仅见少至中量不完全间隔形成, 平均视野下假小叶的数量亦最少, 细胞变性及脂肪变的程度也是三者中最轻. 光镜下仍可见有正常肝脏组织结构分布(图3). 结果表明, 细胞移植组较对照组在肝纤维化、肝细胞变性坏死及脂肪变等方面均有不同程度改善, 其组织病理学评分差异有统计学意义(P<0.05). 其中又以门脉组的改善程度较大, 肝纤维化表现为三组中最轻(表2).
| 分组 | n | 肝纤维化 | 肝细胞变性坏死 | 脂肪变性 |
| 对照组 | 13 | 3.50±0.31 | 2.25±0.23 | 3.52±0.38 |
| 门脉组 | 12 | 1.68±0.25 | 1.27±0.20 | 1.68±0.27 |
| 尾静脉组 | 13 | 2.46±0.29 | 1.34±0.25 | 1.14±0.23 |
肝硬化在我国为常见肝脏疾病, 虽然近年临床上在肝硬化的多学科综合治疗方面已取得长足的进步, 但肝硬化患者的总体生存率并没得以显著提高. 原位肝移植虽已成为终末期肝病最理想的治疗选择, 但因供体肝脏紧缺, 移植后免疫排斥反应及高昂的医疗费用等限制了其临床上的广泛应用[10]. 干细胞移植作为肝硬化治疗的一个新研究方向, 已有大量的基础实验支持和相应的临床实践经验, 具有广阔的发展前景[11].
目前, 在干细胞移植治疗肝硬化及慢性肝病的研究中, 大部分文献集中在对骨髓间质干细胞(bone marrow mesenchymal stem cells, BMSCs). 诸多实验研究表明[12-15], 将BMSCs移植入肝硬化的动物中, 细胞能以较大比例种植于肝脏, 最终分化成功能性肝细胞, 表达ALB和某些肝细胞特异性分子标志物, 并有效改善动物的肝损害程度和抑制纤维化的形成. 在临床应用方面, 国内有学者[16-17]将从肝硬化患者身上分离纯化的BMSCs移植至肝脏, 术后患者的肝功能、凝血功能及一般情况均得以不同程度改善, 证实了自体BMSCs肝内移植对肝硬化患者可起到一定的肝脏支持及减轻肝损症状的作用, 同时未见严重不良反应和并发症发生.
自Zuk et al[1]于2001年首次从人脂肪组织中分离出ADMSCs以来, 几个研究小组又先后证实了这些细胞在合适诱导剂的作用下可向成骨、软骨、脂肪和成肌等细胞分化, 表现出与BMSCs相类似的多向分化潜力[2-5]. 近年来, 国内刘美媛、刘展 et al研究表明ADMSCs在体外用肝细胞生长因子及成纤维细胞生长因子诱导, 可定向分化为肝细胞样细胞, 并表达ALB、AFP及CK18、CK19等[8-9]. 同时, 较之BMSCs, ADMSCs有获取容易、获取量大、可反复取材, 体外培养细胞增殖快、衰老缓慢等优势[18]. 故ADMSCs已成为干细胞移植治疗慢性肝病又一颇具发展前景的待选细胞.
本研究将大鼠ADMSCs通过门脉及尾静脉移植至CCl4诱导的肝硬化大鼠中, 结果表明, 细胞移植组动物肝功能损害程度较对照组明显降低, ALB表达水平升高. 而病理评分也表明移植组的肝纤维化程度较对照组轻微, 门脉组肝假小叶形成不明显. 实验数据证明ADMSCs能有效改善肝硬化动物模型的肝功能, 并在一定程度上抑制肝纤维化进程. 实验结果提示移植细胞有可能部分定植于肝脏, 在肝内微环境和某些因子共同作用下分化成具有功能的肝细胞样细胞, 参与肝脏代谢和肝组织的结构重建. 对于干细胞在体内如何起到抗肝纤维化作用, 其机制至今尚未明确. 有文献认为是多因素作用[19-21], 主要包括两方面: 一是通过干细胞分化为功能性肝细胞, 促进肝再生; 二是干细胞通过直接诱导肝星状细胞凋亡或抑制其激活, 分泌抗纤维化物质如肝细胞生长因子、粒细胞集落刺激因子、基质金属蛋白酶-9等减少胶原沉积和羟脯氨酸含量, 从而抑制肝组织纤维化的形成.
本实验分别通过门静脉及尾静脉途径移植干细胞, 实验结果表明门脉组的肝细胞变性及肝纤维化程度更轻微, 提示门脉组的治疗效果较尾静脉组稍有优势. 其原因可能有以下两方面: (1)通过外周静脉移植干细胞, 在细胞数量相同的条件下, 到达肝脏且能定植的细胞较门脉移植途径要少, 部分细胞可分布于脾脏、肺等器官[22], 因而参与肝脏修复的有效细胞数目较少; (2)通过门脉途径移植细胞, 细胞循门脉血管系统定植, 于肝内分布更均匀, 更接近正常肝索的分布模式, 同时门脉血流较慢, 移植细胞于肝内停留相对容易. 而门脉相对较粗大, 因细胞移植堵塞血管的发生率很低. 因此我们认为经门静脉移植的方式更有效发挥干细胞的治疗作用.
本实验仅为初步研究, 对于ADMSCs在肝内如何定植分布、细胞增殖分化情况及如何表达功能等一系列问题仍未有涉及. 但实验结果至少提示, ADMSCs移植对肝硬化动物模型具有一定的治疗作用. 对于目前尚未解决的问题, 后续的进一步实验探索具有较大的研究价值.
脂肪间质干细胞目前已有较多的体外实验研究, 表明其可向多种体细胞方向分化. 但关于其在动物模型中的应用研究仍处在起步阶段. 本文旨在研究脂肪间质干细胞对肝硬化动物模型的治疗作用.
肖恩华, 教授, 中南大学湘雅二医院放射教研室.
脂肪间质干细胞在体内的分化、功能表达及作用机制等一系列问题是该领域热点.
本研究通过不同途径移植脂肪间质干细胞治疗肝硬化动物模型, 并通过检测肝功能变化及进行病理评分, 比较其疗效有无差异.
本文研究结果提示脂肪干细胞移植对缓解动物肝硬化程度, 改善肝功能有一定作用. 为下一步深入研究其作用机制及将来的临床应用提供初步实验证据.
本研究设计合理, 结果可靠, 对进一步研究有重要参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001;7:211-228. [PubMed] [DOI] |
| 2. | Huang JI, Beanes SR, Zhu M, Lorenz HP, Hedrick MH, Benhaim P. Rat extramedullary adipose tissue as a source of osteochondrogenic progenitor cells. Plast Reconstr Surg. 2002;109:1033-1041; discussion 1042-1043. [PubMed] [DOI] |
| 3. | Rangappa S, Fen C, Lee EH, Bongso A, Sim EK. Transformation of adult mesenchymal stem cells isolated from the fatty tissue into cardiomyocytes. Ann Thorac Surg. 2003;75:775-779. [PubMed] [DOI] |
| 4. | Aust L, Devlin B, Foster SJ, Halvorsen YD, Hicok K, du Laney T, Sen A, Willingmyre GD, Gimble JM. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 2004;6:7-14. [PubMed] [DOI] |
| 5. | Seo MJ, Suh SY, Bae YC, Jung JS. Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo. Biochem Biophys Res Commun. 2005;328:258-264. [PubMed] [DOI] |
| 6. | Taléns-Visconti R, Bonora A, Jover R, Mirabet V, Carbonell F, Castell JV, Gómez-Lechón MJ. Human mesenchymal stem cells from adipose tissue: Differentiation into hepatic lineage. Toxicol In Vitro. 2007;21:324-329. [PubMed] [DOI] |
| 7. | Banas A, Teratani T, Yamamoto Y, Tokuhara M, Takeshita F, Quinn G, Okochi H, Ochiya T. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes. Hepatology. 2007;46:219-228. [PubMed] [DOI] |
| 10. | Thalheimer U, Capra F. Liver transplantation: making the best out of what we have. Dig Dis Sci. 2002;47:945-953. [PubMed] [DOI] |
| 11. | Kania G, Blyszczuk P, Jochheim A, Ott M, Wobus AM. Generation of glycogen- and albumin-producing hepatocyte-like cells from embryonic stem cells. Biol Chem. 2004;385:943-953. [PubMed] [DOI] |
| 12. | Luk JM, Wang PP, Lee CK, Wang JH, Fan ST. Hepatic potential of bone marrow stromal cells: development of in vitro co-culture and intra-portal transplantation models. J Immunol Methods. 2005;305:39-47. [PubMed] [DOI] |
| 13. | Ishikawa T, Terai S, Urata Y, Marumoto Y, Aoyama K, Sakaida I, Murata T, Nishina H, Shinoda K, Uchimura S. Fibroblast growth factor 2 facilitates the differentiation of transplanted bone marrow cells into hepatocytes. Cell Tissue Res. 2006;323:221-231. [PubMed] [DOI] |
| 14. | Zhan YT, Wei L, Chen HS, Cong X, Fei R, Wang Y. [Differentiation of bone marrow stem cells in rat hepatic fibrogenesis environment]. Zhonghua Ganzangbing Zazhi. 2003;11:673-675. [PubMed] [DOI] |
| 15. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Systemic infusion of FLK1(+) mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Transplantation. 2004;78:83-88. [PubMed] [DOI] |
| 16. | 姚 鹏, 王 帅, 胡 大荣, 闻 炜, 周 一鸣, 龚 丽娟. 肝动脉自体骨髓干细胞移植治疗失代偿期肝硬化30例. 世界华人消化杂志. 2005;13:1639-1640. [PubMed] [DOI] |
| 17. | 朱 康顺, 单 鸿, 何 可可, 李 征然, 关 守海, 黄 明声, 钱 结胜, 庞 鹏飞, 姜 在波. 自体骨髓干细胞肝内移植治疗失代偿期肝硬化的初步临床观察. 中国医学影像技术. 2007;23:1863-1865. |
| 18. | Guilak F, Lott KE, Awad HA, Cao Q, Hicok KC, Fermor B, Gimble JM. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. J Cell Physiol. 2006;206:229-237. [PubMed] [DOI] |
| 19. | Yannaki E, Athanasiou E, Xagorari A, Constantinou V, Batsis I, Kaloyannidis P, Proya E, Anagnostopoulos A, Fassas A. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs. Exp Hematol. 2005;33:108-119. [PubMed] [DOI] |
| 20. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] [DOI] |
| 21. | Takeda M, Yamamoto M, Isoda K, Higashiyama S, Hirose M, Ohgushi H, Kawase M, Yagi K. Availability of bone marrow stromal cells in three-dimensional coculture with hepatocytes and transplantation into liver-damaged mice. J Biosci Bioeng. 2005;100:77-81. [PubMed] [DOI] |