修回日期: 2009-02-27
接受日期: 2009-03-02
在线出版日期: 2009-04-08
目的: 构建真核表达载体pEGFP-N1-FADD并检测其在结肠癌细胞株SW480中的表达.
方法: 设计人FADD特异性引物, 从人结肠癌细胞SW480细胞提取总RNA, 通过RT-PCR方法获取人FADD全长cDNA, 定向克隆至真核表达载体pEGFP-N1. 应用PCR、酶切和DNA测序进行鉴定, 确认后转染人结肠癌细胞SW480. G418抗性筛选获得FADD稳定表达细胞克隆, 应用Western blot检测FADD的表达水平.
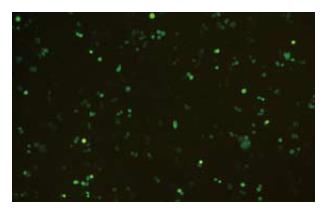
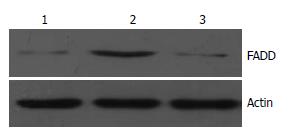
结果: 测序及酶切鉴定证明获得人全长FADD基因, FADD基因正确插入pEGFP-N1中, 在荧光显微镜下观察到绿色荧光蛋白在SW480细胞中的稳定表达, Western blot检测结果显示稳定转染pEGFP-N1-FADD的细胞FADD表达水平增高, 是未转染细胞的2.34倍.
结论: 成功构建真核表达载体pEGFP-N1-FADD, 并且在SW480细胞中稳定表达.
引文著录: 印安宁, 江应安, 张险峰. Fas相关死亡结构域蛋白荧光真核表达载体的构建及其鉴定. 世界华人消化杂志 2009; 17(10): 981-984
Revised: February 27, 2009
Accepted: March 2, 2009
Published online: April 8, 2009
AIM: To construct the recombinant plasmid pEGFP-N1-FADD with gene recombinant technique and detect its expression in SW480 cells.
METHODS: FADD full length cDNA was amplified by RT-PCR with total RNA extracted from human colon carcinoma SW480 cells as template, and cloned into eukaryotic expression vector pEGFP-N1. Recombinant plasmid of pEGFP-N1-FADD was identified by restriction endonuclease analysis and DNA sequencing. Then the pEGFP-N1-FADD plasmid was transfected into SW480 cells. SW480 cell clones with FADD over-expression was screened by G418 selection. FADD expression was determined by Western blot analysis.
RESULTS: The full-length human FADD cDNA was obtained and identified correct through sequencing and enzyme digestion. FADD cDNA was correctly inserted into pEGFP-N1. The expression of EGFP in SW480 cells transfected with pEGFP-N1-FADD was observed by fluorescence microscopy. Western blotting analysis showed that FADD expression significantly increased after pEGFP-N1-FADD transfection in SW480 cells in comparison with that in the controls.
CONCLUSION: The eukaryotic expression vector pEGFP-N1-FADD is successfully constructed, which can stably express FADD in SW480 cells.
- Citation: Yin AN, Jiang YA, Zhang XF. Construction and identifcation of pEGFP-N1-FADD eukaryotic fluorenscent expression vector. Shijie Huaren Xiaohua Zazhi 2009; 17(10): 981-984
- URL: https://www.wjgnet.com/1009-3079/full/v17/i10/981.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i10.981
Fas相关死亡结构域蛋白(fas-associated protein with death domain, FADD)于1995年由Chinnaiyan et al利用酵母双杂交系统成功克隆[1], 是广泛存在于多种组织细胞中的一种胞质蛋白质, 也是细胞内凋亡信号传导通路中的一个关键接合蛋白. 因为包含一个与Fas相关死亡结构域(death domain, DD)同源的结构域, 因而得名, 并认为他是一个凋亡蛋白. 为进一步研究FADD基因抑制结肠癌增殖和促凋亡作用. 我们克隆了人FADD基因并构建了真核表达载体pEGFP-N1-FADD并将其转染真核细胞, 观察其表达, 为下一步的工作奠定了基础.
人结肠癌细胞SW480(购自中国科学院上海细胞生物研究所细胞库)置37 ℃、50 mL/L CO2孵箱中, 用含100 mL/L胎牛血清以及100 kU/L青霉素和50 g/L链霉素的RPMI 1640培养基培养. 2-3 d换液, 取对数生长期细胞进行后续实验. TRIzol试剂购自Invitrogen公司, RT试剂盒购自ToYoBo公司, PCR试剂盒购自Fermentas公司; AMV逆转录酶购自Promega公司; PrimeSTAR HS DNA高保真酶、限制性内切酶、T4连接酶、标准分子质量DNA Marker、DNA凝胶回收试剂盒和DNA片段纯化试剂盒均购自TaKaRa公司; 质粒小量提取试剂盒购自Omega公司; pEGFP-N1购自Clontech公司; 大肠杆菌DH5α菌株购自Tiangen公司. 兔抗人FADD和Actin多克隆抗体购自Santa Cruz公司.
1.2.1 引物的设计与合成: 根据FADD基因序列(GenBank Number: NM_003824.2), 依据PCR引物设计原则和PrimeSTAR HS DNA高保真酶的特性, 利用Primer Premier5.0生物软件设计可以特异性扩增人FADD cDNA全长的引物序列, 同时分别在上游引物和下游引物的5'端引入Hind Ⅲ和EcoRⅠ两酶切位点, 引物由上海英骏生物技术有限公司合成, 序列如下: F: TTTGGATCCGCTAGCATGGACCCGTTCCTGGTGCTG; R: TTTCTCGAGTCAGGACGCTTCGGAGGTAGA.
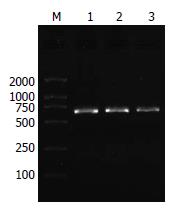
1.2.2 RT-PCR: 取适量培养的结肠癌细胞SW480, 加入1 mL TRIzol试剂, 提取总RNA. 以1 μg总RNA为模板, 按照RT试剂盒说明书进行85 ℃逆转录30 min获得cDNA. 以cDNA产物为模板, F和R为引物, PCR扩增约651 bp的片段, 总反应体积为25 μL. 循环参数为: 94 ℃预变性5 min后, 94 ℃ 30 s, 64 ℃ 30 s, 72 ℃ 30 s, 循环30次, 再72 ℃充分延伸10 min. 取9 μL PCR产物加1 μL溴酚蓝后, 于15 g/L琼脂糖凝胶上电泳.
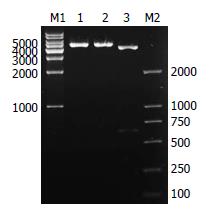
1.2.3 pEGFP-N1-FADD真核表达载体的构建: 琼脂糖凝胶DNA纯化试剂盒回收FADD扩增产物, 和空质粒pEGFP-N1用HindⅢ和EcoRⅠ进行双酶切, 琼脂糖电泳回收载体片段(4.7 kb)和目的片段(651 bp). 连接上述目的片段和载体片段, 构建pEGFP-N1-FADD原核表达载体, 转化DH5α感受态细胞, 用含Kan+的LB平板筛选阳性克隆, 小量提取pEGFP-N1-FADD质粒, 经PCR及HindⅢ和EcoRⅠ双酶切鉴定.
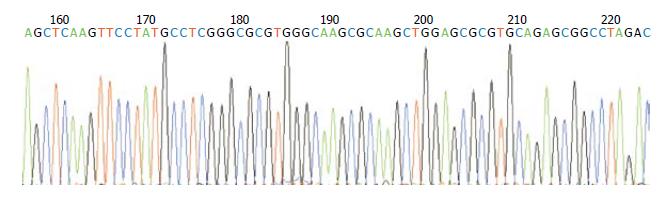
1.2.4 质粒测序鉴定和质粒小量提取: 对pEGFP-N1-FADD质粒进行测序鉴定, 与GenBank序列(NM_003824.2)进行BLAST比对. 按照Omega公司的质粒小量提取试剂盒说明书提取质粒. 具体步骤如下: (1)无菌条件下, 分别取上述菌落扩增的新鲜菌液20 μL, 加入30 mL卡那霉素抗性LB液体培养基中, 37 ℃摇菌过夜; (2)次日, 室温下, 5000 g离心10 min沉淀细菌; (3)加入1 mL Solution1/RnaseA完全重悬细菌; (4)加入1 mL Solution2, 轻柔混匀, 上下颠倒7-10次, 室温放置2 min; (5)加入500 μL预冷的Buffer N3, 上下颠倒7-10次, 室温下12 000 g离心10 min; (6)将上清移至一个新离心管, 加入0.1倍体积ETRsolution, 上下颠倒7-10次, 冰上孵育10 min; (7)将上述裂解液于42 ℃中静置5 min, 裂解液又出现浑浊, 室温下12 000 g离心3 min; (8)将上清移至一个新离心管, 加入0.5倍体积的无水乙醇, 上下颠倒7-10次, 室温放置2 min; (9)将上述混合液放入已经用400 μL Buffer BT平衡的Omega柱子中, 使混合液完全流过柱子进入收集管, 弃去滤液; (10)将1 mL Buffer HB加入柱子中, 室温下10 000 g离心1 min, 弃去滤液; (11)将1.4 mL DNA Wash Buffer加入柱子中, 室温下10 000 g离心1 min, 弃去滤液; 重复此步骤; (12)空柱室温下13000 g离心3 min甩干乙醇; (13)将柱子置于一个无菌离心管, 将Endtoxin Free Elution Buffer 200 μL加入到柱子中, 室温静置5 min, 室温下13 000 g离心1 min, 洗脱出质粒DNA, 并测定浓度.
1.2.5 细胞转染及克隆筛选: 转染前1 d将SW480细胞接种至6孔板中, 2×105个细胞/孔, 使细胞达到90%-95%融合. 转染时用不含血清和抗生素的培养基. 分别用100 μL的上述培养基稀释1 μg质粒DNA和2.5 μL LipofectamineTM2000, 室温孵育5 min. 将LipofectamineTM2000混合物加入质粒DNA中, 总体积为200 μL, 轻轻混匀, 室温孵育20 min. 将DNA-LipofectamineTM2000混合物加入800 μL上述培养基中, 轻轻混匀后, 加到6孔板孔中, 6 h后更换含血清和抗生素的培养基. 37 ℃孵育24 h后消化细胞到培养瓶中, 等到细胞完全贴壁后, 加入含G418(浓度为250 mg/L)的培养液, 进行筛选. 筛选4 wk后建成抗性单克隆, 挑取单克隆, 扩大培养. 以pEGFP-N1质粒为空白转染对照.
1.2.6 Western blot检测FADD表达: 收集稳定转染pEGFP-N1-FADD和pEGFP-N1的细胞, 提取总蛋白. 上样孔加入45 μg蛋白进行SDS-PAGE电泳. 分离胶100 g/L, 积层胶50 g/L. 恒压75V电泳至积层胶底部, 恒压100 V电泳至分离胶底部. 200 mA恒流、30 min转移到硝酸纤维素膜上. 100 g/L脱脂牛奶室温封闭2 h. 按1:1000比例稀释加入兔抗人FADD和Actin(内参)多克隆抗体, 4 ℃摇床过夜. 按1:3000比例稀释加入羊抗兔IgG-HRP, 室温振摇1 h. Millipore ECL试剂显色、曝光并拍照. 扫描后用Quantity One图像分析软件进行吸光度积分值分析, 用FADD/Actin吸光度积分值之比对FADD蛋白表达进行半定量分析.
PCR成功扩增出人FADD全长cDNA, FADD基因PCR产物的电泳结果可见大小为651 bp左右的特异性条带(图1).
构建的质粒用HindⅢ和EcoRⅠ双酶切鉴定, 得到约4.7 kb和651 bp的片段, 与预期结果一致(图2). 对pEGFP-N1-FADD质粒进行测序, 结果与GenBank里的人FADD基因序列相一致(图3).
细胞凋亡一般认为有2条基本通路[2], 一条是线粒体非依赖性, 又叫死亡受体通路, 即是在Fas引导下, FADD以其DD直接与Fas的死亡结构域结合, 相互作用后显露出其死亡效应域(FADD-DED), 随即与无活性的Caspase-8酶原发生同嗜性交联, 使之活化, 进而引起Caspase级联反应, 导致细胞凋亡. 另一条线粒体依赖性的, 即活化的Caspase-8作用于bcl-2家族的促凋亡成员bid, 使其催化断裂, 其C端部分活化并转位至线粒体膜, 引起线粒体跨膜势能降低或破坏, 释放出膜间腔的cytC和procaspase-9等死亡因子, 在Apaf-1、dATP和cytC参与下, procaspase-9自身催化形成活性Caspase-9, 激活下游靶procaspase-3, 导致细胞凋亡.
FADD在细胞凋亡死亡受体通路中起着非常重要的衔接作用[3]. FADD的DD域与死亡受体的DD域结合后, 其DED域进行低聚化并激活Caspase-8前体, 形成DISC. 若DED域缺失, 则干扰DISC形成, 抑制其下游的凋亡信号传导, 遏制细胞凋亡的发生[4]. FADD作为一种凋亡蛋白, 在恶性胶质瘤、类风湿关节炎等疾病中的治疗已有一定的研究[5-8]. 另外, Imai et al[9]的研究表明在人骨肉瘤中过表达显性负相FADD可以降低凋亡水平. 并且, 对FADD磷酸化的研究也取得一定的进展. Shimada et al[10-11]发现, 磷酸化FADD依赖的JNK/caspase通路的活化在化疗诱导凋亡的过程中起着重要的作用.
绿色荧光蛋白(green fluorescent protein, GFP)是20世纪90年代发展起来的一种全新的报告分子[12]. GFP分子质量小, 易与其他目的基因形成融合基因, 对细胞无不良反应, 而且其化学性质稳定, 使用方便, 可以在活体细胞中定时观察, 因而连接有GFP的载体pEGFP-N1在分子生物学中被广泛应用.
本实验中我们应用RT-PCR方法, 从培养的结肠癌细胞SW480中提取RNA, 逆转录为cDNA为模板, 克隆了FADD基因的全序列, 并成功地构建了含人FADD全长的带绿色荧光蛋白的真核表达质粒pEGFP-N1-FADD. 通过G418抗性筛选获得了稳定表达FADD的细胞株SW480/FADD, 为深入研究FADD对结肠癌的抗增殖和促凋亡作用奠定了基础, 为临床治疗结肠癌提供了新思路.
结肠癌是最常见的恶性肿瘤之一, 其发生率一直呈上升趋势. 目前结肠癌的治疗方案, 多采用手术治疗, 再辅以化疗及其他治疗. 手术和化疗虽有一定的疗效, 但术后易复发, 化疗不良反应大且易引起耐药, 对晚期转移患者效果更不理想. 因此, 基因治疗是目前研究的热点. FADD是凋亡死亡受体通路中一种重要的凋亡分子, 在肿瘤中的促凋亡作用的现象及其机制的研究正在受到广泛的关注.
曹志成, 英国生物医学科学研究所院士, 香港伊利沙伯医院临床肿瘤科; 潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
FADD促进肿瘤凋亡的机制及其上下游相互作用蛋白是本领域的研究热点及重点. FADD促进肿瘤细胞凋亡的机制是亟待解决的问题.
Kondo et al研究表明FADD过表达可以在体外和体内诱导恶性胶质瘤细胞的凋亡. Kobayashi et al研究也表明, 利用FADD腺病毒载体可以从体外和体内促进风湿样滑膜细胞的凋亡, 从而为治疗风湿样关节炎提供一种新的手段.
本研究克隆了人FADD基因并构建了GFP表达载体pEGFP-N1-FADD, 并将其转染真核细胞, 观察其稳定表达情况, 为下一步的工作奠定了基础.
Fas相关死亡结构域蛋白(FADD): Chinnaiyan et al利用酵母双杂交系统成功克隆, 是广泛存在于多种组织细胞中的一种胞质蛋白质, 也是细胞内凋亡信号传导通路中的一个关键接合蛋白. 因为包含一个与Fas相关死亡结构域(DD)同源的结构域, 因而得名, 并认为他是一个凋亡蛋白.
本研究成功地构建了含人FADD全长的带绿色荧光蛋白的真核表达质粒pEGFP-N1-FADD, 并通过G418抗性筛选获得了稳定表达FADD的细胞株SW480/FADD. 文章内容稍嫌简单, 若能对构建含人FADD全长的细胞株SW480/FADD作深入研究, 将对读者更有裨益.
编辑: 李军亮 电编:吴鹏朕
| 1. | Chinnaiyan AM, O'Rourke K, Tewari M, Dixit VM. FADD, a novel death domain-containing protein, interacts with the death domain of Fas and initiates apoptosis. Cell. 1995;81:505-512. [PubMed] [DOI] |
| 2. | Fesik SW. Promoting apoptosis as a strategy for cancer drug discovery. Nat Rev Cancer. 2005;5:876-885. [PubMed] [DOI] |
| 3. | Thorburn A. Death receptor-induced cell killing. Cell Signal. 2004;16:139-144. [PubMed] [DOI] |
| 4. | Kim KS. Multifunctional role of Fas-associated death domain protein in apoptosis. J Biochem Mol Biol. 2002;35:1-6. [PubMed] |
| 5. | Kondo S, Ishizaka Y, Okada T, Kondo Y, Hitomi M, Tanaka Y, Haqqi T, Barnett GH, Barna BP. FADD gene therapy for malignant gliomas in vitro and in vivo. Hum Gene Ther. 1998;9:1599-1608. [PubMed] [DOI] |
| 6. | Kobayashi T, Okamoto K, Kobata T, Hasunuma T, Kato T, Hamada H, Nishioka K. Novel gene therapy for rheumatoid arthritis by FADD gene transfer: induction of apoptosis of rheumatoid synoviocytes but not chondrocytes. Gene Ther. 2000;7:527-533. [PubMed] [DOI] |
| 7. | Koga S, Hirohata S, Kondo Y, Komata T, Takakura M, Inoue M, Kyo S, Kondo S. FADD gene therapy using the human telomerase catalytic subunit (hTERT) gene promoter to restrict induction of apoptosis to tumors in vitro and in vivo. Anticancer Res. 2001;21:1937-1943. [PubMed] |
| 8. | Komata T, Koga S, Hirohata S, Takakura M, Germano IM, Inoue M, Kyo S, Kondo S, Kondo Y. A novel treatment of human malignant gliomas in vitro and in vivo: FADD gene transfer under the control of the human telomerase reverse transcriptase gene promoter. Int J Oncol. 2001;19:1015-1020. [PubMed] |
| 9. | Imai T, Adachi S, Nishijo K, Ohgushi M, Okada M, Yasumi T, Watanabe K, Nishikomori R, Nakayama T, Yonehara S. FR901228 induces tumor regression associated with induction of Fas ligand and activation of Fas signaling in human osteosarcoma cells. Oncogene. 2003;22:9231-9242. [PubMed] [DOI] |
| 10. | Shimada K, Nakamura M, Ishida E, Kishi M, Yonehara S, Konishi N. Phosphorylation of Fas-associated death domain contributes to enhancement of etoposide-induced apoptosis in prostate cancer cells. Jpn J Cancer Res. 2002;93:1164-1174. [PubMed] |
| 11. | Shimada K, Matsuyoshi S, Nakamura M, Ishida E, Kishi M, Konishi N. Phosphorylation of FADD is critical for sensitivity to anticancer drug-induced apoptosis. Carcinogenesis. 2004;25:1089-1097. [PubMed] [DOI] |