修回日期: 2009-03-05
接受日期: 2009-03-09
在线出版日期: 2009-04-08
目的: 探讨自体骨髓间充质干细胞(mesen-chymal stem cells, MSCs)移植联合内科方法对急性肝功能衰竭动物的协同治疗作用.
方法: 采用D-氨基半乳糖(D-Gal)诱导建立猪急性肝功能衰竭模型. 12只实验动物随机分为4组(n = 3), 联合治疗组: 诱导24 h后, 门静脉移植5×107自体MSCs, 每24 h自体血浆100 mL、甘利欣100 mg滴注; 单纯内科治疗组: 诱导后每24 h自体血浆100 mL、甘利欣100 mg滴注; 单纯自体MSCs移植组: 诱导24 h后, 经门静脉移植5×107自体MSCs; 对照组: 除普通观察护理外, 不予以任何治疗. 以对照组存活时间为整个实验观察窗口, 观察家猪的肝脏功能及病理变化.
结果: 对照组全部死亡后(存活44±3.5 h), 其他3组所有实验动物人为促死. 肝脏功能指标在联合治疗组、单纯内科治疗组及单纯MSCs移植组明显优于对照组(P<0.05), 联合治疗组比较单纯内科治疗组及单纯自体MSCs移植组有明显改善(P<0.05). 肝脏病理HE染色提示联合治疗组、单纯内科治疗组病理改变轻于其他组, 联合治疗组病理改变轻于内科治疗组, 单纯MSCs移植组与对照组比较无明显差异. 免疫组织化学显示联合治疗组肝脏细胞增殖率(34%)明显优于其他组, 单纯内科治疗组、单纯MSCs移植组及对照组无明显差异.
结论: 单纯骨髓MSCs移植或者内科治疗急性肝功能衰竭有一定效果, 骨髓MSCs移植联合内科治疗具有一定协同作用, 可明显改善D-Gal诱导的急性肝衰竭家猪的肝脏指标, 促进肝组织及功能恢复.
引文著录: 许海云, 施晓雷, 褚薛慧, 丁义涛. 自体骨髓间充质干细胞移植对实验性急性肝功能衰竭的治疗作用. 世界华人消化杂志 2009; 17(10): 962-968
Revised: March 5, 2009
Accepted: March 9, 2009
Published online: April 8, 2009
AIM: To evaluate cooperative effects on swine acute liver failure by combined therapy of autologous mesenchymal stem cell transplantation and medical treatment.
METHODS: Pigs were given D-galactosamine to build models of acute liver failure. Twelve miniature pigs were randomly divided into four groups. In combined therapeutic group, 5 × 107 MSCs were injected into liver via portal veins after 24 h, 100 mL plasma and diammonium glycyrrhizinate 100 mg in vein QD. In the medical treatment group, blood plasma 100 ml and diammonium glycyrrhizinate 100 mg in vein QD. In the MSCs transplantation group, 5 × 107 MSCs were injected into liver via portal veins after 24 h. In the control group, except for routine observation and care, no additional treatment was given. Liver function and pathological changes were measured.
RESULTS: The survival time of the control group was 44 ± 3.5 h, promoting all experimental animals to death at 48 h. The biochemical assay of the combined therapeutic group were different from those in the medical treatment group and from the MSCs transplantation group (P < 0. 05), as well as from the biochemical assay. Area of necrosis was obviously reduced in the combined therapeutic group. Cells grow rate (34%) in the combined therapeutic group was remarkably different from those of other groups.
CONCLUSION: The medical treatment and the MSCs transplantation are useful for ALF partially. The combined therapy shows cooperativeeffects, and the biochemical assay and changes in liver pathology are significantly improved.
- Citation: Xu HY, Shi XL, Chu XH, Ding YT. Effects on swine acute liver failure by combined therapy of autologous mesenchymal stem cell transplantation and medical treatment. Shijie Huaren Xiaohua Zazhi 2009; 17(10): 962-968
- URL: https://www.wjgnet.com/1009-3079/full/v17/i10/962.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i10.962
各种原因引起的急性肝功能衰竭具有很高的死亡率. 肝移植是当今公认的治疗终末期肝病最为有效的手段, 但由于器官供需矛盾突出, 许多患者由于缺乏有效的肝脏支持治疗手段而在等待中死亡. 从长远来看, 肝移植术后各种并发症、术后抗免疫排斥药物应用等因素, 也限制了患者长期生存.
干细胞移植由于其简单易行、应用灵活、对受体影响小及价格相对低廉等特点, 近年来得到较快发展, 成为继原位肝移植后又一治疗肝功能衰竭的有效手段. 研究表明: 骨髓间充质干细胞在一定的内环境下能够转化为肝细胞, 分泌相关细胞因子, 从而促进受损肝脏细胞增生. 以自体骨髓干细胞作为细胞移植的细胞来源, 不仅可以解决细胞来源缺乏的问题, 还可以解决异体细胞带来的免疫排斥反应等一系列问题. 然而, 也有研究结果表明: 骨髓间充质干细胞(mesenchymal stem cells, MSCs)的移植效果并不尽如人意, 干细胞在肝脏中的归巢及转化率很低. 为了解决这个问题, 本研究拟采用自体骨髓MSCs移植联合内科常规方法对急性肝功能衰竭(acute hepatic failure, AHF)进行治疗, 以期通过改善肝脏的内环境来提高干细胞移植的效率, 从而为临床开展骨髓MSCs移植提供更理想的模式.
成年健康家猪12头, 雌雄不限, 体质量20 kg左右, 由南京大学医学院附属鼓楼医院实验动物中心提供. L-DMEM培养液、特级胎牛血清、胰蛋白酶及青链双抗购自Gibco公司; 淋巴细胞分离液购自TBD公司; 小鼠抗猪mAb CD45-FITC购自美国Antigenix公司; 小鼠抗猪mAb CD90-PE购自美国BD Pharmingen公司; 大鼠抗哺乳动物mAb PCNA购自美国Chemicon公司, DAKO Invasion System通用二抗; Membrane Plasma Fractionator膜型血浆成分分离器购自日本川澄化学工业株式会社.
1.2.1 猪骨髓MSCs的分离、培养及扩增: 成年健康家猪氯胺酮肌肉麻醉后, 于髂前上棘穿刺, 抽取骨髓液15 mL. 获取骨髓液按1:1比例缓慢加入到密度为1.077的淋巴细胞分离液中, 2200 r/min离心25 min, 收集中间云雾状的界面层, L-DMEM重悬2次后, 接种于25 mL的培养瓶中. 培养液为90% L-DMEM, 100 mL/L胎牛血清, 100 kU/L青霉素, 100 mg/L链霉素. 24 h后换液除去悬浮细胞, 每3 d换液, 第9-10天细胞生长占瓶底面积超过90%形成融合时, 用2.5 g/L胰酶消化按1:3进行传代, 以后重复操作, 传至第5代, 培养过程中倒置相差显微镜下观察.
1.2.2 MSCs的流式细胞学鉴定: 取P5代细胞用于流式细胞分析. 细胞消化后进行室温离心, 所得细胞沉淀用PBS洗涤后弃除上清; 加入600 µL PBS吹打均匀后15 mL离心管分装, 每管300 µL细胞悬液, 分为实验组和对照组, 实验组加入小鼠抗猪mAb CD45、CD90各5 µL, 避光孵育20 min后行流式细胞学检测.
1.2.3 猪自体血浆分离: 采用全麻下颈动脉及颈外静脉插管, 肝素1 mL颈动脉推注肝素化家猪; 将血液回路导管进血出血口分别接入血浆分离器进血出血口, 整个回路肝素化并且排尽空气, 在蠕动泵驱动下以150 mL/min的速度循环. 收集新鲜血浆300 mL, -20 ℃冰冻备用; 自体血浆分离结束后予以等量复方氯化钠输注.
1.2.4 猪急性肝损伤模型的建立: 采用全麻下颈外静脉插管, 以0.6 g/kg剂量的D-Gal静脉给药. D-Gal按10%的浓度溶于50 g/L葡萄糖溶液, 并调节溶液pH值至6.8, 经颈外静脉中心导管滴注到动物体内; 分别于术后6、12、18及24 h观察临床表现, 存活动物给药24 h后进行后续的分组处理[1].
1.2.5 实验分组及处理: 所有动物急性肝损伤造模成功后, 随机分为4组. A组: 联合治疗组(n = 3): 诱导24 h后, 开腹门静脉移植5×107自体MSCs, 每24 h自体血浆100 mL、甘利欣100 mg滴注; B: 单纯内科治疗组(n = 3): 诱导后每24 h自体血浆100 mL、甘利欣100 mg滴注; C: 单纯自体MSCs移植组(n = 3): 诱导24 h后, 开腹经门静脉移植5×107自体MSCs; D: 对照组(n = 3): 除普通观察护理外, 不予以任何治疗.
5×107骨髓MSCs制成4 mL细胞悬液. 移植方法: 动物麻醉后, 消毒腹部皮肤, 分层进入腹腔, 暴露肝脏, 解剖肝门部, 寻找门静脉, 用头皮针斜行向心穿刺入门静脉, 缓慢推注细胞悬液. 拔针后局部按压止血, 见无明显渗血后, 生理盐水冲洗腹腔, 逐层关腹. 治疗后各组每3 h颈静脉插管处采血, 分别行谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)、血尿素氮(BUN)、血糖(GLU)、血清白蛋白(ALB)、凝血酶原时间(PT)及血氨(NH3)浓度一系列肝脏功能检测. 以对照组存活时间作为整个实验观察窗口.
1.2.6 组织学检查: 动物死后取出肝脏, 随机取肝内血管及周围组织, 甲醛固定后常规石蜡包埋, 行HE染色及免疫组化检测增殖细胞核抗原(proliferating cell nuclear antigen, PCNA).
统计学处理 采用SPSS16.0统计学软件进行数据处理, 组之间比较应用独立样本t检验, P<0.05为差异有统计学意义.
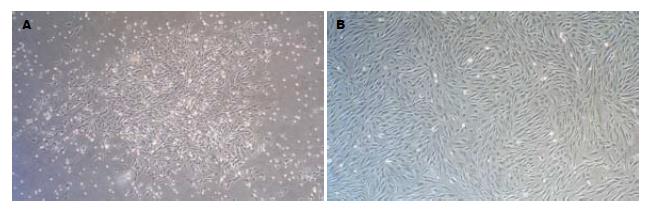
原代接种24 h后换液镜下可见少量类圆形贴壁细胞稀疏生长; 培养3 d后, 可见单个或少量成集落生长的贴壁细胞, 形态大多呈短梭形(图1A); 9-10 d后, 集落不断扩大并形成融合单层, 细胞形态大多呈长梭形或多角形. 传代后, 细胞呈均匀生长, 形态类似成纤维细胞, 混有较多杂质细胞; 传至第5代, 杂质细胞不断被除去, MSCs逐渐纯化(图1B).
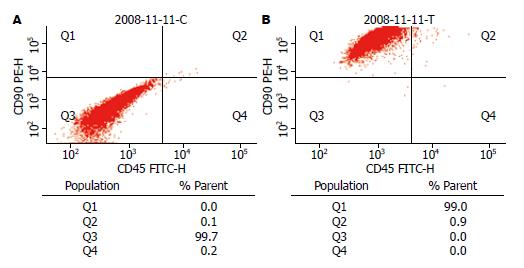
流式细胞鉴定结果P5代细胞表面表达CD90+CD45-的细胞占总细胞数的百分比为95%以上(图2), 表明P5代细胞基本为MSCs, 纯度很高, 可作为种子细胞进行下一步实验.
对照组存活时间约44±3.5 h; 对照组全部死亡后, 其他3组所有实验动物人为促死. 联合治疗组相比于对照组各类生化指标均有显著改善(P<0.05); 单纯内科治疗组、单纯干细胞移植组与对照组相比, 生化功能有一定改善, 主要为AST、BUN、ALB; 联合治疗组较单纯内科治疗组、单纯干细胞移植组比较, 除TB、ALB外各类生化指标有所改善(P<0.05); 单纯内科治疗组与单纯干细胞移植组相比, ALT、TB及BUN有一定改善, 其余生化指标无明显统计学意义(表1).
| 参数 | 治疗前 | 治疗后12 h | 治疗后24 h | |||||||||
| A | B | C | D | A | B | C | D | A | B | C | D | |
| ALT(U/L) | 31.2±2.6 | 69.3±3.4 | 73.9±4.3 | 62.3±7.1 | 38.9±1.4 | 116.6±7.5 | 159.8±6.2 | 181.9±8.4 | 41.9±14.9 | 149.8±7.2 | 190.0±15.9 | 200.4±7.1 |
| AST(U/L) | 134.0± 7.8 | 1091.2±345.0 | 820.8±175.0 | 967.6±298.0 | 193.2±4.4 | 2754.5±806.1 | 2340.9±285.3 | 5889.0±123.8 | 1561.6±111.2 | 3334.5±1151.5 | 3419.1±769.9 | 6613.5±431.6 |
| TB(mmol/L) | 35.9±6.3 | 24.3±2.0 | 24.0±2.4 | 26.7±3.2 | 52.7±1.3 | 38.6±6.0 | 42.5±2.9 | 53.7±13.2 | 68.2±2.9 | 70.5±2.0 | 52.2±2.6 | 69.7±19.6 |
| BUN(mmol/L) | 2.4±0.3 | 3.1±0.3 | 3.5±0.4 | 5.1±1.2 | 2.7±0.3 | 3.7±0.2 | 3.9±0.2 | 7.3±1.1 | 3.2±0.6 | 3.7±0.4 | 6.7±0.2 | 7.3±1.0 |
| GLU(mmol/L) | 4.5±0.4 | 4.8±1.5 | 3.6±0.5 | 3.5±0.4 | 3.7±0.2 | 3.5±0.3 | 2.4±0.4 | 1.7±0.6 | 3.1±0.2 | 1.8±1.3 | 1.5±0.5 | 1.1±0.3 |
| ALB(g/L) | 34.0±2.9 | 28.6±3.1 | 35.1±2.3 | 34.1±0.5 | 32.9±3.6 | 31.6±1.9 | 31.6±1.7 | 29.4±3.1 | 33.7±3.0 | 32.8±3.7 | 32.4±3.0 | 28.6±6.7 |
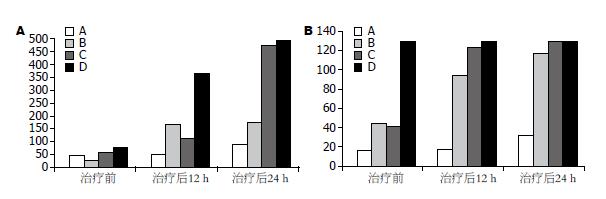
联合治疗组NH3及凝血功能较其余组改善明显, 有统计学差异; 单纯内科治疗组及单纯干细胞移植组较对照组有一定改善; 内科治疗组NH3改善较单纯干细胞移植组有差异(图3).
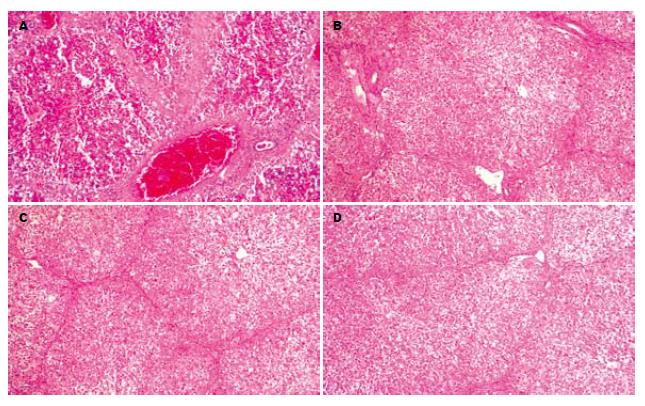
HE染色: 对照组可见肝组织、肝小叶轮廓尚存, 肝细胞坏死严重而广泛. 肝实质坏死区域可见胆汁淤积. 坏死区仅留下原有的网状支架, 网眼中充满红细胞而使坏死区呈红色. 坏死自小叶中央静脉开始, 向四周扩延, 仅小叶周边留有少部分变性的肝细胞. 肝窦明显扩张充血并出血, 小叶内及汇管区有淋巴细胞和巨噬细胞为主的炎细胞浸润(图4A). 单纯内科治疗组及单纯干细胞移植组肝小叶内肝细胞广泛坏死伴出血及中性粒细胞浸润, 部分汇管区中性粒细胞浸润, 部分汇管区结构正常(图4B-C). 联合治疗组肝组织、肝小叶结构尚存, 小叶内肝细胞可见灶性坏死, 部分肝窦内充血, 小叶内见较多中性粒细胞浸润, 小叶间隔及汇管区见中性粒细胞浸润(图4D).
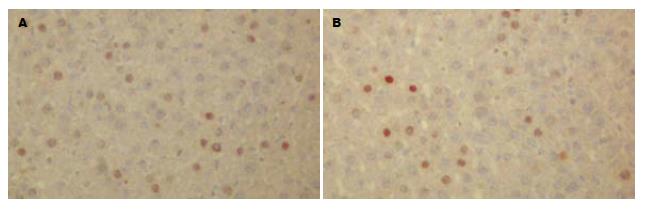
免疫组织化学染色: PCNA阳性表达的细胞核着棕黄色, 细小颗粒状, 疏密不等. 正常肝组织多为阴性表达, 偶见阳性表达. 对照组见几乎未见阳性表达; 单纯内科治疗组及单纯干细胞移植组存在阳性表达, 但数量较少(25%, 21%), 核着色较浅; 联合治疗组较其余3组, 阳性表达数量明显增多(34%), 且染色加深(图5).
骨髓干细胞作为一种成体干细胞, 除了具有一般干细胞的共性即自我更新能力以外, 还具有多向分化的能力, 可以分化为具有功能的组织细胞并应用于器官损伤的治疗, 是人们关注的热点及追求的目标[2]. 已证实MSCs不仅能够分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞、心肌细胞等[3-4]. 近年来还发现在不同微环境及细胞因子诱导条件下, 亦可分化为具有部分功能的类肝细胞, 从而参与肝功能的修复和重构[5-11]. 骨髓细胞在体内不但能分化为肝细胞, 而且能分化为胆管细胞. 由于MSCs具有来源于自体、培养方法简单、扩增能力强、无免疫原性, 且不涉及社会伦理和法律问题等优点, 可以作为肝细胞移植的种子细胞和基因治疗的载体细胞, 在治疗急慢性肝衰竭及遗传代谢性肝脏疾病方面具有很好的前景[12-17].
急性肝功能衰竭患者, 因其肝脏功能严重受损, 合成及分解功能下降, 不能维持正常生理代谢功能, 使A/G失调, 纤维蛋白原及凝血因子合成不足, 体内出现血氨升高、氨基酸不平衡、假性神经递质等, 使机体出现门脉高压, 大量腹水, 出血倾向, 严重可危机生命. 甘利欣具有较强的非特异性的抗炎作用, 可减少肝细胞的水肿、坏死, 同时甘利欣调节内源性类固醇水平, 具有保护肝细胞和溶酶体膜结构及改善肝功能的作用, 甘利欣能阻滞钙离子内流, 以减轻脏器细胞的损害[18]. 新鲜冰冻血浆中含有大量白蛋白、凝血因子、纤维蛋白原等, 对维持肝病患者的血浆胶体渗透压, 纠正出血倾向, 改变氨基酸不平衡有重要意义. 稀释排除有害因子如血氨的稀释可减少肝性脑病的形成, 减轻肝脏负担, 预防肝肾综合征的发生, 同时为患者肝脏功能的恢复创造有利的内环境和宝贵的时间[19].
本实验中, 对照组存活时间为44±3.5 h, 对照组全部死亡后, 其他3组所有实验动物人为促死, 此时其余3组动物仍存活. 检测肝脏功能指标, 联合治疗组、单纯内科治疗组及单纯MSCs移植组明显优于对照组(P<0.05), 联合治疗组比较单纯内科治疗组及单纯自体MSCs移植组有明显改善(P<0.05). 肝脏病理HE染色提示联合治疗组、单纯内科治疗组病理改变轻于其他组, 联合治疗组病理改变轻于内科治疗组, 单纯MSCs移植组与对照组比较无明显差异. 免疫组织化学显示联合治疗组肝脏细胞增殖率(34%)明显优于其他组, 单纯内科治疗组、单纯MSCs移植组及对照组无明显差异.
单纯内科治疗有效减轻肝脏炎症坏死, 预防肝脏功能进一步受损, 改善已受损肝功能作用; 同时维持肝病患者的血浆胶体渗透压, 纠正出血倾向, 改变内环境不平衡状态. 单纯干细胞移植组较对照组生化及病理有一定改善, 考虑为骨髓基质干细胞移植后在受体内的分布、迁徙、分化及转归, 部分分化为肝脏细胞, 补偿受损肝脏功能, 同时也分泌大量细胞因子, 促进肝衰后剩余正常肝脏细胞增生, 但因急性肝功能衰竭后存活时间较短, 一般生存时间为72 h以内, 远远低于MSCs发挥功能的时间窗. 骨髓基质干细胞治疗联合内科治疗组相对与其余组有明显优势: 一方面, 内科治疗可以抑制肝脏功能进一步受损, 为干细胞移植后在受体内充分的分布、迁徙、分化及转归提供时间的可能性; 另一方面, 骨髓基质干细胞输注, 分泌细胞因子, 促死剩余正常肝脏细胞代偿性增生, 自身也有部分转化为肝干细胞, 协同内科治疗作用.
骨髓多能干细胞的存在具有巨大的科研和临床价值, 目前国际上虽对骨髓干细胞的研究已取得很大进展, 但对其生物学特性, 调控分化的因素, 诱导分化方法, 及诱导分化出的细胞与正常组织细胞的生物学特性有无差异等方面的研究都还不够充分, 因而临床应用方面的研究仅处于起步阶段, 有待我们继续努力[20-21].
急性肝功能衰竭具有很高的死亡率. 肝移植是当今公认的治疗终末期肝病最为有效的手段, 但器官供需矛盾突出, 从长远来看, 肝移植术后各种并发症、术后抗免疫排斥药物应用等因素, 也限制了患者长期生存率.
张小晋, 主任医师, 北京积水潭医院消化内科
干细胞移植由于其简单易行、应用灵活、对受体影响小及价格相对低廉等特点, 近年来成为继原位肝移植后又一治疗肝功能衰竭的有效手段, 但在肝脏中的归巢及转化率很低, 这一问题有待解决.
目前已有相当多文献报道, 体外标记骨髓间充质干细胞经各种途径移植后, 可以动态观察到其归巢, 并且免疫组织化学也提示干细胞可以转化为成体肝细胞, 达到纠正改善肝衰竭的目的.
本文主要以干细胞输注及内科常规治疗急性肝衰竭的方法结合, 有效地延长了急性肝衰竭模型的存活时间, 给干细胞归巢、转化及发挥功能一定的时间.
由于MSCs具有来源于自体、培养方法简单、扩增能力强、无免疫原性, 且不涉及社会伦理和法律问题等优点, 可以作为肝细胞移植的种子细胞和基因治疗的载体细胞, 在治疗急慢性肝衰竭及遗传代谢性肝脏疾病方面具有很好的前景.
本研究立题新颖, 设计科学, 数据可靠, 具有很好的参考价值.
编辑: 李军亮 电编:何基才
| 2. | Porada CD, Zanjani ED, Almeida-Porad G. Adult mesenchymal stem cells: a pluripotent population with multiple applications. Curr Stem Cell Res Ther. 2006;1:365-369. [PubMed] |
| 3. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 4. | Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li B, Pickel J, McKay R, Nadal-Ginard B, Bodine DM. Bone marrow cells regenerate infarcted myocardium. Nature. 2001;410:701-705. [PubMed] [DOI] |
| 5. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 6. | Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM, Krause DS. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation. Hepatology. 2000;31:235-240. [PubMed] [DOI] |
| 7. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 8. | Sato Y, Araki H, Kato J, Nakamura K, Kawano Y, Kobune M, Sato T, Miyanishi K, Takayama T, Takahashi M. Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion. Blood. 2005;106:756-763. [PubMed] [DOI] |
| 9. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 10. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 11. | 李 文晰, 段 芳龄. 骨髓干细胞向肝系细胞分化的研究. 胃肠病学和肝病学杂志. 2003;12:5-7. |
| 12. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization, and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophys Res Commun. 2001;288:156-164. [PubMed] [DOI] |
| 13. | Baccarani U, Adani GL, Sainz M, Donini A, Risaliti A, Bresadola F. Human hepatocyte transplantation for acute liver failure: state of the art and analysis of cell sources. Transplant Proc. 2005;37:2702-2704. [PubMed] [DOI] |
| 14. | Kao CL, Lin HT, Chen YW, Chen YC, Tsai FT, Chang YL, Chiou SH, Sheu DC, Ku HH. Fibronectin suppresses lipopolysaccharide-induced liver damage and promotes the cytoprotection abilities of hepatocyte-like cells derived from human bone marrow mesenchymal stem cells. Transplant Proc. 2007;39:3444-3445. [PubMed] [DOI] |
| 15. | Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS ONE. 2007;2:e941. [PubMed] [DOI] |
| 16. | Lu HH, Teng GJ, Ju SH, Sun JH, Li AM, Zhang AF. [Committed differentiation of transplanted bone derived mesenchymal stem cells and their potential to amend damaged liver functions: in vivo experiment with mice]. Zhonghua Yixue Zazhi. 2007;87:223-227. [PubMed] |