修回日期: 2009-03-25
接受日期: 2009-03-30
在线出版日期: 2009-04-08
目的: 探讨天晴甘平减轻急性肝衰竭肝细胞损伤的机制.
方法: 54只健康雌性昆明小白鼠随机分为实验组、对照组、正常对照组3组, 每组18只. 腹腔注射D-氨基半乳糖(D-galn)和脂多糖(LPS)制作急性肝衰竭模型. 注射前3 h, 实验组给予天晴甘平灌胃, 分别于注射后不同时间点用彗星实验检测肝细胞核DNA的损伤.
结果: 实验组和对照组的Olive尾矩值在0.5 h即开始增大, 且随时间延伸逐渐增加, 与正常对照组比较, 差异均具显著意义(0.5 h: 3.95±1.42, 4.79±1.62 vs 0.95±0.56, 均P<0.05); 实验组与对照组比较, 实验组Olive尾矩值明显变小, 差异亦具显著意义(0.5-8 h: 10.81±2.85 vs 19.36±3.95, P<0.05).
结论: 急性肝衰竭小鼠肝细胞损伤的发生机制之一为肝细胞核DNA的损伤, 天晴甘平具有减轻急性肝衰竭小鼠肝细胞核DNA损伤的作用.
引文著录: 刘凤超, 贺永文, 喻佛定. 天晴甘平减轻急性肝衰竭小鼠肝细胞损伤的机制. 世界华人消化杂志 2009; 17(10): 1014-1017
Revised: March 25, 2009
Accepted: March 30, 2009
Published online: April 8, 2009
AIM: To investigate the mechanism of Diammonium Glycyrrhizinate Enteric-coated Capsules in alleviating hepatocytic injury in mice with acute liver failure.
METHODS: Fifty-four healthy female Kunming white mice were randomly divided into 3 groups: experimental group, control group, normal control group (n = 18 in each group). The mice were injected intraperitoneally with D-Galactosamine (D-galn) and lipopolysaccharide (LPS) to create the mouse model of acute liver failure. Three hours prior to the injection, the experimental group were intragastrically administered Diammonium Glycyrrhizinate Enteric-coated Capsules. Comet assay was performed to detect DNA damages of hepatocytes of the mice at different time points after injection.
RESULTS: Oliver tail moment values of both experimental group and control group began to increase over time 0.5 h after the injection and they were significantly greater than that of the normal control group (0.5 h: 3.95 ± 1.42, 4.79 ± 1.62 vs 0.95 ± 0.56, both P < 0.05). The Oliver tail moment of the experimental group was significantly less than that of control group (0.5-8 h: 10.81 ± 2.85 vs 19.36 ± 3.95, P < 0.05).
CONCLUSION: One cause for the damages of hepatocytes of mice with acute liver failure may be the DNA damage of their nuclei, and Diammonium Glycyrrhizinate Enteric-coated Capsules can alleviate the damage to hepatocyte nuclear DNA in mice with acute liver failure.
- Citation: Liu FC, He YW, Yu FD. Mechanism of diammonium glycyrrhizinate enteric-coated capsules in alleviating hepatocytic injury in mice with acute liver failure. Shijie Huaren Xiaohua Zazhi 2009; 17(10): 1014-1017
- URL: https://www.wjgnet.com/1009-3079/full/v17/i10/1014.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i10.1014
天晴甘平为甘草酸二铵肠溶胶囊, 是中药甘草有效成分的第3代提取物与卵磷脂的混合物, 具有较强的抗炎护肝作用, 可用于急性肝衰竭的治疗[1]. 急性肝衰竭的主要病理变化之一是肝细胞的大量凋亡[2-4], 而细胞凋亡可以由细胞核内DNA的损伤诱发[5]. 急性肝衰竭早期是否也存在肝细胞核的DNA损伤, 及天晴甘平是否具有减轻急性肝衰竭肝细胞核DNA损伤并进而起到护肝的作用尚无相关研究报道.
清洁级健康昆明小白鼠54只, ♀, 体质量25±3 g, 由华中科技大学同济医学院实验动物中心提供. 甘草酸二铵(商品名: 天晴甘平, 胶囊, 批号080322)系江苏正大天晴药业股份有限公司生产; DYY-Ⅲ 7型电泳仪系北京市六一仪器厂产品; 荧光显微镜和荧光数码显微成像系统系日本Olympus公司产品; 脂多糖(LPS)、D-氨基半乳糖(D-galn)、正常熔点琼脂糖(NMPA)、低熔点琼脂糖(LMPA)、溴化乙锭(EB)购于武汉凌飞生物技术有限公司; CASP软件系从http://www.casp.of.pl下载(网络免费使用).
1.2.1 分组: 将昆明小白鼠54只随即分为实验组、对照组、正常对照组3组, 每组18只, 全部饲养于室温、湿润、通风良好的状态下, 普通饲料喂养2 d. 实验前动物禁食12 h, 不禁水.
1.2.2 造模及给药: 实验组每只按50 mg/kg灌胃给予生理盐水溶解的天晴甘平, 对照组、正常对照组灌胃给予相同体积的生理盐水. 至灌胃后3 h, 实验组、对照组于清醒状态下按600 mg/kg ip D-Galn的生理盐水溶液后再按20 μg/kg ip LPS生理盐水溶液; 正常对照组每只ip同等量生理盐水. 注射后小鼠放回笼中继续饲养, 并开始计时.
1.2.3 标本采集及处理: 分别于注射后0.5、1、2、4、6、8 h每组各3只经颈椎脱臼法处死, 固定于解剖板上, 碘酒消毒后沿腹中线打开腹腔, 每只取重约1.5 g的中央肝组织1块, 尽量剔除结缔组织后放入置于冰块上的培养皿内, PBS冲洗2次, 眼科剪剪碎, 加入2.5 g/L胰酶4.5 mL后, 将培养皿放入37 ℃温箱内消化30 min. 取出培养皿, 加入100 g/L的小牛血清4.5 mL终止消化, 再将已消化的细胞悬液倾入垫有4层纱布的玻璃漏斗, 过滤入15 mL的离心管内, 4 ℃, 1000 r/min, 离心10 min, 弃上清, 加入PBS 5 mL后, 将离心管置于旋涡式混悬器上将沉淀的细胞经振荡溶解成细胞悬液. 取100 μL细胞悬液与100 μL 0.4%胎盼蓝液混匀后注入细胞计数板, 显微镜下计数细胞. 将细胞悬液用PBS按比例稀释成1.0×1010个细胞/L. 取1 mL上述稀释后的细胞悬液注入EP管, 1000 r/min, 离心10 min, 弃上清. 迅速注入37 ℃的0.7% LMPA PBS溶液200 μL, 混允, 制备成细胞悬液, 立即进行细胞核DNA损伤检测.
1.2.4 DNA损伤的检测: 肝细胞核DNA损伤的检测采用彗星实验, 按文献报道的方法进行并加以改进[6]. 滴加80 µL 50 ℃的1% NMPA PBS溶液于磨砂玻片的一端, 将胶迅速铺开、晾干后, 滴加80 µL 37 ℃的0.5% LMPA PBS溶液于第一层胶上, 4 ℃, 放置约10 min, 再滴加80 µL上述细胞悬液于第二层胶上, 4 ℃, 放置15 min. 将玻片放入染缸中, 加入100 mL pH值为10的细胞裂解液, 4 ℃, 暗处放置1 h, 弃去细胞裂解液, 洗涤后加入100 mL新鲜配制的300 mmol/L NaOH、1 mmol/L EDTANa2、pH值为13的解旋液, 4 ℃, 暗处放置20 min. 洗涤后取出玻片, 平放于电泳槽, 25 V, 300 mA, 电泳25 min. 洗涤后将玻片移入染缸, 加入0.4 mol/L Tris-HCl、pH值为7.5的中和缓冲液100 mL, 4 ℃, 暗处放置10 min, 三蒸水洗3次, 滴加溴化乙锭应用液染色. 选用激发波长549 nm、发射波长590 nm的荧光显微镜观察. 每张玻片随机观察计数50个细胞核并拍照. 用CASP软件分析彗星图片, 用Olive尾矩值表示细胞核DNA损伤程度.
统计学处理 实验结果以mean±SD表示, 所有数据均运用SPSS11.5软件处理. 组间的比较采用单因素方差分析. P<0.05为差异有统计学意义.
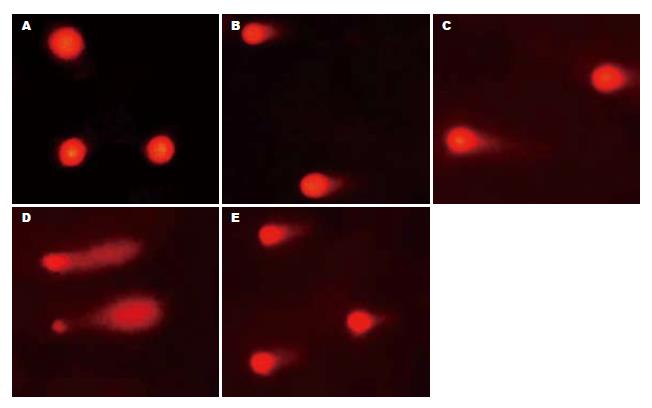
未受损的细胞核表现为一圆形荧光核心, 即彗星头部, 没有拖尾; 而受损的细胞核则有彗尾从核中伸向阳极, 形成一个亮的荧光头部和尾部. 实验组和对照组均出现细胞核DNA的损伤(图1). Olive尾矩值检测结果见表1. 腹腔注射D-Galn和LPS 0.5 h, 实验组和对照组的肝细胞核DNA的Olive尾矩值与正常对照组相比明显增大(3.95±1.42, 4.79±1.62 vs 0.95±0.56, P<0.05), 且随时间延伸逐渐增加, 至8 h, 分别为17.67±3.92、35.22±4.94, 与正常对照组(0.65±0.31)比较差异均具显著意义(P<0.05), 且实验组的较对照组的明显减小, 两组之间比较, 差异亦具显著意义(P<0.05).
急性肝衰竭(acute liver failure, ALF)时肝细胞在短期内出现大量死亡, 从而导致肝功能严重受损, 其临床特点是肝功能迅速恶化, 可引起肝性脑病及凝血功能障碍, 病情进展迅速, 死亡率高. ALF病因复杂, 常由药物损伤和嗜肝病毒感染引起, 目前对其发病机制尚缺乏足够认识. 有研究表明, 急性肝衰竭肝细胞的主要死亡方式之一为凋亡[2-4], 而细胞凋亡的发生存在不同的机制, 其中细胞核内DNA的损伤即可诱发细胞的凋亡[5]. 本研究采用彗星实验检测急性肝衰竭模型小鼠肝细胞核DNA的损伤及演变, 结果发现, 小鼠腹腔注射D-Galn和LPS 0.5 h, 肝细胞核DNA的损伤就已发生, 且随时间延伸, 逐渐加重, 至注药后8 h, DNA损伤达到最大, 而此前有研究显示, 在注药后7 h细胞开始出现大量凋亡[4], 即急性肝衰竭模型小鼠在细胞发生大量凋亡前即已出现了肝细胞核的DNA损伤, 且此后发生的肝细胞凋亡与这种肝细胞核的DNA损伤程度相关, 即当肝细胞核的DNA损伤到一定程度时可能诱发了大量的肝细胞凋亡.
急性肝衰竭的临床治疗方面, 一些药物被证明是有效的, 其中中药干草的提取物即为常用的治疗药物之一[1]. 天晴甘平即为甘草有效成分的第3代提取物与卵磷脂的混合物, 主要成分为干草酸二铵. 但对这类药物的作用机制尚缺乏足够了解. 传统观点认为[1], 这类药物结构与泼尼松相似, 易与类固醇激素的靶细胞受体结合, 具有抗炎作用, 其减轻肝炎肝损伤的机制可能与其具有保护和修复肝细胞膜的作用有关, 但是否还有其他作用机制尚无相关研究报道. 本研究发现, 接受天晴甘平治疗的实验组小鼠肝细胞核DNA的Olive尾矩值较对照组的明显变小, 表明其细胞核DNA的损伤明显减轻, 即天晴甘平具有减轻急性肝衰竭肝细胞核DNA损伤的作用, 提示, 天晴甘平对急性肝衰竭产生治疗效果的机制之一即可能是通过减轻肝细胞核DNA的损伤而发挥作用的.
急性肝衰竭死亡率高, 治疗效果不够理想, 这与其肝细胞损伤机制未被阐明有关. 研究急性肝衰竭肝细胞的损伤机制及一些有效药物的作用机制对寻找到更有效的治疗手段具有非常重要的意义.
党双锁, 教授, 西安交通大学第二医院感染科; 陈耀凯, 副教授, 中国人民解放军第三军医大学西南医院全军感染病研究所
急性肝衰竭肝细胞发生大量凋亡及一些有效药物作用机制为现阶段的研究热点.
本研究在国际上率先发现, 急性肝衰竭肝细胞核的DNA损伤较早发生, 并可能最终诱发了大量的肝细胞凋亡, 并从减轻DNA损伤的角度研究了甘草提取物对急性肝衰竭治疗作用的机制.
本文从DNA损伤的角度研究天晴甘平对急性肝损伤小鼠模型的治疗作用, 有助于阐明甘草酸制剂对于肝细胞损伤的治疗机制, 有一定学术价值.
编辑: 李军亮 电编:何基才
| 2. | Kasahara I, Saitoh K, Nakamura K. Apoptosis in acute hepatic failure: histopathological study of human liver tissue using the tunel method and immunohistochemistry. J Med Dent Sci. 2000;47:167-175. [PubMed] |
| 3. | Liu DX. A new hypothesis of pathogenetic mechanism of viral hepatitis B and C. Med Hypotheses. 2001;56:405-408. [PubMed] [DOI] |
| 4. | Morikawa , A , Sugiyama T, Kato Y, Koide N, Jiang GZ, Takahashi K, Tamada Y, Yokochi T. Apoptotic cell death in the response of D-galactosamine-sensitized mice to lipopolysaccharide as an experimental endotoxic shock model. Infect Immun. 1996;64:734-738. [PubMed] |
| 5. | Roos WP, Kaina B. DNA damage-induced cell death by apoptosis. Trends Mol Med. 2006;12:440-450. [PubMed] [DOI] |