修回日期: 2008-12-06
接受日期: 2008-12-08
在线出版日期: 2009-01-08
目的: 探讨溃疡性结肠炎(ulcerative colitis, UC)大鼠结肠黏膜中性粒细胞趋化因子-1 (CINC-1)及其受体CXCR2的表达及意义.
方法: ♂SD大鼠36只完全随机分为正常组、模型1组、模型2组, 共3组, 每组12只. 用2, 4, 6三硝基苯璜酸100 mg/kg灌肠建立大鼠溃疡性结肠炎模型, 7 d后处死模型1组动物, 14 d后处死模型2组动物. 运用RT-PCR法、免疫组化染色法分别检测各组大鼠CINC-1及CXCR2 mRNA及其蛋白的表达.
结果: CXCR2主要表达在中性粒细胞及肠上皮细胞膜表面. UC活动期CINC-1及CXCR2 mRNA及其蛋白表达明显呈上升趋势, 与炎症相关. 与正常组相比, 模型1组、2组CINC-1 mRNA及蛋白表达有显著差异(1.77±0.52, 1.82±0.24 vs 0.29±0.10; 0.30±0.01, 0.31±0.04 vs 0.18±0.02, 均P<0.05); CXCR2 mRNA及蛋白表达也有显著差异(1.66±0.10, 2.49±0.29 vs0.55±0.13; 0.20±0.03, 0.23±0.02 vs 0.16±0.01, 均P<0.05).
结论: CINC-1及其受体CXCR2表达水平与UC炎症正相关, CINC-1可能通过CXCR2介导中性粒细胞浸润, 造成结肠炎症及组织损伤.
引文著录: 张涛, 施斌, 陈建永, 潘锋. 溃疡性结肠炎大鼠结肠黏膜CINC-1及其受体CXCR2的表达及意义. 世界华人消化杂志 2009; 17(1): 78-82
Revised: December 6, 2008
Accepted: December 8, 2008
Published online: January 8, 2009
AIM: To examine the expression and significance of cytokine-induced neutrophil chemoattractant-1 (CINC-1) and CXC chemokine receptor 2 (CXCR 2) in a rat model of colitis.
METHODS: A total of 36 SD rats were randomly and equally divided into 3 groups with twelve rats in each group. A rat model of ulcerative colitis was established by an enema of 100 mg/kg of TNBS and 500 mL/L ethanol. In model group 1, rats were sacrificed on day 7. The other rats were sacrificed on day 14. The expression of CINC-1 and CXCR2 were detected using the technique of immunohistochemical staining and RT- PCR.
RESULTS: CXCR2 was predominantly expressed in the surface of neutrophil membrane and intestinal epithelial cell membrane. The mRNA and protein expression of CINC-1 and CXCR2 were on the increment in active UC. There was no association between UC and the expression of CINC-1 and CXCR2. Compared with normal group, there were significant differences between the mRNA and protein expression of CINC-1 in model group1 and model group 2 (1.77 ± 0.52, 1.82 ± 0.24 vs 0.29 ± 0.10; 0.30 ± 0.01, 0.31 ± 0.04 vs 0.18 ± 0.02, all P < 0.05), also between the mRNA and protein expression of CXCR2 (1.66 ± 0.10, 2.49 ± 0.29 vs 0.55 ± 0.13; 0.20 ± 0.03, 0.23 ± 0.02 vs 0.16 ± 0.01, all P < 0.05).
CONCLUSION: There is a positive correlation between UC and the expression of CINC-1 and CXCR2. Our data suggest that CINC-1 may mediate the infiltration of polymorph nuclear neutrophil mainly through CXCR 2. Meanwhile, this change induces experimental colitis.
- Citation: Zhang T, Shi B, Chen JY, Pan F. Expression and significance of cytokine-induced neutrophil chemoattractant-1 and CXC chemokine receptor 2 in a rat model of colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 78-82
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/78.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.78
溃疡性结肠炎(ulcerative colitis, UC)是一种原因尚不明确的慢性非特异性肠道炎症, 病理变化局限在黏膜层及黏膜下层, 以隐窝结构扭曲及隐窝脓肿, 大量的中性粒细胞及淋巴细胞浸润为主要特征. 研究指出[1], UC是在基因易患基础上, 结合多种因素如周围环境、遗传、结肠黏膜炎症-免疫系统等共同作用所导致. 其中结肠黏膜免疫-炎症系统与肠道共生菌群之间的交互作用, 大量炎性细胞浸润及细胞因子的释放在UC发病中占据重要地位. 课题组在前期研究基础上, 运用RT-PCR法、免疫组化染色检测大鼠CINC-1及CXCR2 mRNA及其蛋白的表达, 发现CINC-1及其受体CXCR2的表达与UC炎症变化呈正相关. 本文初步探讨CINC-1及其受体CXCR2的表达在UC发病中的意义.
清洁级♂SD大鼠36只, 体质量为200±20 g, 由浙江中医药大学动物实验中心提供[实验动物生产许可证: SCXK(浙)2005-0021]. 5% 2, 4, 6 TNBs 50 g/L购于Sigma公司(货号P2297). 无水乙醇购于上海国药集团. CINC-1抗大鼠抗体, 美国R&D公司出品; CXCR2抗大鼠抗体, 武汉博士德产品; 大鼠CINC-1、CXCR2、β-actin基因引物, 上海生工生物技术有限公司合成.
1.2.1 分组与造模: 大鼠称重量后, 随机分为3组, 每组12只. 除正常组外, 其余24只SD大鼠先给予250 g/L乌拉坦0.35 mL/100 g腹腔麻醉. 参照Morris et al[2]报道TNBs造模法, 最佳剂量100 mg/kg计算, 用1 mL注射器抽吸TNBs原液(0.20 mL/100 g SD大鼠), 继续抽吸0.25 mL的500 mL/L乙醇混合后, 用聚丙烯管插入肛门上段8 cm后注入混合试剂. 6 h后观察造模大鼠, 约75%大鼠出现稀便和血便. 3 d后, 随机处死3只大鼠, 距肛门约7-8 cm处肉眼可见大小约0.3 cm×0.2 cm的溃疡面, 造模成功. 7 d后处死模型1组大鼠; 14 d后处死剩余大鼠. 迅速剖取距肛8 cm远端结肠, 分别置于100 g/L中性甲醛、液氮中备用.
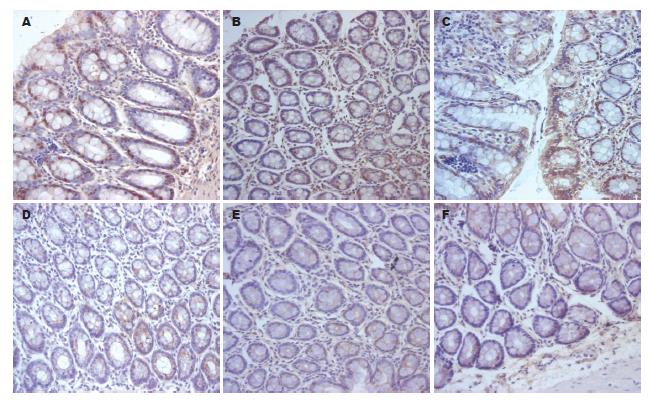
1.2.2 结肠黏膜CINC-1及CXCR2表达: 采用链酶亲合素生物素复合物(SABC)法加微波修复. 具体步骤严格按试剂盒说明进行操作, 用已知阳性标本作阳性对照, 以PBS代替一抗作阴性对照. 在光镜下观察免疫组织化学染色结果, 染色阳性表达为胞质或胞膜呈棕褐色颗粒. 每张切片随机选取5个高倍视野, 计数10 000个细胞, 计算阳性细胞百分比.
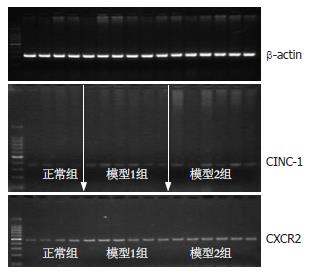
1.2.3 CINC-1及CXCR2 mRNA的表达: 采用RT-PCR法检测. Rat CINC-1引物序列: 上游引物5'-TCCAAAAGATGCTAAAGGGTGT-3'下游引物5'-AAATAGGACCCTCAATAGAAATCG-3'; Rat CXCR2引物序列: 上游引物5'-CCACCTTCTGAGGGAAGTCTTG-3'下游引物5'-TCCTGTTGCTGTGAGCTTGC-3'; β-actin引物序列: 上游引物5'-AAATAGGACCCTCAATAGAAATCG-3'下游引物5'-GCTGATCCACATCTGCTGGAA-3', 其扩增长度为210 bp(上海生工生物工程有限公司合成). TRIzol一步法提取组织总RNA, 取RNA产物10 mg, 用M-MLV逆转录酶合成cDNA, 然后用PCR扩增仪进行PCR反应. 用20 g/L琼脂糖电泳, 电泳结束后置凝胶成像系统中进行分析, 计算与内参β-actin的比值用以校正.
统计学处理 实验数据应用SPSS11.5 for Windows统计软件进行处理. 计量资料采用mean±SD表示, 组间差异采用单因素方差分析(One-way ANOVA), 经方差齐性检验后, 方差齐时用Scheffe法, 方差不齐时用Games-Howell法. P<0.05认为有统计学意义.
应用Image-pro PLUS 4.1版图像分析软件, 每个样本随机选取3个高倍视野, 计数10 000个细胞采用灰度值120-145, 计算阳性细胞数占总细胞数的百分比, 以此对相应蛋白的表达进行定量分析. CINC-1及CXCR2蛋白表达呈上升趋势, 与UC炎症活动呈正相关; 与正常组相比, 有显著性差异P<0.05(表1, 图1).
中性粒细胞(polymorphnuclear neutrophil, PMN) 是血液中数目最多的白细胞, 来源于骨髓的造血干细胞, 在骨髓中分化发育后, 进入血液或组织. PMN在先天免疫中具有重要的作用, 是炎症反应时最早到达感染或损伤部位的细胞, Lampinen et al[3]研究指出PMN在急性和活动期UC中起重要作用. PMN在促炎细胞因子、趋化性物质、和趋化性细胞因子作用下发生活化. PMN的生物学功能与其胞质内的多种颗粒密切相关, 其吞噬、杀菌、细胞毒、趋化和迁移等过程均由颗粒及其内容物如趋化因子及其受体等直接或间接介导.
趋化因子(chemokine)是能使细胞发生趋化作用的细胞因子总称, 最早发现于哺乳动物、鸟类及鱼类动物体内, 为一类结构功能相似, 分子量在8-10 kDa小分子质量蛋白质. 由中性粒细胞、单核细胞等多种细胞分泌产生, 主要表达于中性粒细胞、巨噬细胞等炎细胞表面, 亦可表达于上皮细胞、平滑肌细胞和成纤维细胞等细胞[4-5]. 根据多肽链一级构特点不同, 将趋化因子分为CXC亚家族和CC亚家族(C为半胱氨酸, X为任意氨基酸). CXC亚家族分子靠近N一端两个半胱氨酸之间有一个任意氨基酸, 主要作用于中性粒细胞, 对T、B等淋巴细胞也有趋化作用, 已发现16个CXC趋化因子[6]. 趋化因子受体[7]是一类介导趋化因子行使功能的GTP蛋白偶联的跨膜受体(GPCR), 通常表达于免疫细胞、内皮细胞等细胞膜上. 按趋化因子的分类, 将同CC类趋化因子结合的受体称为CC类受体(CCR), 同CXC类趋化因子结合的受体称为CXC类受体(CXCR)[8-9]. 趋化因子受体与趋化因子相互作用, 通常一种趋化因子受体能与多个趋化因子相结合, 而一个趋化因子可能有多个高亲和性受体, 他们共同构成复杂的网络系统, 在炎症性肠病中起重要作用[10].
研究发现UC活动期[11-13], 大量炎症细胞包括中性粒细胞、淋巴细胞等募集到损伤组织, 免疫细胞克服血管内皮细胞屏障, 在体液和组织间穿行包括多个步骤, 即细胞随体液流动; 细胞被稳固黏附到血管内皮上; 细胞穿过内皮细胞间隙; 细胞迁移到特定组织中. 在此过程中, 趋化因子通过细胞内信号转导过程控制着渗出细胞的选择性以及被选择细胞的稳固黏附. 表达增高的趋化因子除了对炎症细胞激活和趋化, 还能触发其他复杂的炎性活动, 包括颗粒胞吐、产生金属蛋白酶降解基质和上调氧化爆发等. 中性粒细胞趋化因子CINC-1[14-15]是一种和人IL-8类似的鼠源性趋化性细胞因子, 被看作是IL-8家族的一员, 对嗜中性粒细胞有很强的趋化作用. Williams et al[16]研究发现, UC病变肠黏膜的IL-8水平明显高于正常组织, 且与黏膜的PMN数、病灶的大体炎症程度呈正相关. 表明IL-8直接参与了UC的病理过程, 与炎症程度呈正相关. IL-8还可以促进PMN内容物的释放, 增加上皮细胞及单核细胞黏附分子的表达, 还能使肠成纤维细胞产生过量的基质降解酶, 破坏黏膜的完整性, 导致结肠组织损伤.
本研究初步发现活动性UC在炎症诱导下结肠组织中CINC-1蛋白及mRNA表达增高; CXCR 2主要表达在浸润的中性粒细胞及结肠上皮细胞膜上, CINC-1及其受体CXCR2的水平与肠道炎症程度呈正相关. 课题组推测CINC-1可能通过结合CXCR2激活胞膜上的钙泵, 细胞向前方伸出片足, 使细胞移向产生趋化因子的部位, 当中性粒细胞在局部聚集后, 在细胞因子及某些因素作用下活化, 释放胞质内的颗粒, 出现瀑布式的级联反应, 破坏结肠上皮细胞屏障, 导致结肠组织损伤、溃疡形成. 关于CINC-1结合CXCR2细胞内信号转导, 调控相应基因的表达, 最终使中性粒细胞发生迁移、造成组织损伤; 以及拮抗CINC-1结合CXCR2, 能否缓解UC的效应, 尚需要通过靶向研究如基因敲除技术、细胞培养、体外试验等进一步深入探讨.
溃疡性结肠炎(UC)是一种原因尚不明确的慢性非特异性肠道炎症, 病理变化局限在黏膜层及黏膜下层, 以隐窝结构扭曲及隐窝脓肿, 大量的中性粒细胞及淋巴细胞浸润为主要特征. 课题组在前期研究基础上, 运用RT-PCR法、免疫组化染色检测大鼠CINC-1及CXCR2 mRNA及其蛋白的表达, 发现CINC-1及其受体CXCR2的表达与UC炎症变化呈正相关.
房静远, 教授, 上海交通大学医学院附属仁济医院, 上海市消化疾病研究所
结肠黏膜免疫-炎症系统与肠道共生菌群之间的交互作用, 大量炎性细胞浸润及细胞因子的释放在UC发病中占据重要地位.
Williams et al研究发现, UC病变肠黏膜的IL-8水平明显高于正常组织, 且与黏膜的PMN数、病灶的大体炎症程度呈正相关.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
本文试图探讨UC大鼠结肠黏膜CINC-1及其受体CXCR2的表达及意义, 有一定新意.
编辑: 李军亮 电编:何基才
| 1. | Peppelenbosch MP, van Deventer SJ. T cell apoptosis and inflammatory bowel disease. Gut. 2004;53:1556-1558. [PubMed] [DOI] |
| 2. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 3. | Lampinen M, Sangfelt P, Taha Y, Carlson M. Accumulation, activation, and survival of neutrophils in ulcerative colitis: regulation by locally produced factors in the colon and impact of steroid treatment. Int J Colorectal Dis. 2008;23:939-946. [PubMed] [DOI] |
| 4. | Shea-Donohue T, Thomas K, Cody MJ, Aiping Zhao, Detolla LJ, Kopydlowski KM, Fukata M, Lira SA, Vogel SN. Mice deficient in the CXCR2 ligand, CXCL1 (KC/GRO-alpha), exhibit increased susceptibility to dextran sodium sulfate (DSS)- induced colitis. Innate Immun. 2008;14:117-124. [PubMed] [DOI] |
| 5. | Buanne P, Di Carlo E, Caputi L, Brandolini L, Mosca M, Cattani F, Pellegrini L, Biordi L, Coletti G, Sorrentino C. Crucial pathophysiological role of CXCR2 in experimental ulcerative colitis in mice. J Leukoc Biol. 2007;82:1239-1246. [PubMed] [DOI] |
| 6. | Bizzarri C, Beccari AR, Bertini R, Cavicchia MR, Giorgini S, Allegretti M. ELR+ CXC chemokines and their receptors (CXC chemokine receptor 1 and CXC chemokine receptor 2) as new therapeutic targets. Pharmacol Ther. 2006;112:139-149. [PubMed] [DOI] |
| 7. | Sun J, Ramnath RD, Bhatia M. Neuropeptide substance P upregulates chemokine and chemokine receptor expression in primary mouse neutrophils. Am J Physiol Cell Physiol. 2007;293:C696-C704. [PubMed] [DOI] |
| 8. | Christopherson K 2nd, Hromas R. Chemokine regulation of normal and pathologic immune responses. Stem Cells. 2001;19:388-396. [PubMed] [DOI] |
| 9. | Kishimoto S, Haruma K, Tari A, Sakurai K, Nakano M, Nakagawa Y. Rebamipide, an antiulcer drug, prevents DSS-induced colitis formation in rats. Dig Dis Sci. 2000;45:1608-1616. [PubMed] [DOI] |
| 10. | Murdoch C, Finn A. Chemokine receptors and their role in inflammation and infectious diseases. Blood. 2000;95:3032-3043. [PubMed] |
| 11. | Reddy KP, Markowitz JE, Ruchelli ED, Baldassano RN, Brown KA. Lamina propria and circulating interleukin-8 in newly and previously diagnosed pediatric inflammatory bowel disease patients. Dig Dis Sci. 2007;52:365-372. [PubMed] [DOI] |
| 12. | Forbes E, Murase T, Yang M, Matthaei KI, Lee JJ, Lee NA, Foster PS, Hogan SP. Immunopathogenesis of experimental ulcerative colitis is mediated by eosinophil peroxidase. J Immunol. 2004;172:5664-5675. [PubMed] |
| 13. | Yang SK, Choi MS, Kim OH, Myung SJ, Jung HY, Hong WS, Kim JH, Min YI. The increased expression of an array of C-X-C and C-C chemokines in the colonic mucosa of patients with ulcerative colitis: regulation by corticosteroids. Am J Gastroenterol. 2002;97:126-132. [PubMed] [DOI] |
| 14. | Reed KL, Fruin AB, Gower AC, Gonzales KD, Stucchi AF, Andry CD, O'Brien M, Becker JM. NF-kappaB activation precedes increases in mRNA encoding neurokinin-1 receptor, proinflammatory cytokines, and adhesion molecules in dextran sulfate sodium-induced colitis in rats. Dig Dis Sci. 2005;50:2366-2378. [PubMed] [DOI] |