修回日期: 2008-12-04
接受日期: 2008-12-08
在线出版日期: 2009-01-08
目的: 建立缺血-再灌注动物模型, 研究时间变化对肠道损伤的动态影响, 探索肠道损伤的最佳动物模型.
方法: Wistar大鼠随机分成对照组和缺血再灌注组共7组, 每组8只. 模型组分为肢体缺血再灌注组(Z组: Z3-12、Z3-18、Z3-24)和肠系膜上动脉缺血再灌注组(C组: C45-48、C60-48、C75-48). Z组缺血3 h后再灌注, 分别于12 h、18 h、24 h处死, C组采用不同缺血时间(45、60、75 min), 均于再灌注48 h后处死. 各实验组观察模型制备期间精神状态、生命体征; 留取小肠、结肠组织, 观察组织病理变化; 多道生理记录仪记测大鼠结肠平滑肌收缩的振幅.
结果: Z组: 大鼠精神状态均呈现萎靡, 活动减少; 肠组织病理损伤随再灌注时间延长而加重; 肌条振幅下降, 与对照组相比Z3-12、Z3-18组结肠平滑肌振幅(0.49±0.02, 0.46±0.02 vs 0.51±0.03, 均P<0.05). C组: 大鼠精神差, 活动少, 竖毛, 贴笼, 3组均出现死亡并随缺血时间延长死亡率增加. 肠组织病理损伤随缺血时间延长而加重, 结肠动力检测示C45-48组与对照组相比差别无统计学意义; 与正常组相比C60-48结肠肌条振幅有意下降(0.52±0.03 vs 0.56±0.03, P<0.05).
结论: 两种缺血再灌注模型均可造成肠道形态和运动功能的损伤. Z组随再灌注时间的延长而加重; C组随缺血时间延长而加重; C组因其易操作、少感染、死亡率低等优点更适合作为肠道损伤的动物模型.
引文著录: 王宏. 缺血-再灌注损伤对大鼠肠黏膜及运动功能的影响. 世界华人消化杂志 2009; 17(1): 43-48
Revised: December 4, 2008
Accepted: December 8, 2008
Published online: January 8, 2009
AIM: To set up an animal model of ischemia-reperfusion to explore the effects of different reperfusion time injury in rats and to find out a better model.
METHODS: The models of ischemia-reperfusion injury were randomly separated into 7 groups with 8 mice in each group. Model groups (Group Z) included limb ischemia-reperfusion (Z3-12, Z3-18, Z3-24); Group C was intestinal ischemia-reperfusion (C3-12, C3-18, C3-24). In Group Z, reperfusion was performed 3 h after ischemia and their mental status and vital signs were observed. All rats in group Z were scarified at 12, 18 and 24 h after reperfusion. Morphological changes of intestinal mucosa were observed through microscopy. Average contractile amplitude of colonic muscle strips was recorded using a multiscriptor. In group C, all rats were scarified 48 hours after reperfusion with different ischemia time (45, 60, 75 min). The same treatment was performed on group C.
RESULTS: In group Z, the rats' mental status became worse and was less active. The pathological injury of intestinal was worse with reperfusion time passing. In comparison with the control group, the average contractile amplitude of colonic muscle strips was decreased in Z3-12 group and Z3-18 group (0.49 ± 0.02, 0.46 ± 0.02 vs 0.51 ± 0.03, both P < 0.05). In group C, the rats' mental status became worse, and was less active. The death rate was higher as the ischemia time increased, and the pathological changes of intestinal became worse either. In comparison with the control group, the average contractile amplitude of colonic muscle strips was decreased in C60-48 group (0.52 ± 0.03 vs 0.56 ± 0.03, P < 0.05); but there was no difference between C45-48 and the control group.
CONCLUSION: Two types of models of ischemia-reperfusion result in morphological and functional injury; group Z became worse in intestine as the reperfusion time extended; group C became worse in intestine with the ischemia time extended. The model of limb ischemia-reperfusion is better than the intestinal one, because of its easy operation, less infection and lower death rates.
- Citation: Wang H. Effects of ischemia-reperfusion injury on intestinal mucosa and colon motility in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 43-48
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/43.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.43
目前, 大多采取肠系膜上动脉缺血再灌注[1-3]、夹闭肝门动脉[4-5]、腹主动脉[6]等方法造成肠道损伤. 本实验拟对比肠系膜上动脉缺血再灌注模型和肢体缺血再灌注模型对大鼠肠道损伤的动态变化特点, 探索肠道损伤最佳动物模型, 为进一步研究肠动力损伤奠定实验基础.
健康Wistar大鼠, 雌雄各半, 体质量195±15 g, 由中国人民解放军军事医学科学院实验动物中心提供, 许可证号SCXK-(军)2002-001. 正常对照组(N), Z组统一缺血3 h, 按照再灌注时间不同分为12 h组(Z3-12), 18 h组(Z3-18)和24 h组(Z3-24); C组统一再灌注48 h, 按照缺血时间分为45 min组(C45-48), 60 min组(C60-48), 75 min组(C75-48)每组8只. 实验动物适应性平衡饲养1 wk后用于实验. Olympus, BX-60光学显微, Image pro plus 6图像分析系统, SC-15型数控超级恒温槽(宁波), TSD-125C型张力传感器, MP-150型多导生理记录仪(Biopac), 竖型玻璃灌流浴槽(南开大学玻璃仪器厂); 100 g/L水合氯醛, 购自天津医科大学总医院制剂室.
1.2.1 模型制备: Z组: 在Yassin法[7]基础上采用拉力法进行统一结扎力度的改良[8]. 实验动物均于造模前24 h禁食, 自由饮水. 以100 g/L水合氯醛(3 mL/kg)行术前麻醉后, 结扎模型组及给药组大鼠双侧大腿根部, 持续3 h. 迅速解除结扎, 分别行肢体再灌注12、18、24 h. C组: 麻醉方法同Z组, 实验台上仰卧固定, 腹部脱毛后取腹部正中切口进腹, 暴露肠系膜上动脉(superior mesenteric artery, SMA), 各组分别用无创夹夹闭其根部45, 60, 75 min松夹即为再灌注, 在进行SMA夹闭期间, 间断地向腹腔内注射等渗盐水, 以预防或减轻在松开动脉夹后出现的一过性低血容量反应.
1.2.2 组织病理标本制备: 实验大鼠采用颈椎脱臼处死法, 迅速取出距回肠末端10 cm处肠组织2 cm, 纵行剖开, 40 g/L中性甲醛固定, 常规脱水, 石蜡包埋, 切片, HE染色, 光镜下观察.
1.2.3 肌条运动测定方法[9]: 实验结束, 迅速取出近端结肠(盲肠与结肠交界处2 cm以下)5 cm, 制备8 mm×2 mm结肠环行肌条. 将肌条固定于37 ℃恒温灌流浴槽内Krebs液中, 持续通入950 mL/L O2和50 mL/L CO2混合气体. 肌条与张力传感器相连, 张力传感器给予1 g负荷, 记录肌条的等长机械收缩活动.
1.2.4 Krebs液的配制: 称取NaCl 120.6 mmol/L, KCl 5.9 mmol/L, CaCl2 2.5 mmol/L, MgCl2 1.2 mmol/L, NaHCO3 15.5 mmol/L, NaH2PO4 1.2 mmol/L, 葡萄糖11.5 mmol/L, pH7.4. 最后得到148.4 mmol/L Krebs液.
统计学处理 应用SPSS11.5统计软件分析, 采用单因素方差分析和χ2检验进行组间比较.
Z组: Z3-12组多数大鼠出现精神欠佳, 毛色少泽, 3只出现腹胀腹泻, 双后肢活动尚自如; Z3-18组精神差, 毛色晦暗, 腹胀腹泻, 双后肢活动欠佳; Z3-24组精神萎靡, 毛色晦暗, 多数出现腹胀及腹泻. 其中死亡1只, 休克状态1只, 余者蜷缩、畏寒、活动少. C组: C45-48组大鼠精神不佳, 少活动, 贴笼, 死亡1只; C60-48组精神差, 竖毛, 死亡3只; C75-48组精神极差, 毛色晦暗, 少动, 偶有腹部抽搐, 死亡4只.
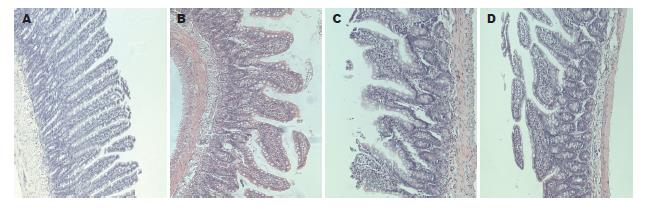
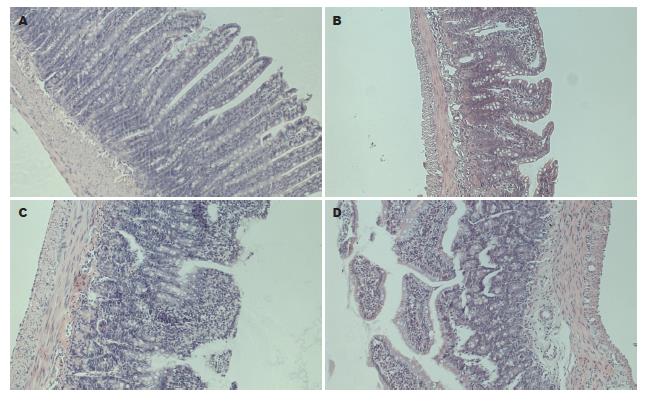
2.2.1 镜下所见: 如图1所示, 正常组肠绒毛基本正常. Z组: Z3-12组肠绒毛出现排列不整, 绒毛萎缩变短增粗; 间质充血、水肿, 部分检体淋巴管扩张、炎细胞浸润. Z3-18组肠绒毛排列不整, 绒毛萎缩、增粗, 部分绒毛脱落、缺损, 间质明显充血、水肿、淋巴管扩张, 大量炎细胞浸润; 上皮细胞排列不整, 变性坏死. Z3-24组绒毛增粗变短, 脱落、缺损, 上皮细胞变性坏死, 杯细胞增多, 肠隐窝明显肥厚, 且间质除充血、水肿、淋巴管扩张并见大量炎细胞浸润. 如图2所示, C组: C45-48组绒毛出现排列不整, 间质充血、水肿、淋巴管扩张、部分炎细胞浸润、绒毛萎缩变短增粗; C60-48组肠绒毛排列不整, 绒毛萎缩折断, 部分绒毛脱落、缺损, 间质明显充血、水肿、淋巴管扩张, 大量炎细胞浸润, 上皮细胞排列紊乱, 变性坏死. C75-48组绒毛增粗变短, 脱落、缺损, 上皮细胞大量变性坏死, 间质除充血、水肿、淋巴管扩张并见大量炎细胞浸润, 部分黏膜下层与肌壁层分离.
2.2.2 小肠绒毛形态分类法: 将肠绒毛分为5类[10], 每检体计数20根绒毛, Ⅰ-Ⅲ为正常型, Ⅳ-Ⅴ为异常型, 计算正常型百分比. 与正常组相比Z组各组正常绒毛比率均呈有意下降(P<0.05); Z组组内比较, 与Z3-12组相比Z3-18组和Z3-24组正常绒毛比率呈有意下降(P<0.05), 与Z3-18组相比Z3-24组的正常绒毛比率呈有意下降(P<0.05, 表1). 与正常组相比C组各组正常绒毛比率均呈有意下降(P<0.05); C组组内比较, 与C45-48组相比C60-48组和C75-48组正常绒毛比率呈有意下降(P<0.05), 与C60-48组相比C75-48组的正常绒毛比率呈有意下降(P<0.05, 表2).
肠系膜上动脉为肠道的主要血管, 当肠道处于缺血状态后其血流恢复需48 h[11], 本实验探讨统一再灌注48 h, 而不同缺血时间状态下的肠道损伤的动态变化; 肢体缺血再灌注是利用统一拉力橡皮筋束缚大鼠双下肢股动静脉造成下肢缺血, 通过再灌注后产生的二次打击对其远端器官-肠道造成损伤, 故此采用统一缺血时间不同再灌注时间观察肠道损伤的动态变化.
缺血再灌注损伤是一个复杂的生理病理改变[12]. 机体在正常情况下, 循环血流的30%流经胃肠道. 当机体遭受严重创伤或休克时, 机体为了保护心、脑等重要器官, 使全身血液重新分配, 胃肠道血流明显减少. 若全身血流量减少10%, 即可导致胃肠道血流减少40%[13], 造成了肠道的屏障损伤和动力障碍. 一般将肠屏障归纳为四部分: 机械屏障, 即黏膜上皮; 生物屏障, 即肠道内的常居菌群; 化学屏障, 即胃酸、胆汁、溶菌酶、黏多糖和蛋白分解酶等; 免疫屏障. 其中机械屏障尤其是小肠黏膜上皮细胞非常重要, 他在充满细菌和毒素的肠腔和其他组织及血循环之间构建了一个物理性屏障, 一般意义上的肠屏障即指这层结构, 应激状态下, 其结构的完整性被破坏, 致使机械屏障作用减弱[14-17]. 肠黏膜低灌注, 细胞因子作用及氧自由基损伤是肠黏膜三大主要致伤因素[18]. 肠黏膜在解剖上有其特点: 小肠绒毛营养血管呈发夹状, 发夹顶端位于绒毛项部, 故其血供较差. 加之绒毛营养血管从母支直角分发, 致营养绒毛血液的氧容量下降, 因此在病理情况下, 肠绒毛顶端更容易发生缺血性损害. 缺血缺氧时, 使得肠黏膜上皮水肿, 上皮细胞膜及细胞间连接断裂, 细胞坏死, 上皮从绒毛顶端开始脱落甚至黏膜全层脱落而形成溃疡, 导致肠通透性增加[19], 肠血供减少越多, 肠壁细胞超微结构破坏就会越严重[20]. 小肠在缺血再灌注后, 其黏膜和肌层均有白细胞的聚积和炎性反应并且减弱了肌肉的收缩功能, 同时肠黏膜的屏障功能受到破坏如肠黏膜上皮细胞的坏死、脱落、出血及溃疡等. T淋巴细胞还能调节小肠后微血管的炎症应答, 小肠内缺血再灌注损伤后伴随出现CD4+和CD8+和T淋巴细胞的募集反应, 该反应是由内皮MAdCAM-1介导的. T淋巴细胞调整了在发生缺血再灌注几小时后出现的多形核白细胞的募集反应, 这对于改善小肠缺血再灌注损伤后出现的炎症反应有很大意义[21]. McCord(1985年)首次提出再灌注损伤的概念, 从此自由基在再灌注损伤中的作用得以重视. 氧自由基在再灌注期主要来自黄嘌呤氧化酶途经. 在缺血期, 肠黏膜中丰富的黄嘌呤脱氢酶转化为黄嘌呤氧化酶, 腺苷酸分解代谢为次黄嘌呤, 在缺血组织中累积. 再灌注期, 氧随着血流的恢复进入缺血组织, 在黄嘌呤氧化酶的作用下次黄嘌呤与氧分子作用生成黄嘌呤, 最终生成尿酸. 在这一过程中释放大量的氧自由基, 其具有强氧化性而能使脂质过氧化、蛋白变性, 从而产生细胞毒害作用[22].
前人做过不同缺血、再灌注时间研究发现:缺血15 min再灌注60 min的小鼠, 肠黏膜损伤的早期形态学改变为小肠绒毛上皮分离[23]. 缺血30 min再灌注60 min, 小肠上皮细胞脱落, 绒毛尖端上皮抬高, 与固有膜剥离, 可见散在的溃疡和出血灶, 并有大量的中性粒细胞浸润[24]. 缺血45 min再灌注60 min, 出现了绒毛两侧上皮成块脱落, 部分上皮完全脱落, 仅存固有膜, 肠壁变薄[25]. 缺血1 h再灌注2 h, 有多部位不同程度的肠黏膜绒毛上皮脱落、黏膜下水肿、毛细血管扩张、瘀血[26]. 缺血1 h再灌注3 h即可出现肠黏膜绒毛上皮下间隙增宽, 绒毛上皮与固有层剥离、脱落+. 不同的缺血时间及再灌注时间, 均能造成小肠黏膜的损伤, 再灌注2-3 h时为早期, 晚期则可持续到再灌注后12-24 h甚至3-4 d[28]. 从上述研究中难以发现缺血再灌注时间变化与损伤的程度之间的规律; 另外, 前期实验[2]利用单一时间点探讨了肠屏障的损伤情况, 阐释了肢体缺血再灌注模型对肠屏障具有损伤作用, 然而并未对其动态变化进行深入探讨, 故此, 本实验借鉴前人经验进行规律性研究, 结果提示: 两种动物模型在不同缺血、再灌注时间下均可对肠屏障损伤产生动态影响.
缺血再灌注不仅损伤肠屏障, 也对肠道功能具有损伤作用[29], 可导致肠神经节细胞凋亡[30]并对肠平滑肌收缩、传输功能产生影响[31-33]. 结肠的血管不具有小肠的血管特点, 对于缺血再灌注损伤的耐受比小肠好, 肠黏膜损伤程度较轻[34]. 细菌移位也是肠黏膜损伤的重要原因, 缺血再灌注后小肠出现细菌移位, 而结肠几乎没有没发生移位, 黏膜损伤不明显[35], 同时由于针对小肠屏障的研究目前开展较为普遍, 故此本实验重点探讨结肠动力损伤情况. 结肠是消化系的重要组成部分, 主要生理功能为吸收水分、某些电解质、短链脂肪酸和细菌的代谢产物, 贮存和排泄粪便. 结肠的精确运动形式主要表现为袋状往返运动、分节推进运动、多袋推进运动和蠕动等4种类型. 其运动的调控主要依赖于电活动在肠肌内的扩散, 肠内神经的反射, 交感、副交感神经的反射和激素调节. 针对缺血再灌注造成结肠动力损伤动态变化的探讨国内外较少. 前期实验结果表明, 肢体缺血再灌注可引发血清NO明显升高[2], 可导致结肠运动功能障碍[36-37]. 前人已证实[38-39], 单一时间点的肢体缺血再灌注可以造成结肠动力障碍, 其机制与结肠平滑肌细胞内钙离子浓度相关, 由此推测本实验中出现的动力障碍变化可能与钙离子浓度变化相关, 今后将就此问题进行深入探讨. 本实验用37℃恒温、950 mL/L O2、50 mL/L CO2及Krebs液浸浴组织等方法模拟生态环境, 记录到的离体肌条活动稳定可靠, 可以直观的反映结肠运动情况, 便于观察动态时间变化下的动力损伤程度.
肠系膜上动脉缺血再灌注模型和肢体缺血再灌注模型, 均可造成肠屏障和肠动力的损伤, 然而肢体缺血再灌注模型因其易操作、无感染且死亡率低等特点更便于对肠道损伤的研究. 今后, 将就此模型对肠动力损伤的变化进行深入研究和探讨.
目前, 大多采取肠系膜上动脉缺血再灌注、夹闭肝门动脉、腹主动脉等方法建立肠道损伤动物模型. 然而, 这些方法存在伤口易感染, 死亡率较高等不足.
程爱国, 教授, 华北煤炭医学院临床医学系
缺血再灌注导致肠黏膜损伤是一个研究热点, 涉及多个研究领域.
有研究表明缺血30 min再灌注60 min, 可引起小肠上皮细胞脱落, 绒毛尖端上皮抬高, 与固有膜剥离, 可见散在的溃疡和出血灶, 并有大量的中性粒细胞浸润. 缺血45 min再灌注60 min, 出现了绒毛两侧上皮成块脱落, 部分上皮完全脱落, 仅存固有膜, 肠壁变薄.
采用较为简便易行、不会造成感染的动物模型方法; 观察动态时间下的损伤肠道变化, 探索损伤程度变化规律; 进行运动功能实验, 探讨肠动力损伤.
肢体缺血再灌注动物模型, 不仅可以作为肠黏膜损伤动态变化的造模方法, 还可用于探讨肠动力损伤的动态变化.
本研究作为今后深入研究肢体缺血再灌注性损伤对肠道四大屏障功能的影响是有意义的, 具有参考价值.
编辑: 史景红 电编:何基才
| 2. | Liu KX, Chen SQ, Huang WQ, Li YS, Irwin MG, Xia Z. Propofol pretreatment reduces ceramide production and attenuates intestinal mucosal apoptosis induced by intestinal ischemia/reperfusion in rats. Anesth Analg. 2008;107:1884-1891. [PubMed] [DOI] |
| 3. | Teke Z, Sacar M, Yenisey C, Atalay AO, Kavak T, Erdem E. Activated protein C attenuates intestinal mucosal injury after mesenteric ischemia/reperfusion. J Surg Res. 2008;149:219-230. [PubMed] [DOI] |
| 7. | Yassin MM, Barros D'Sa AA, Parks TG, McCaigue MD, Leggett P, Halliday MI, Rowlands BJ. Lower limb ischaemia- reperfusion injury alters gastrointestinal structure and function. Br J Surg. 1997;84:1425-1429. [PubMed] |
| 9. | 周 吕, 柯 美云. 胃肠动力学: 基础与临床. 北京: 科学出版社 1999; 293-303. |
| 10. | Lee FD, Tonar PG. Biopsy pathology of the small intestine. London: Chapmann and Hall 1980; 7-35. |
| 12. | Bastide M, Bordet R, Pu Q, Robin E, Puisieux F, Dupuis B. Relationship between inward rectifier potassium current impairment and brain injury after cerebral ischemia/reperfusion. J Cereb Blood Flow Metab. 1999;19:1309-1315. [PubMed] [DOI] |
| 14. | MacFie J, O'Boyle C, Mitchell CJ, Buckley PM, Johnstone D, Sudworth P. Gut origin of sepsis: a prospective study investigating associations between bacterial translocation, gastric microflora, and septic morbidity. Gut. 1999;45:223-228. [PubMed] |
| 15. | 尉 秀清, 姚 集鲁, 文 卓夫. 肠道粘膜屏障功能及其临床检测. 国外医学·内科学分册. 2004;31:415-418. |
| 16. | 王 彤, 赵 欣, 王 尧华. 肠内早期中药干预对肠黏膜屏障的保护作用. 中国中西医结合外科杂志. 2003;9:410-412. |
| 20. | Yüksek YN, Kologlu M, Daglar G, Doganay M, Dolapci I, Bilgihan A, Dolapçi M, Kama NA. Intestinal ischemia-reperfusion injury augments intestinal mucosal injury and bacterial translocation in jaundiced rats. Hepatogastroenterology. 2004;51:171-175. [PubMed] |
| 21. | Shigematsu T, Wolf RE, Granger DN. T-lymphocytes modulate the microvascular and inflammatory responses to intestinal ischemia-reperfusion. Microcirculation. 2002;9:99-109. [PubMed] [DOI] |
| 22. | Köksoy C, Kuzu MA, Ergün H, Demirpençe E, Zülfikaroglu B. Intestinal ischemia and reperfusion impairs vasomotor functions of pulmonary vascular bed. Ann Surg. 2000;231:105-111. [PubMed] [DOI] |
| 23. | Ikeda H, Suzuki Y, Suzuki M, Koike M, Tamura J, Tong J, Nomura M, Itoh G. Apoptosis is a major mode of cell death caused by ischaemia and ischaemia/reperfusion injury to the rat intestinal epithelium. Gut. 1998;42:530-537. [PubMed] [DOI] |
| 26. | 胡 晓敏, 吕 阳, 姚 尚龙. 丙泊酚对大鼠肠缺血再灌注损伤的影响. 华中科技大学学报(医学版). 2007;36:210-213. |
| 28. | Mallick IH, Yang W, Winslet MC, Seifalian AM. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 2004;49:1359-1377. [PubMed] [DOI] |
| 29. | Moore-Olufemi SD, Kozar RA, Moore FA, Sato N, Hassoun HT, Cox CS Jr, Kone BC. Ischemic preconditioning protects against gut dysfunction and mucosal injury after ischemia/reperfusion injury. Shock. 2005;23:258-263. [PubMed] |
| 30. | Linhares GK, Martins JL, Fontanezzi F, Patrício Fdos R, Montero EF. Do lesions of the enteric nervous system occur following intestinal ischemia/reperfusion? Acta Cir Bras. 2007;22:120-124. [PubMed] [DOI] |
| 31. | Ladipo JK, Seidel SA, Bradshaw LA, Halter S, Wikswo JP Jr, Richards WO. Histopathologic changes during mesenteric ischaemia and reperfusion. West Afr J Med. 2003;22:59-62. [PubMed] |
| 32. | Ballabeni V, Barocelli E, Bertoni S, Impicciatore M. Alterations of intestinal motor responsiveness in a model of mild mesenteric ischemia/reperfusion in rats. Life Sci. 2002;71:2025-2035. [PubMed] [DOI] |
| 33. | Attuwaybi BO, Hassoun HT, Zou L, Kozar RA, Kone BC, Weisbrodt NW, Moore FA. Hypothermia protects against gut ischemia/reperfusion-induced impaired intestinal transit by inducing heme oxygenase-1. J Surg Res. 2003;115:48-55. [PubMed] [DOI] |
| 34. | Chang JX, Chen S, Ma LP, Jiang LY, Chen JW, Chang RM, Wen LQ, Wu W, Jiang ZP, Huang ZT. Functional and morphological changes of the gut barrier during the restitution process after hemorrhagic shock. World J Gastroenterol. 2005;11:5485-5491. [PubMed] |
| 36. | 杜 军, 候 艳, 刘 景丽, 刘 晓燕, 冯 伟燕, 戈 应滨. 一氧化氮对糖尿病小鼠近端结肠动力有抑制作用. 南京医科大学学报 (自然科学版). 2008;28:1109-1112. |
| 37. | Takahashi A, Tomomasa T, Kaneko H, Watanabe T, Tabata M, Morikawa H, Tsuchida Y, Kuwano H. Intestinal motility in an in vivo rat model of intestinal ischemia-reperfusion with special reference to the effects of nitric oxide on the motility changes. J Pediatr Gastroenterol Nutr. 2001;33:283-288. [PubMed] [DOI] |