修回日期: 2008-12-10
接受日期: 2008-12-15
在线出版日期: 2009-01-08
目的: 探讨依达拉奉对L-精氨酸诱导的重症急性胰腺炎(SAP)大鼠的治疗作用及机制.
方法: 将60只大鼠随机分为三组(n = 20). 采用大鼠腹腔内分次注射大剂量L-精氨酸(2.5 g/kg×2, 间隔1 h)的方法制备SAP大鼠模型, 治疗组大鼠腹腔内注射依达拉奉注射液3 mg/kg, bid×3 d. 72 h后比较三组大鼠胰腺组织病理变化、腹水性状及量、血清淀粉酶(AMY)、TNF-α、IL-6水平和胰腺组织丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)含量及预后.
结果: 72 h后, 与对照组相比, SAP组出现典型的SAP病理形态改变, 腹水量较多(5.16±1.52 vs 0.50±0.10, P<0.01), 且大鼠血清AMY、TNF-α、IL-6及胰腺组织MDA均显著升高(8967.5±298.4 vs 720.1±119.7; 103.98±10.56 vs 41.59±3.79; 548.57±10.45 vs 198.34±2.10; 35.6±3.8 vs 7.9±2.2, 均P<0.01), 胰腺组织抗氧化物质GSH、SOD明显降低(7.2±0.6vs 17.1±2.1; 7300±1800 vs 28400±2700, 均P<0.01); 与SAP组相比, 治疗组胰腺组织病理损害减轻, 腹水量减少(4.05±1.22 vs 5.16±1.52, P<0.05), 且组织病理评分较低(P<0.05), 血清AMY、TNF-α、IL-6及胰腺组织MDA明显降低(7809.5±158.3 vs 8967.5±298.4; 79.80±14.23 vs 103.98±10.56; 467±6.64 vs 548.57±10.45; 29.1±2.6 vs35.6±3.8, 均P<0.05), 胰腺组织GSH、SOD升高(8.7±1.3 vs 7.2±0.6; 114 000±27 000 vs 7300±1800, 均P<0.05).
结论: 依达拉奉能清除氧自由基、提高胰腺组织抗氧化物质SOD和GSH含量, 降低促炎细胞因子水平, 可减轻胰腺组织的病理损害, 并且有可能降低死亡率.
引文著录: 龚平, 张彧, 宋政军. 依达拉奉对大鼠重症急性胰腺炎的保护作用. 世界华人消化杂志 2009; 17(1): 31-35
Revised: December 10, 2008
Accepted: December 15, 2008
Published online: January 8, 2009
AIM: To investigate the therapeutic effects and mechanism of edaravone on rats with severe acute pancreatitis (SAP) induced by L-arginine.
METHODS: A total of 60 rats were randomly and equally divided into three groups, namely control group, SAP model group and edaravone treatment group (n = 20). A SAP model was established by injecting intraperitoneally with L-arginine at a dose of 2.5 g/kg twice at an interval of 1 h, and injecting intravenously with edaravone 3 mg/kg, bid × 3 d (edaravone treatment group). The characteristics and volume of ascites, the pathological changes of pancreatic tissue and the serum levels of amylase (AMY), tumor necrosis factor-α (TNF-α), interleukin (IL)-6 and the contents of malonaldehyde (MDA), superoxide dismutase (SOD), glutathione (GSH) in pancreatic tissue of rats and prognosis were compared after 72 h following administration of L-arginine.
RESULTS: Compared with control group, 72 h after administration of L-arginine, SAP model group showed typical histopathological changes of SAP, elevated the volume of ascites (5.16 ± 1.52 vs 0.50 ± 0.10, P < 0.01), and significantly higher serum levels of AMY, TNF-α, IL-6 and content of MDA of pancreatic tissue (8967.5 ± 298.4 vs 720.1 ± 119.7I; 103.98 ± 10.56 vs 41.59 ± 3.79; 548.57 ± 10.45 vs 198.34 ± 2.10; 35.6 ± 3.8 vs 7.9 ± 2.2, all P < 0.01), and lower GSH and SOD in pancreatic tissue (7.2 ± 0.6 vs 17.1 ± 2.1; 7300 ± 1800 vs 28 400 ± 2700, both P < 0.01). Compared with SAP model group, 72 h after administration of L-arginine, significantly alleviated pathological lesions of SAP, decreased volume of ascites (4.05 ± 1.22 vs 53.16 ± 1.52, P < 0.05), lower pathological scores (P < 0.05), lower serum levels of AMY, TNF-α, IL-6 and MDA in pancreatic tissue (7809.5 ± 158.3 vs 8967.5 ± 298.4; 79.80 ± 14.23 vs 103.98 ± 10.56; 467 ± 6.64 vs548.57 ± 10.45; 29.1 ± 2.6 vs 35.6 ± 3.8, all P < 0.05), and higher GSH and SOD in pancreatic tissue were observed in edaravone treatment group (8.7 ± 1.3 vs 7.2 ± 0.6; 114 000 ± 27 000 vs 7300 ± 1800, both P < 0.05).
CONCLUSION: Edaravone can scavenge oxygen-derived free radicals, upgrade the contents of SOD and GSH in pancreatic tissue, decrease the serum levels of proinflammatory cytokines and, ameliorate the pathological lesions of pancreatic tissue in rats, and has a possibility of decreasing death rate.
- Citation: Gong P, Zhang Y, Song ZJ. Protective effects of edaravone on rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 31-35
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/31.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.31
重症急性胰腺炎(severe acute pancreatitis, SAP)是胰腺内部及周边发生炎症和坏死, 常并发多脏器功能衰竭, 病情凶险, 死亡率很高[1-2]. 其发病机制目前尚不完全清楚, 但氧自由基对胰腺及胰外器官的损伤是各种病因所致的SAP的共同发病环节. 依达拉奉(edaravone)是一种新型的自由基清除剂, 临床上已经广泛用于改善缺血性脑损害, 研究证实他具有独特的清除自由基、抑制脂质过氧化, 减轻缺血再灌注的作用,能抑制大脑的血管内皮细胞和神经细胞的过氧化作用[3-5], 但在重症胰腺炎中的作用尚未见报道.本实验旨在探索依达拉奉对SAP大鼠氧化应激的影响, 为临床治疗提供理论依据.
SOD、MDA测定试剂盒, 南京建成生物工程研究所; L-精氨酸, 美国Sigma公司, 使用时用生理盐水配成浓度为200 g/L的溶液; 大鼠IL-6及TNF-α ELISA试剂盒, 武汉博士德公司; 依达拉奉注射液, 南京先声东元制药有限公司. 健康成年SD大鼠60只, 体质量240-300 g, 雌雄不限, 由大连医科大学实验动物中心提供. 将大鼠随机分为3组, 即对照组、SAP组、依达拉奉治疗组(治疗组), 每组20只.
1.2.1 动物模型制备: 实验前后大鼠自由进食饮水. SAP组和治疗组大鼠分2次间隔1 h ip 200 g/L L-精氨酸溶液(2.5 g/kg×2)[6-7]; 对照组同法注射等量生理盐水.
1.2.2 给药剂量及方式: 从首次ip 200g/L L-精氨酸溶液前30 min开始, 治疗组大鼠ip依达拉奉注射液3 mg/kg, 2次/d, 连续3 d[8], 其余两组同法予等量生理盐水.
1.2.3 主要检侧指标及方法: (1)72 h后, 每组大鼠用注射器刺入心脏采血4-8 mL, 不加抗凝剂, 血凝后4℃下3000 r/min离心10 min, 取血清1.5-3 mL, -8℃保存. ELISA法检测TNF-α、IL-6; 全自动生化仪检测AMY; (2)采血后大鼠立即断颈致死、剖腹, 观察腹水性状及量(用注射器吸引腹水并收集于试管中)、胰腺外观, 并立即在胰头、胰体、胰尾各取1块组织, 加入预冷的生理盐水, 在冰上碾成匀浆, 离心取上清液, 采用硫代巴比妥酸比色分析法测定MDA含量, 黄嘌呤氧化酶法检测SOD活性, 具体操作均严格按试剂盒说明书进行. (3)组织病理学观察: 大鼠处死后, 另取胰腺组织, 在100 g/L甲醛中固定, 石蜡包埋切片, 苏木精/伊红(HE)染色, 光镜下观察, 并按照Kusske方法[9]根据水肿、炎症、出血、坏死程度不同分0-4分进行双盲法胰腺组织病理评分.
统计学处理 采用SPSS13.0统计软件处理数据, 计量资料以mean±SD表示, 组间比较用t检验; 计数资料用Fisher确切概率法检验; P<0.05为差异有统计学意义.
2.2.1 大体观察: 剖腹后, 对照组见少量清亮腹水, SAP组、治疗组均见淡红色腹水, 而治疗组腹水量较SAP组少(P<0.05, 表1). 对照组胰腺外观未见异常; SAP组和治疗组胰腺均可见明显充血水肿、坏死、胰周脂肪皂化, 治疗组程度较轻.
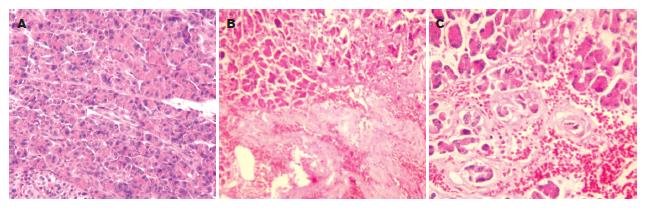
2.1.2 组织病理学变化: 对照组胰腺结构正常(图1A); SAP组大鼠胰腺分叶结构模糊, 大片腺泡细胞坏死和广泛炎细胞浸润, 间质水肿明显, 血管充血、出血, 并可见脂肪坏死(图1B); 治疗组上述改变较SAP组减轻(图1C).
2.1.3 组织病理评分: SAP组和治疗组4项评分均高于对照组(P<0.01); 治疗组4项评分均低于SAP组(P<0.05, 表2).
72 h后, SAP组和治疗组大鼠AMY、MDA、TNF-α、IL-6均显著高于对照组(P<0.01), SOD和GSH明显低于对照组(P<0.01); 但与SAP组比较, 治疗组大鼠AMY、MDA、TNF-α、IL-6均明显降低(P<0.05), SOD、GSH升高(P<0.05, 表3).
在72 h内, SAP组大鼠死亡3只, 治疗组死亡1只, 对照组无死亡. 各组大鼠72 h死亡率: 对照组为0(0/20), SAP组15%(3/20), 治疗组5%(1/20), 提示治疗组死亡率低于SAP组, 但差异无统计学意义(P = 0.25).
目前己发现炎性介质、微循环障碍等因素参与了SAP的发生发展[10-15], 尤其是胰腺微循环障碍和缺血-再灌注损伤导致的氧自由基损害在SAP的进展中具有重要的作用[16-19]. 氧自由基与SAP的发病以及胰外脏器损伤关系密切, 早期胰腺细胞损伤可导致胰腺腺泡细胞胰酶的激活, 诱发局部炎症反应, 引起炎症细胞释放大量的活性氧(reactive oxygen species, ROS)及炎性介质等, 氧化应激还与炎性介质发挥协同作用, 触发共同的信号传导通路, 主要通过促细胞丝裂原活化蛋白激酶(MAPK)和激活NF-KB等, 导致了炎症的级联扩增, 引起SIRS和MODS[20-22]. 大量的氧自由基还直接损害蛋白质、核酸、脂质和多糖等大分子, 导致胰腺水肿、出血和组织变性、坏死. GSH、抗氧化酶SOD和脂质过氧化反应产物MDA含量可反映自由基水平[23-24].
大鼠腹腔内注射大剂量L-精氨酸是一种非侵入性的建立SAP实验模型方法, 已经在国内外广泛使用. 单次注射大剂量L-精氨酸(5 g/kg), 大鼠死亡率高, 而分次腹腔内注射大剂量L-精氨酸(2.5 g/kg×2, 间隔1 h)建立的SAP模型比较理想[6-7]. 本实验中我们观察到腹腔内分次注射大剂量L-精氨酸72 h后出现典型的SAP病理形态及病理生理改变, 与对照组相比, 胰腺明显出血、坏死, 出现较多的血性腹水(P<0.01); 血清AMY、促炎细胞因子TNF-α和IL-6, 以及胰腺组织脂质过氧化反应产物MDA均显著升高(P<0.01), 而胰腺组织抗氧化物质GSH、SOD明显降低(P<0.01).
依达拉奉化学名为3-甲基-1-苯基-2-吡唑啉-5-酮, 是目前临床上广泛使用的一种新型自由基清除剂[3-5,25-31]. 本研究结果显示, 诱发SAP 72 h后, 与SAP组相比, 达拉奉治疗组大鼠胰腺组织MDA明显降低(P<0.05), 抗氧化物质GSH、SOD升高(P<0.05); 血清AMY水平较低, 胰腺组织病理形态改变减轻, 腹水量减少(P<0.05), 组织病理评分较低(P<0.05). 另外还发现, 促炎细胞因子TNF-α和IL-6也明显下降(P<0.05).这提示SAP时自由基大量产生, 清除氧自由基的能力明显不足, 而依达拉奉能清除氧自由基, 相应地提高抗氧化物质水平, 同时可降低促炎细胞因子水平, 减轻胰腺的病理损害. 但是其上游调控机制并不清楚, 我们将在以后的实验中进一步研究. 在本实验中还发现经依达拉奉治疗的大鼠死亡率低于未治疗的SAP组, 但差异无统计学意义(P = 0.25), 这可能受样本量小和观察时间短的影响.
总之, SAP时氧自由基大量产生, 而抗氧化应激能力明显不足, 依达拉奉能清除氧自由基、提高胰腺组织抗氧化物质SOD和GSH的含量, 降低促炎细胞因子水平, 减轻胰腺组织的病理损害, 并且有可能降低死亡率, 但是其临床效果需要进一步验证.
重症急性胰腺炎(SAP)起病急、进展快、病情凶险、死亡率很高, 发病机制并不十分清楚, 氧自由基对胰腺及胰外器官的损伤是各种病因所致的SAP共同发病环节, 近年来抗氧化治疗受到重视.
周国雄, 主任医师, 南通大学附属医院消化内科
氧化应激在急性胰腺炎发病机制中的作用以及抗氧化治疗是当前研究的热点. 依达拉奉是一种新型的自由基清除剂, 大量基础和临床实验均证实他能够清除缺血性脑血管病的自由基、有保护大脑的作用, 并且疗效确切, 但他对SAP中氧化应激的作用未见报道.
Roth et al认为氧化应激是由活性氧或活性氮大量产生或内源性抗氧化能力降低引起的; 在各种危重病中, 比如急性胰腺炎、脓毒症、创伤、烧伤、ARDS等, 都存在氧化应激增强或抗氧化应激能力降低; 活性氧或活性氮以前被认为是有害的, 但他们还可以作为重要的信使分子参与基因调节, 促进某些抑制炎症过程的细胞因子或黏附分子的合成.
本研究发现依达拉奉能清除由L-精氨酸诱导的大鼠SAP产生的氧自由基、提高胰腺组织抗氧化物质SOD和GSH含量, 降低促炎细胞因子水平, 减轻胰腺组织的病理损害, 并有可能降低死亡率.
该动物实验证实SAP时氧自由基大量产生, 而抗氧化应激能力明显不足, 依达拉奉能清除SAP大鼠的氧自由基、提高胰腺组织抗氧化物质的含量, 对大鼠SAP具有保护作用, 为其临床应用提供了理论依据, 但临床疗效需要进一步验证.
活性氧(ROS): 是指一组含有化学性质活泼的含氧功能基团的化合物, 包括含氧自由基、氢过氧化物、脂质过氧化物等.
本文探讨依达拉奉对L-精氨酸诱导的重症急性胰腺炎大鼠的治疗作用及机制, 设计较科学, 数据可靠, 统计正确, 结果有一定的可靠性, 具有较好的临床参考价值.
编辑: 史景红 电编:吴鹏朕
| 1. | Fu CY, Yeh CN, Hsu JT, Jan YY, Hwang TL. Timing of mortality in severe acute pancreatitis: experience from 643 patients. World J Gastroenterol. 2007;13:1966-1969. [PubMed] |
| 2. | Kong L, Santiago N, Han TQ, Zhang SD. Clinical characteristics and prognostic factors of severe acute pancreatitis. World J Gastroenterol. 2004;10:3336-3338. [PubMed] |
| 3. | Yoshida H, Yanai H, Namiki Y, Fukatsu-Sasaki K, Furutani N, Tada N. Neuroprotective effects of edaravone: a novel free radical scavenger in cerebrovascular injury. CNS Drug Rev. 2006;12:9-20. [PubMed] [DOI] |
| 4. | Watanabe T, Tahara M, Todo S. The novel antioxidant edaravone: from bench to bedside. Cardiovasc Ther. 2008;26:101-114. [PubMed] [DOI] |
| 5. | Watanabe T, Tanaka M, Watanabe K, Takamatsu Y, Tobe A. [Research and development of the free radical scavenger edaravone as a neuroprotectant]. Yakugaku Zasshi. 2004;124:99-111. [PubMed] [DOI] |
| 6. | Hegyi P, Rakonczay Z Jr, Sári R, Góg C, Lonovics J, Takács T, Czakó L. L-arginine-induced experimental pancreatitis. World J Gastroenterol. 2004;10:2003-2009. [PubMed] |
| 8. | Song Y, Gong YY, Xie ZG, Li CH, Gu Q, Wu XW. Edaravone (MCI-186), a free radical scavenger, attenuates retinal ischemia/reperfusion injury in rats. Acta Pharmacol Sin. 2008;29:823-828. [PubMed] [DOI] |
| 9. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 12. | Panek J, Zasada J, Poźniczek M. [Microcirculatory disturbance in the course of acute pancreatitis]. Przegl Lek. 2007;64:435-437. [PubMed] [DOI] |
| 13. | Schneider L, Pietschmann M, Hartwig W, Marcos SS, Hackert T, Gebhard MM, Uhl W, Büchler MW, Werner J. Inosine reduces microcirculatory disturbance and inflammatory organ damage in experimental acute pancreatitis in rats. Am J Surg. 2006;191:510-514. [PubMed] |
| 14. | Liu XM, Liu QG, Xu J, Pan CE. Microcirculation disturbance affects rats with acute severe pancreatitis following lung injury. World J Gastroenterol. 2005;11:6208-6211. [PubMed] |
| 15. | Cuthbertson CM, Christophi C. Disturbances of the microcirculation in acute pancreatitis. Br J Surg. 2006;93:518-530. [PubMed] [DOI] |
| 16. | Park BK, Chung JB, Lee JH, Suh JH, Park SW, Song SY, Kim H, Kim KH, Kang JK. Role of oxygen free radicals in patients with acute pancreatitis. World J Gastroenterol. 2003;9:2266-2269. [PubMed] |
| 17. | Tadao M, Yuji O. [Role of free radicals in the development of severe acute pancreatitis]. Nippon Rinsho. 2004;62:2015-2020. [PubMed] |
| 18. | Brankov O, Shivachev Kh, Drebov R, Dumanov K. [Clinical manifestation of acute pancreatitis in children with caustic ingestion injury - the role of oxidative stress]. Khirurgiia (Sofiia). 2007;5-8. [PubMed] |
| 19. | Shi C, Andersson R, Zhao X, Wang X. Potential role of reactive oxygen species in pancreatitis-associated multiple organ dysfunction. Pancreatology. 2005;5:492-500. [PubMed] [DOI] |
| 21. | Shi C, Zhao X, Wang X, Andersson R. Role of nuclear factor-kappaB, reactive oxygen species and cellular signaling in the early phase of acute pancreatitis. Scand J Gastroenterol. 2005;40:103-108. [PubMed] [DOI] |
| 22. | Roth E, Manhart N, Wessner B. Assessing the antioxidative status in critically ill patients. Curr Opin Clin Nutr Metab Care. 2004;7:161-168. [PubMed] [DOI] |
| 23. | Abu-Hilal M, McPhail MJ, Marchand L, Johnson CD. Malondialdehyde and superoxide dismutase as potential markers of severity in acute pancreatitis. JOP. 2006;7:185-192. [PubMed] |
| 24. | Modzelewski B, Janiak A. [Lipid peroxidation product as prognostic factors in acute necrotizing pancreatitis]. Pol Merkur Lekarski. 2005;19:511-513. [PubMed] |
| 25. | Higashi Y, Jitsuiki D, Chayama K, Yoshizumi M. Edaravone (3-methyl-1-phenyl-2-pyrazolin-5-one), a novel free radical scavenger, for treatment of cardiovascular diseases. Recent Patents Cardiovasc Drug Discov. 2006;1:85-93. [PubMed] |
| 26. | Takumida M, Takeda T, Takeda S, Kakigi A, Nakatani H, Anniko M. Protective effect of edaravone against endolymphatic hydrops. Acta Otolaryngol. 2007;127:1124-1131. [PubMed] [DOI] |
| 27. | Sumitomo K, Shishido N, Aizawa H, Hasebe N, Kikuchi K, Nakamura M. Effects of MCI-186 upon neutrophil-derived active oxygens. Redox Rep. 2007;12:189-194. [PubMed] [DOI] |
| 28. | Dohi K, Satoh K, Nakamachi T, Yofu S, Hiratsuka K, Nakamura S, Ohtaki H, Yoshikawa T, Shioda S, Aruga T. Does edaravone (MCI- 186) act as an antioxidant and a neuroprotector in experimental traumatic brain injury? Antioxid Redox Signal. 2007;9:281-287. [PubMed] [DOI] |
| 29. | Akao T, Takeyoshi I, Totsuka O, Arakawa K, Muraoka M, Kobayashi K, Konno K, Matsumoto K, Morishita Y. Effect of the free radical scavenger MCI-186 on pulmonary ischemia-reperfusion injury in dogs. J Heart Lung Transplant. 2006;25:965-971. [PubMed] [DOI] |
| 30. | Rao P, Maeda H, Yutong X, Yamamoto M, Hirose N, Sasaguri S. Protective effect of a radical scavenger, MCI-186 on islet cell damages induced by oxidative stress. Transplant Proc. 2005;37:3457-3458. [PubMed] [DOI] |
| 31. | Iguchi T, Nishikawa M, Chang B, Muroya O, Sato EF, Nakatani T, Inoue M. Edaravone inhibits acute renal injury and cyst formation in cisplatin-treated rat kidney. Free Radic Res. 2004;38:333-341. [PubMed] [DOI] |