修回日期: 2008-12-01
接受日期: 2008-12-08
在线出版日期: 2009-01-08
目的: 探讨急性坏死性胰腺炎(ANP)时肠黏膜屏障的氧化应激损伤和HIF-1α的表达, 及其与黏膜损伤的关系.
方法: ♂Wistar大鼠随机分为3组, A组(ANP组, n = 18), 诱导ANP模型; B组(DMSO组, n = 18), 诱导ANP前, 使用二甲基亚砜(DMSO)预处理组; C组(con组, n = 10)假手术组. A和C组术前30 min皮下注射生理盐水(0.2 mL/kg体质量), B组动物术前30 min皮下注射同等剂量的DMSO(0.2 mL/kg体质量), 并且实验前30 min每只动物饲入60 mg/100 g体质量的FITC-右旋糖酐. 动物分别在手术后0, 6, 24 h点心脏取血后处死, 分别取胰头和末端回肠3-5 cm. 观察胰腺和肠黏膜组织形态学改变, 测定肠黏膜组织中DAO、SOD、GSH、MPO、MDA含量, Western-blot测定肠黏膜中HIF-1α的表达, 并检测血清中二氨氧化酶(DAO)活性及FITC浓度.
结果: ANP时大鼠肠黏膜屏障功能严重破坏, 肠道通透性明显增加. ANP组6 h时黏膜中DAO的活性已经明显下降(0.43±0.07 U/L vs 0.91±0.11 U/L, P<0.05), DMSO处理后DAO活性下降受抑. 而血清中测定DAO活性正好相反. ANP组6 h黏膜组织中SOD、GSH活性就已有明显下降, 12 h最为明显(SOD: 12.12±2.24 U/mg vs 25.12±3.86 U/mg; GSH: 160.75±24.25 mg/gvs 412.45±45.60 mg/g, 均P<0.01), 而MPO活性及MDA浓度明显升高(MPO: 1.32±0.18 U/mg vs 0.63±0.11 U/mg; MDA: 2.85±0.21 nmol/mg vs 1.34±0.12 nmol/mg, 均P<0.01), 观察期限内一直处在较高水平. DMSO预处理组动物肠黏膜通透性有所改善, 但仍然高于正常(P<0.05). 使用DMSO后, 氧化应激反应及其产物有所减弱, 但仍然高于正常(P<0.05). ANP时HIF-1α表达明显增加, 而DMSO的使用可使HIF-1α高表达下调.
结论: ANP时肠黏膜屏障结构和功能存在严重破坏; 氧化应激损伤是肠黏膜屏障损伤的一个重要因素, 而清除氧自由基能一定程度上减轻肠黏膜屏障损伤并能维护其功能; HIF-1α参与ANP肠黏膜屏障的修复和维持, 清除氧自由基减轻肠黏膜损伤可以调节HIF-1α表达.
引文著录: 崔培林, 吕栋, 张峻, 姚士伟, 王燕斌, 杨昭徐. 急性坏死性胰腺炎肠黏膜氧化应激损伤和HIF-1α的表达. 世界华人消化杂志 2009; 17(1): 24-30
Revised: December 1, 2008
Accepted: December 8, 2008
Published online: January 8, 2009
AIM: To examine the role of oxidative stress in intestinal mucosal barrier damage during ANP, and to explore the putative mechanism of HIF-1α during this process.
METHODS: Male Wistar rats were divided randomly into three groups: group A (n = 18) and B (n = 18) served as ANP models, group C (n = 10) was designated as a normal control (sham operation). In group A and C, rats were treated with normal saline therapy, while in group B, rats were treated with DMSO therapy. During the observation period, the morphological changes of intestinal mucosa and pancreatic tissue were observed, and the intestinal permeability was evaluated by FITC-labeled Dextran method and DAO activity detection. The activities of SOD, MPO and the level of MDA and GSH were measured and also the expression of HIF-1α protein was assayed.
RESULTS: During the observation period of ANP, the intestinal mucosal barrier function was damaged seriously and the intestinal permeability was increased. As early as 6h, the DAO activity in the mucosa was decreased obviously (0.43 ± 0.07 U/L vs 0.91 ± 0.11 U/L, P < 0.05) while was attenuated by administration of DMSO. In the serum, the detection of DAO activity showed an opposite results. Also in ANP group, the activity of SOD and the level of GSH were highly decreased (SOD: 12.12 ± 2.24 U/mg vs 25.12 ± 3.86 U/mg; GSH: 160.75 ± 24.25 mg/g vs 412.45 ± 45.60 mg/g, both P < 0.01), while the activity of MPO and the level of MDA were markedly increased (MPO: 1.32 ± 0.18 U/mg vs 0.63 ± 0.11 U/mg; MDA: 2.85 ± 0.21 nmol/mg vs 1.34 ± 0.12 nmol/mg, both P < 0.01). However, administration of DMSO attenuated the damage to some extent, and mucosal barrier function was improved (P < 0.05). And the injury induced by oxidative stress was limited to some extent (P < 0.05). Western blot showed the expression of HIF-1α protein was up-regulated with ANP while down-regulated with DMSO.
CONCLUSION: The intestinal mucosal barrier is damaged during the process of ANP; oxidative stress plays an important role in the damage to mucosal barrier and OFR scavenger could maintain the integrity of mucosal barrier structure and function; HIF-1α is involved in the protection effect on intestinal mucosal barrier under hypoxia induced by ANP, which could be regulated through attenuating the mucosal barrier damage when OFR scavenger is used.
- Citation: Cui PL, Lv D, Zhang J, Yao SW, Wang YB, Yang ZX. Oxidative stress damage and HIF-1α expression in rat intestinal mucosa during acute necrotic pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 24-30
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/24.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.24
肠黏膜屏障一般是由机械、免疫、生物和化学屏障4部分构成, 是维持机体内环境稳定的重要器官之一[1-3]. 肠黏膜屏障的功能受损, 可引起肠道细菌的易位, 诱发肠源性感染, 继而可诱发全身炎性反应综合征, 甚至诱发多脏器功能不全和衰竭[4-6]. 而在众多严重疾病和创伤过程中, 肠黏膜屏障都会受到不同程度的损伤, 尤常见于急性坏死性胰腺炎[7-8]. 肠黏膜屏障损伤的机制也极为复杂, 缺血缺氧、理化免疫因素、肠道菌群的微生态变化、氧自由基及其他炎性介质等多种因素均参与其中[5,9]. 已经有大量研究表明在肠黏膜屏障损伤时, 氧化应激产物明显升高, 而抗氧化剂治疗可以一定程度上减轻损伤, 我们前期研究工作也已经充分证实[10-12]. 但是在氧自由基如何损伤肠黏膜屏障机制方面目前研究还不够深入. HIF-1α虽发现于肿瘤细胞, 与机体许多重大缺血缺氧性疾病的病理生理有关, 并与肠黏膜屏障结构和功能的修复和维持关系密切[13-15]. 本研究就为了探讨急性坏死性胰腺炎时肠黏膜屏障的氧化应激损伤和HIF-1α表达, 旨在深入探讨其两者之间与黏膜损伤有无关联.
牛磺胆酸钠、FITC-右旋糖苷, DAO、SOD、GSH、MPO、MDA检测试剂盒购自北京化学试剂公司, 组织细胞裂解液、丙烯酰胺、N,N-亚甲双丙烯酰胺购自美国Sigma公司, HIF-1α兔多克隆抗体、β-actin鼠多克隆抗体、羊抗兔多克隆抗体、羊抗鼠多克隆抗体购自美国Santa Cruz公司, 低温组织匀浆机、高速台式冷冻离心机、垂直电泳槽、电转移装置、电泳仪、PVDF膜、ECL化学发光成像系统, 荧光及普通分光光度仪等由北京市神经外科研究所和中国医学科学院国家重点分子生物实验室提供.
1.2.1 造模及分组: 动物模型采用传统的逆行胰胆管注射法诱导急性坏死性胰腺炎(50 g/L牛磺胆酸钠)[16]. ♂Wistar大鼠(体质量250-300 g), 实验前禁食(自由饮水)12 h, 随机数字法分为3组, A组为急性坏死性胰腺炎组(ANP), n = 18; B组二甲基亚砜(DMSO)处理组(DMSO), n = 18; C组为假手术组(对照组), n = 10. 术前30 min B组动物皮下注射DMSO(0.2 mL/kg体质量), A组和C组注射同等量的生理盐水(0.2 mL/kg体质量). 动物分别在手术后0, 6, 24 h点杀死, 取末端回肠3-5 cm, 剔除系膜, 清除肠内容物后取黏膜组织放入液氮中保存, 随即进行以下实验.
1.2.2 胰腺和肠黏膜组织细胞形态学观察: 动物处死后, 分别取胰头和末端回肠部分, 各分成两部分, 一部分普通光镜检查, 一部分放入20 g/L戊二醛固定液中送电镜检查.
1.2.3 肠黏膜通透性的测定: 肠壁通透性用FITC标记的右旋糖酐法测定[17]. 实验前30 min每只动物饲入60 mg/100 g体质量的FITC-右旋糖酐(4000 kDa, 80 g/L), 杀死动物前心脏取血测定血清中FITC浓度及血清中DAO的活性, 同时, 测定肠黏膜组织中的DAO活性.
1.2.4 肠黏膜组织中氧自由基产物的测定: 从液氮中取冻存的新鲜黏膜组织200 mg, 在液氮预冷的研钵中研碎组织后, 加入冰生理盐水, 在低温组织匀浆机按需制备100 g/L和10 g/L的组织匀浆, 3000 r/min, 10 min后去上清液备用. 按试剂盒说明书严格操作, 测定黏膜组织中的丙二醛(SOD)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH).
1.2.5 黏膜组织中HIF-1α蛋白的测定: 取冻存的新鲜肠黏膜组织200 mg, 同样在液氮预冷的研钵中研碎, 加入组织细胞裂解液(含蛋白酶抑 制剂), 冰上放置20 min, 13 000 r/min低温下离心15 min, 取上清, 用Bradford法进行蛋白定量后分装, 放入-80℃冰箱保存. 用免疫印迹法测定总蛋白中HIF-1α含量, 简单步骤如下: 首先SDS-PAGE进行蛋白分离, 再低温下(4℃)转移到PDVF膜上进行免疫杂交, 用50 g/L牛奶封闭液封闭非特异性抗原位点, PBST清洗后4℃孵育一抗溶液(1:500)过夜, 然后加二抗溶液(1:10 000)孵育1-2 h, 用ECL化学发光法显色并测定分析(GBISC, gene bio imaging system for chemiluminescence).
统计学处理 使用SPSS10.0软件包对数据进行处理, 所有数据均以mean±SD表示, 符合正态分布的进行t检验或ANOVA, 非正态分布资料用秩和检验; P<0.05被认为具有统计学意义.
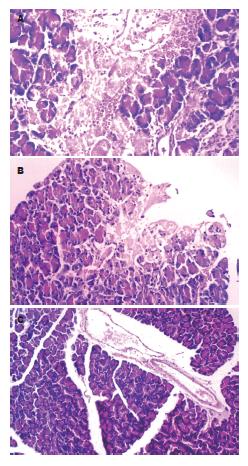
ANP组胰腺组织病变严重, 间质水肿, 小叶结构凌乱, 可见大片出血和坏死灶, 并可见炎性细胞浸润, 24 h已可见明显钙化灶. DMSO处理组胰腺腺小叶结构病变有所减轻, 出血坏死较同期A组动物轻, 多为小灶性坏死, 间质中炎性细胞浸润较轻(图1).
光镜下见A组肠绒毛从肿胀、缩短、增粗到倒伏、融合、破损甚至断裂剥脱, 固有层裸露. B组损伤较同期A组轻. C组为正常肠绒毛结构.
电镜下A组小肠黏膜上皮表面糖衣层消失, 线粒体肿胀, 结构不清晰. 粗面内质网和滑面内质网呈不同程度扩张. 细胞间连接部分增宽. 随着时间延长, 细胞间连接破坏严重, 可见凋亡细胞. 肠黏膜绒毛可见不同程度排列稀疏、断裂、脱落、缺损, 似"破棉絮"样改变, 重者微绒毛广泛脱落, 其顶端呈 "花瓣状". B组肠绒毛结构及黏膜细胞损伤较同期A组轻, 绒毛结构基本完整(图2).
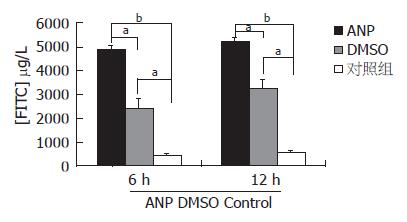
ANP时大鼠肠黏膜屏障功能严重破坏, 肠道通透性明显增加, FITC-Dextran外渗明显增加, 观察期限内12 h最为明显(P<0.01). DMSO预处理组动物肠黏膜通透性有所改善(P<0.05), 但仍然高于正常(P<0.05, 图3). 黏膜组织中DAO活性检测结果显示, ANP 6 h时黏膜中DAO的活性已经明显下降(P<0.05), DMSO处理后DAO活性下降受抑(P<0.05). 而血清中测定DAO活性正好相反, ANP组明显升高(P<0.05), 在DMSO处理组明显低于ANP组(P<0.05), 但仍然高于正常(P<0.05, 表1).
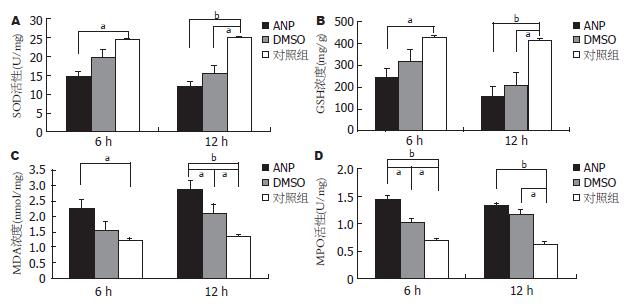
观察期限内, ANP组6 h黏膜组织中SOD、GSH活性就已有明显下降, 12 h最为明显(ANP组 vs 对照组, SOD 12.12 ±2.24 U/mg vs 25.12±3.86 U/mg和GSH 160.75±24.25 mg/g vs 412.45±45.60 mg/g,P<0.01), 而MPO活性及MDA浓度明显升高(ANP vs 对照组, MPO 1.32±0.18 U/mg vs 0.63+0.11 U/mg和 MDA 2.85±0.21 nmol/mg vs 1.34±0.12 nmol/mg, P<0.01), 观察期限内一直处在较高水平(图4). 使用DMSO后, 氧化应激反应及其产物有所减弱(P<0.05), 但仍然高于正常(P<0.05, 图4).
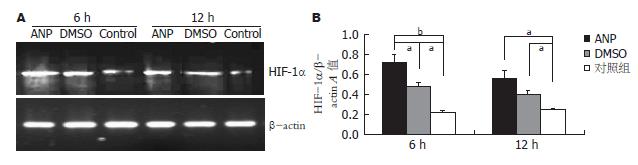
正常的小肠黏膜组织中, HIF-1α也有轻微表达, 与黏膜细胞处于缺氧状态有关, ANP时HIF-1α表达明显增加(P<0.05), 而DMSO的使用可以使HIF-1α高表达下调(图5), 说明DMSO可以通过清除氧自由基减轻肠黏膜损伤改善缺血缺氧状况, 使HIF-1α表达下调, 但维持在较高水平(P<0.05).
胰腺和继发其他器官感染目前仍是ANP患者的主要死亡原因, 占80%以上[18-19]. 肠道是机体内最大的细菌和内毒素储存库, 正常情况下由于完整的黏膜屏障功能, 并不损害机体健康. 但在众多危重疾病包括ANP时, 肠道黏膜屏障功能受损, 肠道通透性增加, 导致肠道内细菌和内毒素移位进入血液和腹腔, 从而进一步激发炎症级联反应, 诱发SIRS, 最终导致MODS、MOF直至死亡[8,20-22]. 而在ANP并发肠黏膜屏障损伤的种种机制中, 由于缺血缺氧、再灌注的多种原因产生的大量氧自由基是引起肠黏膜屏障损伤的一个重要因素. 我们在前期实验中已经初步证实氧自由基在ANP发病和并发的肠黏膜损伤中重要作用, 并预防性使用氧自由基清除剂取得一定的治疗效果, 但研究不够深入.
本研究中我们同样制作了ANP动物模型, 形态学上从普通光镜到电镜下黏膜细胞、细胞间连接及肠微绒毛等超微结构上证实黏膜屏障结构受到严重破坏, 并通过FITC-Dextran外渗实验观察的肠道的通透性明显增加, 进一步证实黏膜屏障功能严重受损. DAO存在哺乳动物动物的黏膜和绒毛上层, 其中大部分存在于小肠黏膜绒毛, 其活性与绒毛高度和黏膜细胞合成核酸和蛋白相关, 是反映小肠黏膜屏障结构和功能理想指标. 本研究中小肠黏膜组织中DAO活性明显下降, 与此对应的血清中DAO活性上升, 提示黏膜屏障被破坏, DAO大量释放入血.
肠道拥有大量的黄嘌呤脱氢氧化酶系统(XO), 当严重应激出现后, 肠道黏膜缺血损伤造成黏膜炎症, 就会通过黄嘌呤氧化脱氢酶(XD)系统产生氧自由基[23-24]. 另外, 在再灌注出现后被多种因素激活中性粒细胞(PMN)通过细胞膜上的NADPH氧化酶, 诱导呼吸爆发(respiratory burst)产生, 释放大量的氧自由基及其衍生的生物活性物质, 进一步造成组织的严重损伤[25-27]. 另外应激状态下抑制体内的重要抗氧化谷胱甘肽氧化还原系统明显受到抑制[28-29], 使清除氧自由基能力降低, 最终导致大量毒性氧自由基在组织细胞内堆积, 致使细胞的脂质过氧化, 从而使细胞蜕变, 最终引起细胞死亡. 另外激活的中性粒细胞还可以分泌血管活性物质如前列腺素、白三烯等均可使使炎症进一步加重, 继发恶性循环[30]. 本研究中检测ANP时肠黏膜组织中抗氧化物质中SOD和GSH活性明显减弱, 而MDA含量明显增高, 证实大量氧自由基损伤黏膜组织, 机体内的抗氧化系统消耗并受抑. 而DMSO是一种有效的氧自由基清除剂, 本研究中发现预防使用DMSO后, 可明显减轻肠黏膜的损伤, 能有效的清除氧自由基, 改善体内氧化-还原系统的失衡, 减轻氧自由基对黏膜组织细胞的损伤, 改善肠黏膜的通透性, 从而有效的维护肠黏膜屏障结构和功能的完整性. MPO与激活的中性粒细胞产生的"呼吸爆发"密切相关[31], 本实验中也发现ANP时MPO活性明显增强, 提示中性粒细胞大量蓄集在肠黏膜组织中, 呼吸爆发产生大量的氧自由基和其他活性物质, 对黏膜结构和功能造成严重损伤. DMSO的使用同样可以部分组织呼吸爆发的产生, 尤其是在6 h时.
HIF-1作为核转录因子, 参与机体内许多与低氧反应基因的调节, 包括120 kDa的α亚基和91-94 kDa的β亚基, α亚基(HIF-1α)蛋白受低氧调控, 常氧时可被蛋白酶体降解; 低氧或存在过渡金属(Co2+, Ni2+和Mn2+)及铁离子螯合剂时, HIF-1α蛋白稳定性增强不被降解, 与组成性表达的HIF-1β结合成二聚体, 通过核转位进入细胞核, 与目的基因的低氧反应元件(hypoxia response element, HRE)结合, 调节低氧相关基因的表达, 从而增强细胞对缺氧的适应能力以及改善因缺氧而诱导的凋亡, 使细胞保持旺盛的增殖能力[32-34]. 众多的研究结果表明, 在小肠黏膜上皮细胞中, HIF-1α持续轻微表达, 可能与小肠黏膜细胞长期处于低氧状态并有很强的增殖能力有关, 因此对肠黏膜屏障结构和功能的维持具有非常重要的意义[13-15,35-37]. 本实验中发现观察期限内ANP动物小肠黏膜中HIF-1α表达明显增加, 明显高于正常时的表达水平, 提示ANP时造成肠黏膜细胞的缺血缺氧加重, 黏膜细胞通过自身HIF-1α的表达上调, 改善对缺氧的耐受并促进增殖维护黏膜屏障的完整. 令人感兴趣的是DMSO的使用能使HIF-1α的表达部分下调, 提示DMSO可以通过清除氧自由基减轻肠黏膜损伤改善缺血缺氧状况, 而反馈性使HIF-1α的表达下调. 但是氧自由基本身也是细胞中HIF-1α表达调节的重要调节因子, 本研究有待进一步更加深入.
总之, ANP时肠黏膜屏障的结构和功能受到严重破坏, 氧自由基是参与其中一个重要机制, 氧自由基清除剂能一定程度上维护肠黏膜屏障的结构和功能的完整; HIF-1α参与ANP肠黏膜屏障的修复和维持, 清除氧自由基减肠黏膜损伤可以调节HIF-1α表达.
肠黏膜屏障是维持机体内环境的重要部分, 其破坏可引起严重的全身炎症反应, 最终可引起多脏器衰竭.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
本文主要研究氧化应激在ANP伴发的肠黏膜屏障损伤时所起的作用, 氧自由基清除剂能否减轻黏膜屏障损伤, 并进一步探讨减轻氧化应激损伤与HIF-1α表达有无关联.
已经有部分研究危重疾病伴发的肠黏膜屏障的损伤机制, 涉及内容较多, 其中对氧化应激损伤比较笼统, 缺乏具体研究. HIF-1α与黏膜屏障的维护已有报道, 且与OFR之间的关系研究较为复杂, 在体外实验中, OFR能降低HIF-1α的表达, 可能与转录后调控有关, 但在体内目前比较复杂, 因除能保护细胞外, 本身还是一种炎性因子参与炎症反应.
ANP时肠黏膜屏障损伤机制复杂, 目前研究虽多但无具体, 本文就氧化应激一个方面对肠黏膜屏障的损伤机制进行探讨, 并阐明其与HIF-1α表达调节关系.
本文结论可靠, 参考文献引用合理, 但文章的观察指标较为陈旧, 研究方法也不甚先进, 使得文章的科学性及先进性不是很高.
编辑: 李军亮 电编:吴鹏朕
| 1. | Gasbarrini G, Montalto M. Structure and function of tight junctions. Role in intestinal barrier. Ital J Gastroenterol Hepatol. 1999;31:481-488. [PubMed] |
| 2. | Sakaguchi T, Brand S, Reinecker HC. Mucosal barrier and immune mediators. Curr Opin Gastroenterol. 2001;17:573-577. [PubMed] [DOI] |
| 3. | Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut. 2003;52:439-451. [PubMed] [DOI] |
| 4. | Antequera R, Bretana A, Cirac A, Brito A, Romera MA, Zapata R. Disruption of the intestinal barrier and bacterial translocation in an experimental model of intestinal obstruction. Acta Cient Venez. 2000;51:18-26. [PubMed] |
| 5. | O'Hara JR, Buret AG. Mechanisms of intestinal tight junctional disruption during infection. Front Biosci. 2008;13:7008-7021. [PubMed] |
| 6. | Ding LA, Li JS, Li YS, Zhu NT, Liu FN, Tan L. Intestinal barrier damage caused by trauma and lipopolysaccharide. World J Gastroenterol. 2004;10:2373-2378. [PubMed] |
| 7. | Chen J, Wang XP, Liu P, Wu K, Xu M, Yu XF, Wang GS. [Effects of continuous early enteral nutrition on the gut barrier function in dogs with acute necrotizing pancreatitis]. Zhonghua Yixue Zazhi. 2004;84:1726-1731. [PubMed] |
| 8. | Ammori BJ. Role of the gut in the course of severe acute pancreatitis. Pancreas. 2003;26:122-129. [PubMed] [DOI] |
| 9. | Hang CH, Shi JX, Li JS, Wu W, Yin HX. Alterations of intestinal mucosa structure and barrier function following traumatic brain injury in rats. World J Gastroenterol. 2003;9:2776-2781. [PubMed] |
| 10. | Buchholz BM, Kaczorowski DJ, Sugimoto R, Yang R, Wang Y, Billiar TR, McCurry KR, Bauer AJ, Nakao A. Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury. Am J Transplant. 2008;8:2015-2024. [PubMed] [DOI] |
| 11. | Assimakopoulos SF, Thomopoulos KC, Patsoukis N, Georgiou CD, Scopa CD, Nikolopoulou VN, Vagianos CE. Evidence for intestinal oxidative stress in patients with obstructive jaundice. Eur J Clin Invest. 2006;36:181-187. [PubMed] [DOI] |
| 12. | Theoharides TC, Doyle R, Francis K, Conti P, Kalogeromitros D. Novel therapeutic targets for autism. Trends Pharmacol Sci. 2008;29:375-382. [PubMed] [DOI] |
| 13. | Robinson A, Keely S, Karhausen J, Gerich ME, Furuta GT, Colgan SP. Mucosal protection by hypoxia-inducible factor prolyl hydroxylase inhibition. Gastroenterology. 2008;134:145-155. [PubMed] [DOI] |
| 14. | Furuta GT, Turner JR, Taylor CT, Hershberg RM, Comerford K, Narravula S, Podolsky DK, Colgan SP. Hypoxia-inducible factor 1-dependent induction of intestinal trefoil factor protects barrier function during hypoxia. J. Exp Med. 2001;193:1027-1034. [PubMed] [DOI] |
| 15. | Kong T, Westerman KA, Faigle M, Eltzschig HK, Colgan SP. HIF-dependent induction of adenosine A2B receptor in hypoxia. FASEB J. 2006;20:2242-2250. [PubMed] [DOI] |
| 16. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 17. | Napolitano LM, Koruda MJ, Meyer AA, Baker CC. The impact of femur fracture with associated soft tissue injury on immune function and intestinal permeability. Shock. 1996;5:202-207. [PubMed] [DOI] |
| 18. | Carroll JK, Herrick B, Gipson T, Lee SP. Acute pancreatitis: diagnosis, prognosis, and treatment. Am Fam Physician. 2007;75:1513-1520. [PubMed] |
| 19. | Walsh MK. Diagnosis, prognosis, and treatment of acute pancreatitis. Am Fam Physician. 2008;77:594. [PubMed] [DOI] |
| 20. | Laukoetter MG, Nava P, Nusrat A. Role of the intestinal barrier in inflammatory bowel disease. World J Gastroenterol. 2008;14:401-407. [PubMed] [DOI] |
| 21. | Zhang XP, Zhang J, Song QL, Chen HQ. Mechanism of acute pancreatitis complicated with injury of intestinal mucosa barrier. J Zhejiang Univ Sci B. 2007;8:888-985. [PubMed] [DOI] |
| 22. | Ammori BJ. Gut barrier dysfunction in patients with acute pancreatitis. J Hepatobiliary Pancreat Surg. 2002;9:411-412. [PubMed] [DOI] |
| 23. | Mittal A, Phillips AR, Loveday B, Windsor JA. The potential role for xanthine oxidase inhibition in major intra-abdominal surgery. World J Surg. 2008;32:288-295. [PubMed] [DOI] |
| 24. | Miyazono Y, Gao F, Horie T. Oxidative stress contributes to methotrexate-induced small intestinal toxicity in rats. Scand J Gastroenterol. 2004;39:1119-1127. [PubMed] [DOI] |
| 25. | Caputo FJ, Rupani B, Watkins AC, Barlos D, Vega D, Senthil M, Deitch EA. Pancreatic duct ligation abrogates the trauma hemorrhage-induced gut barrier failure and the subsequent production of biologically active intestinal lymph. Shock. 2007;28:441-416. [PubMed] [DOI] |
| 26. | Ha EM, Oh CT, Bae YS, Lee WJ. A direct role for dual oxidase in Drosophila gut immunity. Science. 2005;310:847-850. [PubMed] [DOI] |
| 27. | Nakamura N, Morisaki H, Suzuki T, Yajima S, Katori N, Kotake Y, Funakoshi Y, Kawabata K, Yamada S, Ishizaka A. Inhibition of neutrophil elastase attenuates gut mucosal injury evoked by acute alveolar hypoxia in rabbits. Shock. 2007;28:101-105. [PubMed] |
| 28. | Ranganna K, Mathew OP, Yatsu FM, Yousefipour Z, Hayes BE, Milton SG. Involvement of glutathione/glutathione S- transferase antioxidant system in butyrate-inhibited vascular smooth muscle cell proliferation. FEBS J. 2007;274:5962-5978. [PubMed] [DOI] |
| 29. | Burdo J, Schubert D, Maher P. Glutathione production is regulated via distinct pathways in stressed and non-stressed cortical neurons. Brain Res. 2008;1189:12-22. [PubMed] [DOI] |
| 30. | Ginzberg HH, Cherapanov V, Dong Q, Cantin A, McCulloch CA, Shannon PT, Downey GP. Neutrophil-mediated epithelial injury during transmigration: role of elastase. Am J Physiol Gastrointest Liver Physiol. 2001;281:G705-G717. [PubMed] |
| 31. | Guilpain P, Servettaz A, Batteux F, Guillevin L, Mouthon L. Natural and disease associated anti-myeloperoxidase (MPO) autoantibodies. Autoimmun Rev. 2008;7:421-425. [PubMed] [DOI] |
| 32. | Semenza GL, Nejfelt MK, Chi SM, Antonarakis SE. Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci U S A. 1991;88:5680-5684. [PubMed] [DOI] |
| 33. | Chun YS, Kim MS, Park JW. Oxygen-dependent and -independent regulation of HIF-1alpha. J Korean Med Sci. 2002;17:581-588. [PubMed] |
| 34. | Ivan M, Kondo K, Yang H, Kim W, Valiando J, Ohh M, Salic A, Asara JM, Lane WS, Kaelin WG Jr. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science. 2001;292:464-468. [PubMed] [DOI] |
| 35. | Karhausen J, Furuta GT, Tomaszewski JE, Johnson RS, Colgan SP, Haase VH. Epithelial hypoxia-inducible factor-1 is protective in murine experimental colitis. J Clin Invest. 2004;114:1098-1106. [PubMed] |
| 36. | Shah YM, Ito S, Morimura K, Chen C, Yim SH, Haase VH, Gonzalez FJ. Hypoxia-inducible factor augments experimental colitis through an MIF-dependent inflammatory signaling cascade. Gastroenterology. 2008;134:2036-2048, 2048.e1-e3. [PubMed] |