修回日期: 2008-03-01
接受日期: 2008-03-08
在线出版日期: 2008-03-28
目的: 研究Delta-like 4(DLL4)在胃癌中的表达及其与血管生成的关系.
方法: 采用免疫组化EnVision法检测胃癌组织芯片中DLL4的表达, 用CD34进行微血管内皮细胞染色, 计算微血管密度(MVD), 分析其相关性.
结果: DLL4在胃癌中的表达明显高于正常胃黏膜(85.9% vs 35.3%, P<0.01). DLL4的高表达与胃癌的转移(r = 0.612, P<0.01)和胃壁浸润深度(r = 0.482, P<0.01)呈正相关, 与胃癌的组织病理及Borrmann分型无关. 胃癌组织MVD明显高于正常胃黏膜组织(66.5±18.6 vs 34.2±16.4, P<0.01). MVD值与胃癌的组织病理分型(r = 0.506, P<0.01)和转移有关(r = 0.426, P<0.01), 与胃癌胃壁浸润深度和Borrmann分型无明显相关性. DLL4表达阳性组的MVD指数明显高于DLL4表达阴性组(70.5±16.2 vs 32.5±10.4, P<0.01), DLL4表达与MVD呈正相关(r = 0.521. P<0.01).
结论: DLL4表达促进血管分化, 对胃癌的转移、浸润起重要作用.
引文著录: 吕伟, 陈凛, 孙锁柱. 应用组织芯片技术研究Delta-like 4在胃癌组织中的表达及意义. 世界华人消化杂志 2008; 16(9): 956-961
Revised: March 1, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
AIM: To explore the expression of Delta-like 4 (DLL4) and its relations with the angiogenesis in gastric cancer.
METHODS: EnVision immunohistochemical staining was used to detect the expression of DLL4. The microvessel density (MVD) was calculated after CD34 staining for microvessel endothelium and the correlation between their roles and the pathological behavior of gastric carcinoma was investigated.
RESULTS: The expression of DLL4 in gastric cancer was significantly higher than that in normal gastric mucosa (85.9% vs 35.3%, P < 0.01). The over-expression of DLL4 in gastric cancer was positively related to the metastasis (r = 0.612, P < 0.01) and invasion depth (r = 0.482, P < 0.01), while not related to the histological types and Borrmann types. The MVD in gastric cancer tissues was notably higher than that in normal mucosal tissues (66.5 ± 18.6 vs 34.2 ± 16.4, P < 0.01). MVD was correlated with the histological types (r = 0.506, P < 0.01) and metastasis (r = 0.426, P < 0.01), while it was not correlated with the depth of invasion and Borrmann types. The MVD of DLL4-positive group was higher than that of DLL4-negative one (70.5 ± 16.2 vs 32.5 ± 10.4, P < 0.01), and the expression of DLL4 and MVD were positively correlated (r = 0.521, P < 0.01).
CONCLUSION: DLL4 expression may play an important role in gastric carcinogenesis by promoting vascular differentiation, tumor invasion and metastasis.
- Citation: Lv W, Chen L, Sun SZ. Detection of Delta-like 4 expression in gastric cancer and its clinical significance by tissue microarray. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 956-961
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.956
胃癌是消化系统最常见的恶性肿瘤, 世界范围内每年胃癌死亡人数占肿瘤死亡人数的第2位[1]. 我国胃癌每10万人口的年死亡率为25.21, 在各种恶性肿瘤中占首位. 与大多数实体瘤一样, 胃癌的生长、转移和复发与肿瘤新生血管形成、有效微循环建立密切相关[2]. 因此, 抗肿瘤新生血管形成, 抑制肿瘤组织中有效微循环建立是胃癌综合治疗的重要研究方向. Notch信号途径是保守进化的由多种分子参与的复杂信号传导通路, 通过调节相邻细胞之间通讯进而调控细胞发育. 哺乳动物细胞中有5种Notch跨膜配体Jagged1, Jagged2, Delta-like 1(DLL1), Delta-like 3(DLL3), Delta-like 4(DLL4)和4种Notch受体(Notch1-4), 受体必须与相关配体结合才能被激活[3]. 近年来研究发现, Notch信号途径在血管发生、分化和成熟过程中发挥重要调节作用[4-6]. 其中, DLL4作为内皮细胞特异性的配体, 在血管的新生、发育和成熟过程中起主要作用[7]. 组织芯片技术是将多个细小组织片整齐排列于同一载体而成的缩微组织切片, 具有体积小、信息含量高的特点, 结果均一可靠、可比性强, 在肿瘤病理研究和临床病理诊断中有广泛用途[8]. 我们采用免疫组织化学方法和组织芯片技术研究DLL4在胃癌和癌旁正常组织中的表达及其与血管生成的关系, 探讨其在胃癌病理生物学行为中的作用和临床意义.
中国人民解放军总医院2006-10/2007-08手术切除胃癌标本92例, 男62例, 女30例, 中位年龄为62(29-82)岁. 另取其中34例距肿瘤边缘大于5 cm处的正常胃黏膜上皮作为对照. 胃癌分化程度和组织学类型按全国胃癌协作组标准进行. 标本经40 g/L甲醛固定, 常规石蜡包埋, 制作成4 µm厚的切片HE染色供定位用. 兔抗人DLL4 mAb(Abcam公司), 即用型鼠抗人CD34 mAb(福州迈新公司), EnVisionTM免疫组化试剂盒(Dako 公司). 组织芯片仪及1 mm组织穿刺针(Beecher Instruments), 免疫组织化学配套仪器.
1.2.1 组织芯片制作: 组织载玻片经过夜泡酸、充分清洗并烘干, 用多聚赖氨酸防脱片处理. 对每一组织标本, 观察HE切片确定癌、肠上皮化生、不典型增生及远癌正常组织等, 选取目标组织并在HE切片及其相应石蜡组织块(供体蜡块)上标记. 制作2.2 cm×2.5 cm×2 cm大小的空白蜡块(受体蜡块). 在该蜡块上设计7×9共63点组织列阵, 用组织芯片仪打孔制成2块带孔空白蜡块. 将蜡块放在39-42℃水浴中软化后, 用组织芯片仪从供体蜡块标记部位逐个取出直径1 mm, 高4 mm的组织柱共126个, 分别推入2块空白蜡块预先设计的相应孔内, 对蜡块进行连续切片, 裱于防脱片处理的载玻片上.
1.2.2 组织芯片免疫组化染色: 采用EnVision方法对胃癌及其旁正常组织芯片进行免疫组化染色, 并利用PBS(pH7.4)代替一抗作为阴性对照, 已知阳性切片作为阳性对照. DLL4蛋白阳性反应颗粒定位于血管内皮细胞膜和胞质, 每例标本选择2个有代表性的高倍视野, 数200个肿瘤细胞, 取平均值. 阳性细胞数<5%为阴性(-), 5%-25%为弱阳性(+), 25%-50%为中度阳性(++), >50%为强阳性(+++). CD34表达于血管内皮细胞膜, 每一个染成棕黄色的、可与周围血管、肿瘤细胞和其他结缔组织区分开来的明显微小血管腔或含3个以上内皮细胞的内皮细胞簇, 不论管腔和红细胞出现与否, 均作为一个单一的、可计数的微血管. 管腔面积>8个红细胞直径, 带有较厚的肌层的微血管均不计数[9]. 先于低倍光镜下确定3个血管着色最密集区域, 然后在中倍视野下计数微血管的数目, 取2个视野的均值作为微血管密度(MVD). 结果判定在双盲法下进行, 每张切片由两位病理医师分别判定计数.
统计学处理 采用SPSS12.0统计软件包进行, 利用χ2检验分析比较率的差异, 利用t检验或F检验比较组间总体均数的差异, MVD结果以mean±SD表示, DLL4和CD34在胃癌中表达的相关性作Spearman等级相关分析, P<0.05为差异有统计学意义.
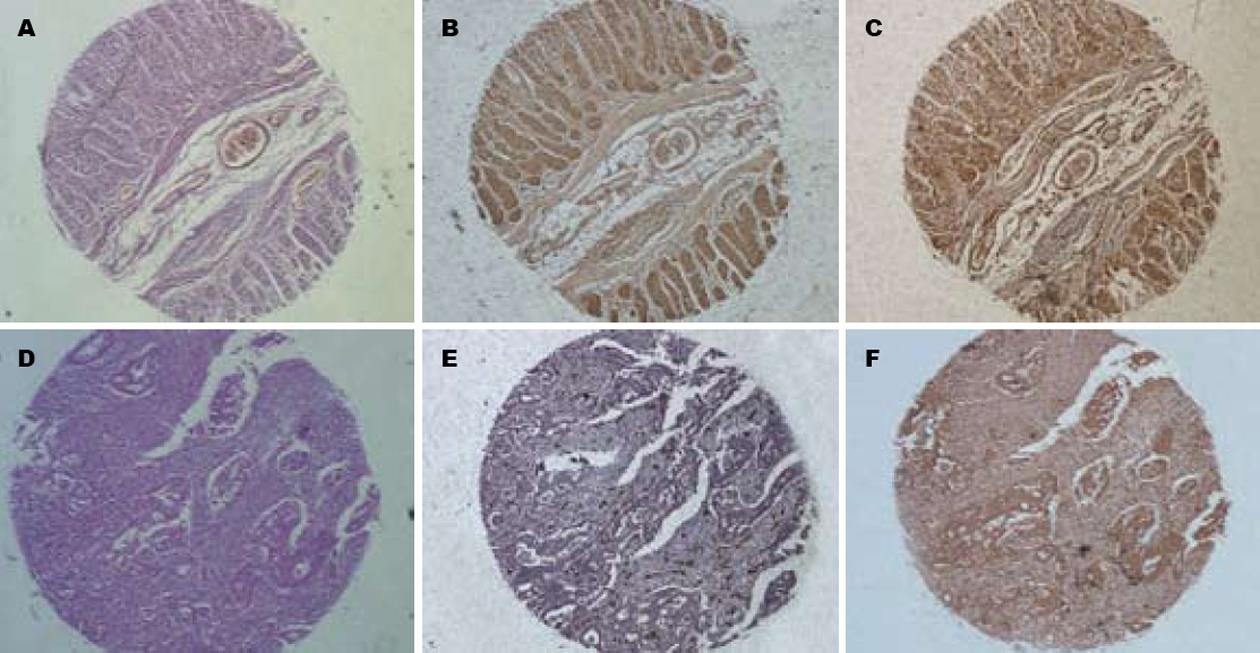
胃癌及正常胃黏膜组织芯片 常规HE染色切片芯片组织形态好, 有代表性. 胃癌组织芯片在免疫组织化学染色中无脱落, 组织阳性信号清晰, 背景清洁(图1).
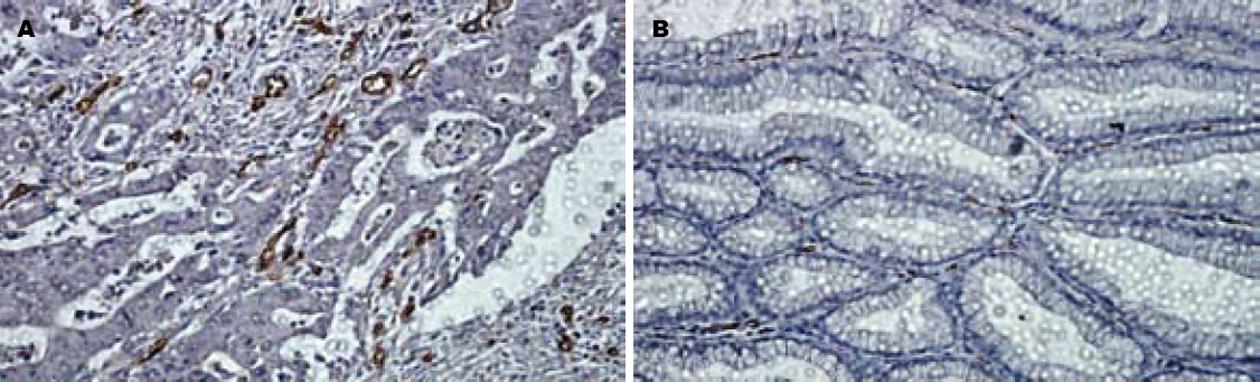
DLL4免疫组化染色最终可用芯片组织为: 胃癌92例, 远癌正常胃黏膜34例. DLL4的阳性染色主要定位于癌组织中血管内皮细胞膜和胞质. DLL4在胃癌中的表达明显高于正常胃黏膜(P = 0.000). DLL4在转移组的阳性率高于无转移组的阳性率(P = 0.000). DLL4表达与胃癌胃壁浸润深度呈正相关(P = 0.008), 与胃癌的组织病理分型无关(P = 0.796), 与Borrmann分型无关(P = 0.327, 表1, 图2).
| 临床病理特征 | n | DLL4 | MVD | ||||||
| - | +~+++ | 阳性率(%) | χ2 | P | t/f | P | |||
| 年龄(岁) | |||||||||
| <62 | 42 | 8 | 34 | 81.0 | 0.885 | 0.347 | 62.5±12.4 | -1.624 | 0.108 |
| ≥62 | 50 | 5 | 45 | 90.0 | 67.3±15.5 | ||||
| 性别 | |||||||||
| 男 | 62 | 7 | 55 | 88.7 | 0.648 | 0.421 | 68.6±14.4 | 1.829 | 0.071 |
| 女 | 30 | 6 | 24 | 80.0 | 62.5±16.5 | ||||
| 组织性质 | |||||||||
| 正常胃黏膜 | 34 | 22 | 12 | 35.3 | 29.128 | 0.000 | 34.2±16.4 | 8.950 | 0.000 |
| 胃癌 | 92 | 13 | 79 | 85.9 | 66.5±18.6 | ||||
| 病理分型 | |||||||||
| 乳头状腺癌 | 4 | 0 | 4 | 100.0 | 3.106 | 0.796 | 38.4±10.7 | 5.727 | 0.000 |
| 高分化管状腺癌 | 9 | 1 | 8 | 88.9 | 43.2±18.3 | ||||
| 中分化管状腺癌 | 26 | 4 | 22 | 84.6 | 58.1±16.5 | ||||
| 低分化腺癌 | 31 | 3 | 28 | 90.3 | 74.4±20.5 | ||||
| 黏液腺癌 | 11 | 2 | 9 | 81.8 | 66.4±20.0 | ||||
| 印戒细胞癌 | 8 | 2 | 6 | 75.0 | 76.4±26.3 | ||||
| 未分化癌 | 3 | 1 | 2 | 66.7 | 46.0±20.4 | ||||
| 转移 | |||||||||
| 无 | 23 | 9 | 14 | 60.9 | 13.169 | 0.000 | 52.5±22.7 | 2.700 | 0.008 |
| 有 | 69 | 4 | 65 | 94.2 | 68.5±25.4 | ||||
| 浸润深度 | |||||||||
| 肌层 | 5 | 3 | 2 | 40.0 | 9.707 | 0.008 | 69.3±18.3 | 0.654 | 0.523 |
| 浆膜下 | 60 | 8 | 52 | 86.7 | 62.4±22.7 | ||||
| 穿出浆膜 | 27 | 2 | 25 | 92.6 | 67.5±20.8 | ||||
| Borrman分型 | |||||||||
| Ⅱ | 14 | 1 | 13 | 92.9 | 2.390 | 0.327 | 56.8±18.3 | 0.410 | 0.665 |
| Ⅲ | 72 | 10 | 62 | 86.1 | 60.3±22.6 | ||||
| Ⅳ | 6 | 2 | 4 | 66.7 | 66.4±20.5 | ||||
CD34表达免疫组化染色最终可用芯片组织为胃癌92例, 远癌正常胃黏膜34例. CD34主要表达于血管内皮细胞胞膜. 微血管染色呈棕黄色, 在92例胃癌组织中MVD为16-100, 均数为66.5. 在胃癌组织中的MVD明显高于在正常胃黏膜组织(P = 0.000). MVD值与胃癌的组织病理分型有关, 在分化差的胃癌其MVD明显高于分化好的胃癌(P = 0.000). 另外MVD值与是否转移明显相关(P = 0.008); 与胃壁浸润深度和Borrmann分型无明显相关性(P>0.05, 表1, 图3).
DLL4表达阳性的胃癌组与其相应的阴性组相比(70.5±16.2 vs 32.5±10.4), DLL4和CD34表达显著正相关(r = 0.521, P = 0.000).
组织芯片又称为组织微阵列技术, 具有体积小, 信息含量高, 并可根据不同的需要进行组合和设计的特点, 适于免疫组化和DNA, RNA原位杂交, 并能大大提高实验效率. 而且可根据需要灵活设计, 所得结果均一可靠, 可比性强, 与传统的病理研究方法相比具有省时、经济、信息量大等优点, 有十分广阔的应用前景. 目前有研究认为, 组织芯片由于所取组织量少, 在信息量上有一定的局限性, 但在本研究的组织芯片制作过程中, 对目标组织有精确定位可将这个局限性减小. 我们构建了包含92例胃癌及34例正常黏膜的组织芯片, 检测DLL4和CD34的表达情况, 所得实验结果满意.
Folkman[10]于1971年提出的"肿瘤血管生成依赖学说"使人们对肿瘤生长与新生血管形成的关系有了较为深刻的认识, 抗肿瘤新生血管形成成为肿瘤综合治疗的重要策略之一. 目前主要通过阻断血管内皮生长因子(vascular endothelial growth factor, VEGF)及其主要受体(VEGFR)来达到抑制肿瘤新生血管形成的目的[11-13]. 但临床实践发现, 多种肿瘤对VEGF抑制剂有拮抗作用, 肿瘤生长和血管生成并不能受到有效抑制[14-15]. 因此, 肿瘤新生血管的形成、分化、成熟, 并最终形成有效的微循环网络, 其中有更多的机制需要进一步深入探讨. Notch信号途径作为高度保守的信号传导通路, 在调节相邻细胞之间通讯进而调控细胞发育过程中有着重要作用[16-18]. Notch基因编码4种膜蛋白受体(Notchl-4), 与5种跨膜糖蛋白配体(DLL1, DLL3, Jaggedl, Jagged2, DLL4)结合, 而后通过一系列的级联反应, 最终在转录水平调控细胞的发育与分化[19-20]. 新近的研究发现, 血管内皮细胞表达的两种受体Notch1和Notch4, 与内皮细胞特异性的配体DLL4结合后在促进肿瘤新生血管的分化、成熟和有效微循环通路形成中发挥重要作用[21-24]. Patel et al[25-26]报导膀胱癌组织中的DLL4表达量是周围正常组织的2倍, 肾透明细胞癌肿瘤组织中DLL4表达量是周围正常组织的9倍. Scehnet et al[27-28]采用可溶蛋白阻断Dll4/Notch信号途径的方法, 均有效抑制了肿瘤组织的生长, 根据肿瘤裸鼠皮下荷瘤模型的不同, 肿瘤生长的抑制率50%-90%. DLL4现已经成为肿瘤抗血管治疗研究的新热点[29-30]. 我们采用组织芯片技术检测92例胃癌组织DLL4表达, 结果显示, DLL4在胃癌中的表达明显高于正常胃黏膜, 且与肿瘤组织MVD呈显著正相关. DLL4在转移组的阳性率高于无转移组, DLL4表达与胃癌胃壁浸润深度呈正相关, 提示DLL4的过表达与胃癌的侵袭和转移能力密切相关. 本研究表明, DLL4的表达在胃癌的血管生成过程中起着重要作用, 与胃癌的转移、浸润密切相关, 其表达可作为判断胃癌预后的一个指标, 以DLL4为靶目标的抗血管治疗技术将为胃癌的综合治疗提供新的方法.
胃癌是消化系统最常见的恶性肿瘤, 抗肿瘤新生血管形成是胃癌综合治疗的重要研究方向. 近年来研究发现, Notch信号途径的重要配体Delta-like 4 (DLL4)在血管发生、分化和成熟过程中发挥重要调节作用, 有可能成为抗肿瘤血管生成治疗的新靶点.
于颖彦, 教授, 上海交通大学医学院附属瑞金医院器官移植中心病理室.
DLL4/ Notch信号途径在肿瘤血管生成中发挥重要调节作用, 抑制肿瘤组织中DLL4的过度表达将导致肿瘤组织生成大量无功能的新生血管, 造成肿瘤组织血供不足, 最终导致肿瘤生长受到抑制, 其具体作用机制有待进一步深入研究.
Patel et al发现膀胱癌组织中的DLL4表达量是周围正常组织的2倍, 肾透明细胞癌肿瘤组织中DLL4表达量是周围正常组织的9倍, 但目前尚未有胃癌组织中DLL4表达的研究报道.
Delta-like 4的研究国内外刚刚起步, 很多未知问题有待于阐明. 本文进一步深入研究Delta-like 4/Notch途径的作用机制对完善肿瘤新生血管与肿瘤生长关系学说有重要意义.
本文选题新颖, 书写流畅, 研究目的明确, 具有一定的参考价值.
编辑: 师忠芳 电编:郭海丽
| 1. | Shah MA, Schwartz GK. Treatment of metastatic esophagus and gastric cancer. Semin Oncol. 2004;31:574-587. [PubMed] [DOI] |
| 2. | Chen Y, Zhang S, Chen YP, Lin JY. Increased expression of angiogenin in gastric carcinoma in correlation with tumor angiogenesis and proliferation. World J Gastroenterol. 2006;12:5135-5139. [PubMed] |
| 3. | Pires-daSilva A, Sommer RJ. The evolution of signalling pathways in animal development. Nat Rev Genet. 2003;4:39-49. [PubMed] [DOI] |
| 4. | Shawber CJ, Kitajewski J. Notch function in the vasculature: insights from zebrafish, mouse and man. Bioessays. 2004;26:225-234. [PubMed] [DOI] |
| 5. | Iso T, Hamamori Y, Kedes L. Notch signaling in vascular development. Arterioscler Thromb Vasc Biol. 2003;23:543-553. [PubMed] [DOI] |
| 6. | Li JL, Harris AL. Notch signaling from tumor cells: a new mechanism of angiogenesis. Cancer Cell. 2005;8:1-3. [PubMed] [DOI] |
| 7. | Gale NW, Dominguez MG, Noguera I, Pan L, Hughes V, Valenzuela DM, Murphy AJ, Adams NC, Lin HC, Holash J. Haploinsufficiency of delta-like 4 ligand results in embryonic lethality due to major defects in arterial and vascular development. Proc Natl Acad Sci U S A. 2004;101:15949-15954. [PubMed] [DOI] |
| 8. | Liu K, Lei XZ, Zhao LS, Tang H, Liu L, Feng P, Lei BJ. Tissue microarray for high-throughput analysis of gene expression profiles in hepatocellular carcinoma. World J Gastroenterol. 2005;11:1369-1372. [PubMed] [DOI] |
| 9. | Boxer GM, Tsiompanou E, Levine T, Watson R, Begent RH. Immunohistochemical expression of vascular endothelial growth factor and microvessel counting as prognostic indicators in node-negative colorectal cancer. Tumour Biol. 2005;26:1-8. [PubMed] [DOI] |
| 10. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] [DOI] |
| 11. | Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol. 2005;23:1011-1027. [PubMed] [DOI] |
| 12. | Mendelsohn J. Targeting the epidermal growth factor receptor for cancer therapy. J Clin Oncol. 2002;20:1S-13S. [PubMed] |
| 13. | Veeravagu A, Hsu AR, Cai W, Hou LC, Tse VC, Chen X. Vascular endothelial growth factor and vascular endothelial growth factor receptor inhibitors as anti-angiogenic agents in cancer therapy. Recent Patents Anticancer Drug Discov. 2007;2:59-71. [PubMed] [DOI] |
| 14. | Casanovas O, Hicklin DJ, Bergers G, Hanahan D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell. 2005;8:299-309. [PubMed] [DOI] |
| 15. | Jain RK, Duda DG, Clark JW, Loeffler JS. Lessons from phase III clinical trials on anti-VEGF therapy for cancer. Nat Clin Pract Oncol. 2006;3:24-40. [PubMed] [DOI] |
| 16. | Weinmaster G. Notch signal transduction: a real rip and more. Curr Opin Genet Dev. 2000;10:363-369. [PubMed] [DOI] |
| 17. | Artavanis-Tsakonas S, Matsuno K, Fortini ME. Notch signaling. Science. 1995;268:225-232. [PubMed] [DOI] |
| 18. | High FA, Epstein JA. The multifaceted role of Notch in cardiac development and disease. Nat Rev Genet. 2008;9:49-61. [PubMed] [DOI] |
| 19. | Artavanis-Tsakonas S, Rand MD, Lake RJ. Notch signaling: cell fate control and signal integration in development. Science. 1999;284:770-776. [PubMed] [DOI] |
| 20. | Fiuza UM, Arias AM. Cell and molecular biology of Notch. J Endocrinol. 2007;194:459-474. [PubMed] [DOI] |
| 21. | Hellstrom M, Phng LK, Hofmann JJ, Wallgard E, Coultas L, Lindblom P, Alva J, Nilsson AK, Karlsson L, Gaiano N. Dll4 signalling through Notch1 regulates formation of tip cells during angiogenesis. Nature. 2007;445:776-780. [PubMed] [DOI] |
| 22. | Hofmann JJ, Iruela-Arispe ML. Notch signaling in blood vessels: who is talking to whom about what? Circ Res. 2007;100:1556-1568. [PubMed] |
| 23. | Gridley T. Notch signaling in vascular development and physiology. Development. 2007;134:2709-2718. [PubMed] [DOI] |
| 24. | Roca C, Adams RH. Regulation of vascular morphogenesis by Notch signaling. Genes Dev. 2007;21:2511-2524. [PubMed] [DOI] |
| 25. | Patel NS, Dobbie MS, Rochester M, Steers G, Poulsom R, Le Monnier K, Cranston DW, Li JL, Harris AL. Up-regulation of endothelial delta-like 4 expression correlates with vessel maturation in bladder cancer. Clin Cancer Res. 2006;12:4836-4844. [PubMed] [DOI] |
| 26. | Patel NS, Li JL, Generali D, Poulsom R, Cranston DW, Harris AL. Up-regulation of delta-like 4 ligand in human tumor vasculature and the role of basal expression in endothelial cell function. Cancer Res. 2005;65:8690-8697. [PubMed] [DOI] |
| 27. | Ridgway J, Zhang G, Wu Y, Stawicki S, Liang WC, Chanthery Y, Kowalski J, Watts RJ, Callahan C, Kasman I. Inhibition of Dll4 signalling inhibits tumour growth by deregulating angiogenesis. Nature. 2006;444:1083-1087. [PubMed] [DOI] |
| 28. | Scehnet JS, Jiang W, Kumar SR, Krasnoperov V, Trindade A, Benedito R, Djokovic D, Borges C, Ley EJ, Duarte A. Inhibition of Dll4-mediated signaling induces proliferation of immature vessels and results in poor tissue perfusion. Blood. 2007;109:4753-4760. [PubMed] [DOI] |
| 29. | Thurston G, Noguera-Troise I, Yancopoulos GD. The Delta paradox: DLL4 blockade leads to more tumour vessels but less tumour growth. Nat Rev Cancer. 2007;7:327-331. [PubMed] [DOI] |
| 30. | Sainson RC, Harris AL. Anti-Dll4 therapy: can we block tumour growth by increasing angiogenesis? Trends Mol Med. 2007;13:389-395. [PubMed] [DOI] |