修回日期: 2008-02-28
接受日期: 2008-03-08
在线出版日期: 2008-03-28
目的: 分析血管内皮生长因子(vascular endothelial growth factor, VEGF)和基质金属蛋白酶9(matrix metalloproteinases-9, MMP-9)在胰腺癌中的表达, 探讨血管生成在肿瘤侵袭转移中的差别及意义.
方法: 选取35例胰腺癌及其癌旁组织、正常组织标本, 应用免疫组化方法检测VEGF、MMP-9表达和微血管密度(microvessel density, MVD)计数,并结合病理特点进行分析.
结果: VEGF、MMP-9表达阳性率胰腺癌组织较癌旁组织、正常组织差异有统计学意义(VEGF: 77.14% vs 5.71%, 12.86%, P<0.01; MMP-9: 68.57% vs 8.57%, 5.71%, P<0.01); 在大小为<2 cm、2-4 cm和>4 cm肿瘤VEGF的阳性率分别为42.86%、92.86%和78.57%, MMP-9的阳性率分别为28.57%、75.00%和83.33%; 分化程度高、中、低肿瘤VEGF的阳性率分别为71.43%、70.59%和90.91%, MMP-9的阳性率分别为71.43%、64.71%和72.73%, 差异均有统计学意义(P<0.05). VEGF、MMP-9阳性率在淋巴转移阳性组分别为100%、95.24%, 胰腺癌VEGF、MMP-9阳性组与阴性组MVD平均值比较, 差异均有统计学意义(t = 3.23, P<0.01; t = 3.89, P<0.01).
结论: VEGF、MMP-9与胰腺癌的高血管生成活性相关, VEGF、MMP-9有望成为抗胰腺癌侵犯转移治疗的靶蛋白.
引文著录: 李春龙, 崔云甫, 杜雪飞, 邰升, 钟翔宇. VEGF和MMP-9在胰腺癌侵袭转移中的表达及临床意义. 世界华人消化杂志 2008; 16(9): 1012-1016
Revised: February 28, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
AIM: To study the expression of vascular endothelial growth factor (VEGF) and matrix metalloproteinases-9 (MMP-9) in pancreatic carcinoma (PC) and validate the significance and distinction of angiogenesis in vascular invasion and metastasis.
METHODS: VEGF, MMP-9 expression and microvessel density (MVD) were detected by immunohistochemistry in surgically resected specimens (cancer tissues, cancer-adjacent tissues and normal tissues) from 35 PC patients, and the results were analyzed combined with clinical pathologic characteristics.
RESULTS: VEGF and MMP-9 expression were higher in PC tissues than those in the cancer-adjacent and normal pancreatic tissues (VEGF: 77.14% vs 5.71%, 12.86%, P < 0.01; MMP-9: 68.57% vs 8.57%, 5.71%, P < 0.01). The positive rates of VEGF and MMP-9 expression were related to the tumor size (< 2 cm, 2-4 cm and > 4 cm in diameter, VEGF: 42.86%, 92.86% and 78.57%; MMP-9: 28.57%, 75.00% and 83.33%; all P < 0.05) and the tumor differentiation (high, moderate and low differentiation, VEGF: 71.43%, 70.59% and 90.91%, MMP-9: 71.43%, 64.71% and 72.73%; all P < 0.05). VEGF and MMP-9 expression in metastasis-positive group were 100% and 95.24%, respectively. The mean values of MVD were significantly different between VEGF- or MMP-positive group (t = 3.23, P < 0.01; t = 3.89, P < 0.01).
CONCLUSION: MMP-9 and VEGF expression are associated with high angiogenesis in PC, so VEGF and MMP-9 may serve as new target proteins to resist the invasion and metastasis of PC.
- Citation: Li CL, Cui YF, Du XF, Tai S, Zhong XY. Clinical significance of matrix metalloproteinases-9 and vascular endothelial growth factor expression in the invasion and metastasis of pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 1012-1016
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/1012.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.1012
血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前已知最重要的促血管生成因子之一, 基质金属蛋白酶9(matrix metalloproteinases-9, MMP-9)是一种与肿瘤侵袭和转移密切相关的蛋白酶, 他与血管形成过程中基底膜的降解关系密切. 血管生成(angiogenesis)与肿瘤的生长和转移密切相关, 微血管密度(microvessel density, MVD)则是反映肿瘤组织血管生成情况的一项客观指标. 本实验选取35例胰腺癌及其癌旁组织、正常组织标本, 应用免疫组化方法检测VEGF、MMP-9表达和MVD计数, 以探讨二者与胰腺癌血管形成和临床的关系.
2004-0l/2006-12哈尔滨医科大学第一附属医院和第二附属医院普外科住院治疗的胰腺癌患者35例. 入选标准: (1)病理确诊; (2)手术切除病变; (3)术前未行放、化疗; (4)病历资料完整. 同时记录35例胰腺癌临床病理资料, 有淋巴结转移21例, 无淋巴结转移14例.
调出所有患者存档病理蜡块, 各制成4张4 μm的切片, 1张常规HE染色, 3张行免疫组化染色. 免疫组化染色按北京中山试剂公司生产的试剂盒说明书操作. 用已知阳性切片作阳性对照, 用PBS代替一抗作阴性对照. VEGF、MMP-9阳性判断参考Volm et al[1]的方法, 以胰腺组织肿瘤细胞或腺上皮细胞胞质中出现明显的黄色或棕黄色颗粒为阳性. 按400倍视野阳性细胞百分值(0%: 0分; 1%-25%: 1分; 26%-50%: 2分; >50%: 3分)和细胞着色强度(阴性: 0分; 淡黄色: 1分; 棕黄色: 2分; 棕褐色: 3分)评分. 两分值相加, 0-2分为阴性(-), 3-4分为弱阳性(+), 5-6分为强阳性(++). 肿瘤MVD测定参考Weidner et al[2]的方法, 首先在100倍视野下挑选CD31阳性最高区域, 然后计数5个200倍视野的CD31阳性微血管数, 取平均值. CD31阳性判断是以血管内皮细胞胞质内出现明显的黄色或棕黄色颗粒为阳性.
统计学处理 数据以mean±SD表示, 弱阳性和强阳性均计为阳性, 使用SPSS13.0统计软件处理数据, 应用t检验、χ2检验、Fisher确切概率法, P<0.05有统计学意义.
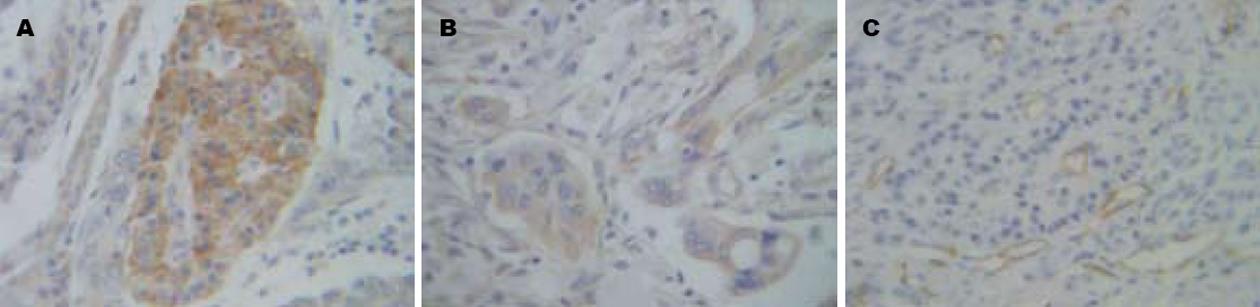
微血管分布不均, 肿瘤边缘区域较肿瘤内部密集, 而正常组织分布较少(图1).
35例胰腺癌标本中, VEGF蛋白阳性表达在癌组织、癌旁组织、正常组织中分别为27例(77.14%)、2例(5.71%)、1例(12.86%), MMP-9蛋白阳性表达在癌组织、癌旁组织、正常组织中分别为24例(68.57%)、3例(8.57%)、2例(5.71%), VEGF、MMP-9蛋白阳性表达在淋巴转移阳性组分别为21例(100%)、20例(95.24%), 胰腺癌VEGF阳性组MVD平均值为31.19±8.35、阴性组MVD平均值为21.50±1.53, 胰腺癌MMP-9阳性组MVD平均值为32.12±8.38、阴性组MVD平均值为22.11±1.89. VEGF、MMP-9表达阳性率癌组织显著高于癌旁组织和正常组织, 差异均有统计学意义(P<0.01); 而癌旁组织与正常组织, 差异无统计学意义(P>0.05). 胰腺癌组织、癌旁组织、正常组织中MMP-9、VEGF阳性率比较见表1. 胰腺癌有淋巴转移组与无淋巴转移组VEGF、MMP-9表达阳性率比较, 差异均有统计学意义(P<0.01). 胰腺癌VEGF、MMP-9阳性组与阴性组MVD平均值比较, 差异均有统计学意义(P<0.01); 胰腺癌有淋巴转移组与无淋巴转移组MVD平均值比较, 差异有统计学意义(P<0.01, 表2). VEGF、MMP-9表达阳性率在性别、年龄方面无明显差异(P>0.05); 在肿瘤大小、分化程度方面有明显差异(P<0.05, 表3).
| VEGF | χ2 | P | MMP-9 | χ2 | P | |||
| + | - | + | - | |||||
| 癌组织 | 27 | 8 | 36.80 | <0.01 | 24 | 11 | 26.59 | <0.01 |
| 癌旁组织 | 2 | 33 | 3 | 32 | ||||
| 癌组织 | 27 | 8 | 40.24 | <0.01 | 24 | 11 | 29.61 | <0.01 |
| 正常组织 | 1 | 34 | 2 | 33 | ||||
| 癌旁组织 | 2 | 33 | 0.35 | >0.05 | 3 | 32 | 0.21 | >0.05 |
| 正常组织 | 1 | 34 | 2 | 33 | ||||
| n | MVD | t | P | ||
| VEGF | + | 27 | 31.19±8.35 | 3.23 | <0.01 |
| - | 8 | 21.50±1.55 | |||
| MMP-9 | + | 24 | 32.12±8.38 | 3.89 | <0.01 |
| - | 11 | 22.11±1.89 | |||
| 淋巴转移 | 有 | 21 | 32.72±8.80 | 3.80 | <0.01 |
| 无 | 14 | 23.35±3.04 |
| VEGF | MMP-9 | ||||
| 阳性率(%) | P | 阳性率(%) | P | ||
| 性别 | 男 | 78.26 | >0.05 | 69.56 | >0.05 |
| 女 | 75.00 | 66.67 | |||
| 年龄 | ≥60 | 78.68 | >0.05 | 68.42 | >0.05 |
| <60 | 81.25 | 68.75 | |||
| 分化程度 | 高 | 71.43 | <0.05 | 71.43 | <0.05 |
| 中 | 70.59 | 64.71 | |||
| 低 | 90.91 | 72.73 | |||
| 肿瘤大小 | <2 cm | 42.86 | <0.05 | 28.57 | <0.05 |
| 2-4 cm | 92.86 | 75.00 | |||
| >4 cm | 78.57 | 83.33 | |||
由于胰腺癌恶性度及转移发生率高, 大多数胰腺癌患者切除术后预后较差. 淋巴转移通路是胰腺癌细胞最主要的转移方式之一. 胰腺癌的分化程度和淋巴转移直接影响患者的预后, 据Yeo et al[3]报道, 美国胰腺癌5年生存率有15%, 中国
解放军总医院报道胰头癌5年生存率<3.8%[4], 而可切除的淋巴结已经发生转移达到71.8%(107/149), 是胰腺癌复发主要因素, 胰腺癌细胞低分化和淋巴道转移使胰腺癌生存时间平均缩短0.91年[3]. Tang et al[5]报道在胰腺癌中VEGF的表达率为80.4%, Northern blot表明胰腺癌细胞的VEGF总RNA表达是正常细胞的2.2倍, 提示他们与淋巴结转移和淋巴管浸润密切相关. Bogoevski et al[6]研究胰腺癌淋巴结阳性个数与胰腺癌预后成负相关性, 说明淋巴结有无转移是判断胰腺癌预后的重要指标, 所以急需阐明影响胰腺癌分化程度和淋巴结转移的因素, 找到新的相关靶点加以干预, 以期改善胰腺癌预后.
近年来许多实验提示VEGF、MMP-9与肿瘤的发生分化转移密切相关, 而二者在胰腺癌中的作用及相互关系报道较少. 现已知VEGF作用于血管内皮细胞促进毛细血管的形成, 并对新生血管的内皮细胞具有强烈的抗凋亡作用, 在肿瘤的血管形成中具有核心作用, Knoll et al[7]对32例胰腺癌进行VEGF检测, 符合国际抗癌协会Ⅲ期标准(union internationale contre le cancer-Ⅲ, UICC-Ⅲ)病例的阳性率显著高于其他组, 但尚未发现VEGF与胰腺癌肝转移间的联系. MMP-9通过降解和破坏细胞基质中最重要的Ⅳ、Ⅴ型胶原和明胶, 以利于肿瘤血管向间质生长, 肿瘤血管的微血管密度不断增加, 肿瘤不断增长并向远处转移, Nagakawa et al[8]的研究表明在32例胰腺癌中MMP-9的阳性率为50%, 在同时伴有肝转移的病例中, MMP-9的阳性率为66.7%, 提示MMP-9与胰腺癌肝转移间可能存在联系. 在胰腺癌方面二者均有一定的潜在研究价值.
本实验结果表明VEGF、MMP-9在癌组织中的表达平均水平高于癌旁组织和正常组织中的表达, 提示VEGF、MMP-9与胰腺癌的发生相关, 但本实验提示一部分癌旁组织和正常组织中VEGF、MMP-9也有明显表达, 这说明虽然癌旁组织和正常组织经病理切片证实未见癌组织, 但仍有可能有癌细胞存在, 也可能是由于肿瘤的生长启动了机体内部某种调节机制, 促使胰腺癌细胞及肿瘤周围正常细胞的MMP-9、VEGF蛋白都过度表达. 有研究表明, 缺氧可诱导肿瘤细胞及正常细胞VEGF的表达增强2-50倍, 从而刺激肿瘤血管的形成[9]. 其作用机制及诱导途径也是我们以后研究胰腺癌发生、转移的一个重要方向.
本实验还提示VEGF、MMP-9与MVD的多少相关, 而MVD是反映肿瘤组织血管生成情况的一项客观指标. Yancopoulos et al[10]证明肿瘤生长依赖于血管生成, 当瘤体直径超过l-2 mm时, 必须依赖新生血管提供养分. Nagakawa et al[8]研究表明, 肿瘤微血管的形态和数量与肝转移存在联系. 肝转移组的单位面积内侵犯型微血管和破坏型微血管数量显著高于非转移组. Ikeda et al[11]报道高MVD值的患者局部复发和远处转移的发生率也显著高于低MVD值者. 微血管数量明显增加, 形态扭曲增粗, 分支不规则, 有异常的网状血管结构, 其基底膜不完整, 通透性增高[12]. 肿瘤的生长和转移与血管生成有关, 肿瘤细胞自原发部位脱落后浸透组织基底膜, 进而借助结构不完整的新生血管进人血循环或淋巴循环[13], 本实验表明在胰腺癌中有淋巴转移组MVD平均值高于无淋巴转移组即证明了这一点. Bergers et al[14]在转基因裸鼠的胰腺癌模型研究中发现: MMP-2的活性降低不能减弱血管生成的诱导作用, 他仅仅能延缓肿瘤的生长, 而MMP-9可协同VEGF促进胰腺癌血管形成, 因此, MMP-9在胰腺癌血管形成中起重要作用. 本研究结果表明, MMP-9、VEGF的表达与胰腺癌有无淋巴结转移有相关性, 表明MMP-9、VEGF在胰腺癌转移过程中起重要作用, 有可能为胰腺癌抗血管形成治疗提供新的靶蛋白, 为胰腺癌治疗探索一种新的途径. 实验结果还显示, MMP-9、VEGF的表达与胰腺癌的分化程度和肿瘤大小相关, 这提示MMP-9、VEGF表达的高低与胰腺癌的恶性程度密切相关, 而胰腺癌的恶性程度与预后密切相关, 因此我们可以通过检测MMP-9和VEGF蛋白表达来判断胰腺癌患者的预后.
本实验仅能提示VEGF和MMP-9在胰腺癌发生转移中可能有一定的关系, 二者大体保持同步的变化, 不能充分证明二者关系, 而肿瘤细胞以及内皮细胞、上皮细胞、间皮细胞和白细胞等均可分泌多种分子诱导血管形成, 也包括VEGF和MMP-9[15], 因而有待于进一步实验证明二者的同步关系, 因果关系, 或二者为同一原因的两个结果. 总之, 对VEGF和MMP-9更深入的研究, 有助于对胰腺癌生长、浸润和转移机制的进一步认识, 最终为胰腺癌的诊断、治疗和预后评价提供重要帮助.
胰腺癌是常见的消化道恶性肿瘤之一, 其恶性程度及转移发生率高, 大多数患者切除术后预后较差, 淋巴转移通路是胰腺癌细胞最主要的转移方式之一, 胰腺癌的分化程度和淋巴转移直接影响患者的预后.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科.
Griffin et al证实胰腺癌动物在注射抑制血管生长因子受体药物后, 肿瘤的血流灌注减少50%, 显著抑制胰腺癌的生长, 随着胰腺癌微血管生成机制研究的进展, 可能使胰腺癌综合治疗的效果得到进一步改善.
本文对VEGF和MMP-9在胰腺癌中的作用进行初步的探讨. 采用的病理染色方法较丰富, 从不同角度观察病理变化.
VEGF和MMP-9的深入研究, 有助于对胰腺癌生长、浸润和转移机制的进一步认识, 并为胰腺癌的早期诊断及治疗提供重要帮助.
本文选题较新, 但检测方法单一, 定量的客观性与准确性易受影响.
编辑: 李军亮 电编:郭海丽
| 1. | Volm M, Koomagi R, Mattern J. Prognostic value of vascular endothelial growth factor and its receptor Flt-1 in squamous cell lung cancer. Int J Cancer. 1997;74:64-68. [PubMed] [DOI] |
| 2. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] [DOI] |
| 3. | Yeo CJ, Sohn TA, Cameron JL, Hruban RH, Lillemoe KD, Pitt HA. Periampullary adenocarcinoma: analysis of 5-year survivors. Ann Surg. 1998;227:821-831. [PubMed] [DOI] |
| 5. | Tang RF, Itakura J, Aikawa T, Matsuda K, Fujii H, Korc M, Matsumoto Y. Overexpression of lymphangiogenic growth factor VEGF-C in human pancreatic cancer. Pancreas. 2001;22:285-292. [PubMed] [DOI] |
| 6. | Bogoevski D, Yekebas EF, Schurr P, Kaifi JT, Kutup A, Erbersdobler A, Pantel K, Izbicki JR. Mode of spread in the early phase of lymphatic metastasis in pancreatic ductal adenocarcinoma: prognostic significance of nodal microinvolvement. Ann Surg. 2004;240:993-1000; discussion 1000-1001. [PubMed] [DOI] |
| 7. | Knoll MR, Rudnitzki D, Sturm J, Manegold BC, Post S, Jaeger TM. Correlation of postoperative survival and angiogenic growth factors in pancreatic carcinoma. Hepatogastroenterology. 2001;48:1162-1165. [PubMed] |
| 8. | Nagakawa Y, Aoki T, Kasuya K, Tsuchida A, Koyanagi Y. Histologic features of venous invasion, expression of vascular endothelial growth factor and matrix metalloproteinase-2 and matrix metalloproteinase-9, and the relation with liver metastasis in pancreatic cancer. Pancreas. 2002;24:169-178. [PubMed] [DOI] |
| 9. | Bachler P, Reber HA, Buchler M, Shrinkante S, Buchler MW, Friess H, Semenza GL, Hines OJ. Hypoxia-inducible factor 1 regulates vascular endothelial growth factor expression in human pancreatic cancer. Pancreas. 2003;26:56-64. [PubMed] [DOI] |
| 10. | Yancopoulos GD, Davis S, Gale NW, Rudge JS, Wiegand SJ, Holash J. Vascular-specific growth factors and blood vessel formation. Nature. 2000;407:242-248. [PubMed] [DOI] |
| 11. | Ikeda N, Adachi M, Taki T, Huang C, Hashida H, Takabayashi A, Sho M, Nakajima Y, Kanehiro H, Hisanaga M. Prognostic significance of angiogenesis in human pancreatic cancer. Br J Cancer. 1999;79:1553-1563. [PubMed] [DOI] |
| 12. | Folkman J. The role of angiogenesis in tumor growth. Semin Cancer Biol. 1992;3:65-71. [PubMed] |
| 13. | Esposito I, Menicagli M, Funel N, Bergmann F, Boggi U, Mosca F, Bevilacqua G, Campani D. Inflammatory cells contribute to the generation of an angiogenic phenotype in pancreatic ductal adenocarcinoma. J Clin Pathol. 2004;57:630-636. [PubMed] [DOI] |
| 14. | Bergers G, Brekken R, McMahon G, Vu TH, Itoh T, Tamaki K, Tanzawa K, Thorpe P, Itohara S, Werb Z. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat Cell Biol. 2000;2:737-744. [PubMed] [DOI] |
| 15. | von Marschall Z, Cramer T, Hocker M, Burde R, Plath T, Schirner M, Heidenreich R, Breier G, Riecken EO, Wiedenmann B. De novo expression of vascular endothelial growth factor in human pancreatic cancer: evidence for an autocrine mitogenic loop. Gastroenterology. 2000;119:1358-1372. [PubMed] [DOI] |