修回日期: 2008-02-27
接受日期: 2008-03-02
在线出版日期: 2008-03-18
目的: 探讨TGF-β1和TGF-β R1蛋白及其前体mRNA的表达与胃癌发生发展的关系.
方法: 采用免疫组化和实时PCR(real-time PCR)方法, 对胃癌50例、萎缩性胃炎19例和正常胃黏膜18例的TGF-β1和TGF-β R1蛋白及其前体mRNA的表达进行检测.
结果: 胃癌组织中TGF-β1和TGF-β R1蛋白表达明显增强, 其阳性率(80.0%和75.0%)明显高于正常胃黏膜组(33.3%和27.8%)及萎缩性胃炎组(36.8%和36.8%), 差异有显著性(P<0.01). 胃癌组织的分化程度越低, TGF-β1、TGF-β R1蛋白表达的阳性率越高(r = 35.58, P<0.01). 同样, 胃癌组织中TGF-β1和TGF-β R1前体mRNA的表达明显高于萎缩性胃炎组(TGF-β1: 4.20±0.51 vs 9.15±2.12, 8.22±1.81; TGF-β R1: 1.28±0.48 vs 5.55±1.48, 4.19±0.95).
结论: TGF-β1和TGF-β R1的高表达与胃癌的发生发展、生物学行为和预后可能有关.
引文著录: 韩慧, 徐珞, 刘希双, 司海运, 王宝中. 胃癌组织TGF-β1和TGF-β R1及其前体mRNA的表达意义. 世界华人消化杂志 2008; 16(8): 856-861
Revised: February 27, 2008
Accepted: March 2, 2008
Published online: March 18, 2008
AIM: To evaluate the significance of transforming growth factor-β1 (TGF-β1) and its β I type receptor (TGF-β R1) in the pathogenesis of gastric carcinoma.
METHODS: TGF-β1 and TGF-β R1 were detected by immunohistochemistry in and real-time PCR (RT-PCR) 50 cases of gastric carcinoma, 19 cases of atrophic gastritis and 18 cases of normal gastric mucosa.
RESULTS: Immunohistochemistry demonstrated that the positive expression rates of TGF-β1 and TGF-β R1 were significantly higher in gastric carcinoma (80.0% and 75.0%) than in normal gastric mucosa (33.3% and 27.8%) and atrophic gastritis (36.8% and 36.8%) (P < 0.01). The lower the differentiation of gastric carcinoma was, the higher the expression of TGF-β1 and TGF-β R1 was (r = 35.58, P < 0.01). Furthermore, the expression of TGF-β1 and TGF-β R1 mRNA was significantly higher in gastric carcinoma than in normal gastric mucosa and atrophic gastritis (TGF-β1: 4.20 ± 0.51 vs 9.15 ± 2.12, 8.22 ± 1.81; TGF-β R1: 1.28 ± 0.48 vs 5.55 ± 1.48, 4.19 ± 0.95).
CONCLUSION: High expression of TGF-β1 and TGF-β R1 is correlated with the development, biologic behavior and prognosis of gastric carcinoma.
- Citation: Han H, Xu L, Liu XS, Si HY, Wang BZ. Expression of transforming growth factor β1 and its type I receptor in gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 856-861
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/856.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.856
胃癌是最常见的恶性肿瘤之一. 据统计, 中国胃癌患者的死亡率占全部恶性肿瘤的首位. 与其他恶性肿瘤一样, 胃癌的发生机制不明. 最近研究发现, 转化生长因子-β(transforming growth factor β, TGF-β)家族的分泌紊乱及其传导通路的中断与肿瘤的发生发展关系密切. 在TGF-β家族中, 人类有TGF-β1、TGF-β2和TGF-β3三种形态存在, 三者的生物学作用相似, 其中TGF-β1含量最高且具有代表性. TGF-β1是一多功能细胞生长因子, 为DPC4基因的信号传递蛋白, 他通过与其受体(如TGF-β R1)结合能抑制多种细胞的增殖、分化并促进细胞间质的形成[1-2]. 已证实TGF-β1、TGF-β R1表达与恶性肿瘤生物学行为和预后有密切关系[3-8]. DPC4基因为抑癌基因, 其蛋白产物Smad4对恶性肿瘤的发生发展及转移有重要影响[9]. 因此, 我们采取免疫组织化学和分子生物学方法, 对胃癌组织中TGF-β1、TGF-β R1蛋白及其前体mRNA的表达进行了检测, 以了解胃癌组织细胞中TGF-β1和TGF-β R1的表达状况, 探讨其生物学意义.
收集青岛大学医学院附属医院病理科和聊城市人民医院病理科新鲜标本87例, 其中胃癌50例, 萎缩性胃炎19例, 正常胃黏膜18例. 50例胃癌中, 男36例, 女14例, 年龄37-69岁. 取材后立即放入液氮中备用. 病理诊断全部经2名以上高年资病理医师按WHO肿瘤国际组织学分类标准复查.
1.2.1 免疫组织化学染色: 切片脱蜡至水洗, 滴加30 mL/L过氧化氢20 min以抑制内源性过氧化物酶; 0.01 mol/L PBS冲洗, 正常羊血清封闭非特异性抗原20 min, 倾去后滴加TGF-β1一抗(1:100, 美国Sigma公司), 4 ℃湿盒内孵育过夜, 0.01 mol/L PBS洗5 min 3次, 滴加二抗(生物素标记)室温30 min, 经0.01 mol/L PBS冲洗后滴加SABC(室温20 min), DAB显色液显色3-10 min, 自来水终止, 苏木精复染, 梯度酒精脱水, 二甲苯透明, 封片观察. 采用PBS液代替一抗作阴性对照, 已知阳性标本作阳性对照. TGF-β1和TGF-β R1免疫阳性细胞的结果判定以组织细胞中出现棕色或棕褐色颗粒为准, 每张切片随机观察5个视野, 每个视野观察100个细胞, 共计数500个细胞中染色阳性的细胞数, 根据阳性细胞的多少分为Ⅰ级(< 30%), Ⅱ级(30%-70%)和Ⅲ级(>70%).
1.2.2 总RNA的提取和单链cDNA合成: 取组织标本50-100 mg, 加入TRIzol(Invitrogen公司产品)1 mL, 冰冷状态下匀浆. 按每毫升TRIzol试剂添加氯仿0.2 mL, 振摇15 s, 室温下放置2-3 min, 12000 g离心15 min(4 ℃), 保留上层水相. 按每毫升TRIzol加异丙醇0.5 mL, 混匀, 室温放置10 min, 12000 g离心10 min(4 ℃), 弃上清留沉淀. 用750 mL/L的乙醇1 mL漂洗RNA沉淀, 7500 g离心5 min(4 ℃). 用无RNA酶水重溶RNA, 紫外分光光度计测A值, A260/280比值为1.9-2.2取总RNA 3 µL(1 g/L), 引物Oligo-d(T16)1 µL(10 nmol/L), 10×RT缓冲液2 µL, dNTPs 2.5 mmol/L 4 µL, Rnase抑制剂1 µL, AMV逆转录酶1 µL(Invitrogen公司产品), 至反应总体积为20 µL. 反应条件: 42 ℃ 1 h; 95 ℃ 5 min.
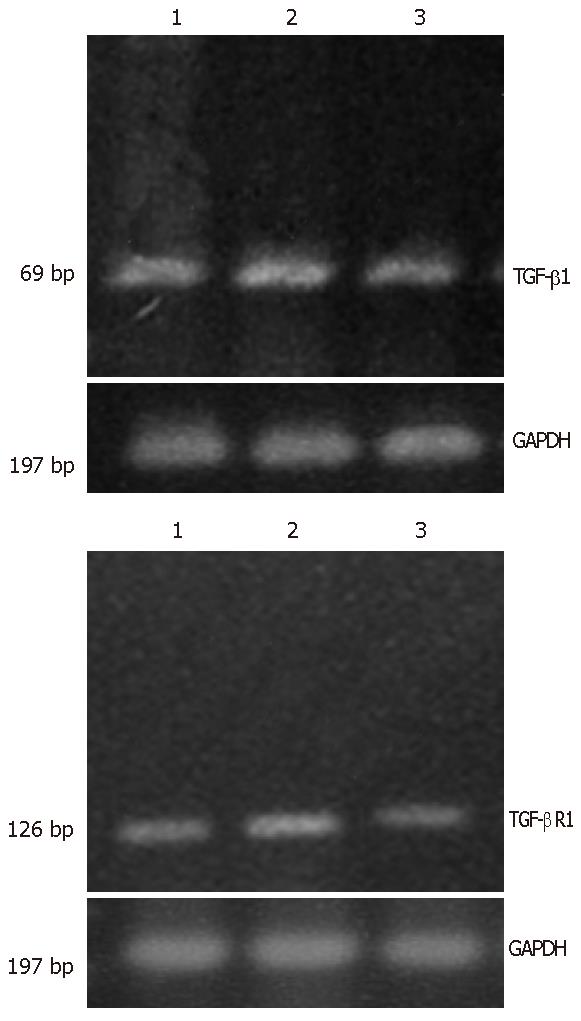
1.2.3 实时PCR(Real Time PCR)实验: 实时动态定量PCR采用5700型定量PCR仪(PE公司产品) 对各种mRNA起始拷贝进行分析[10]. 以看家基因GAPDH设为内参, 分别取正常对照组、萎缩性胃炎和胃癌组织, 提取总RNA, 并反转录为单链cDNA(ss-cNDA), 各取ss-cDNA产物1 µL作为待测样品. 所有的待测样品均一式两份, 分别对TGF-β1、TGF-β R1和GAPDH进行扩增(引物见表1), 扩增反应用SYBR GreenⅠ定量PCR试剂盒(日本东洋坊公司)和5700型定量PCR仪完成, 扩增条件: 95 ℃ 1 min预变性, 然后按95 ℃ 30 s, 54 ℃ 15 s, 72 ℃ 15 s, 共做40个循环. 最后按照94 ℃ 0 s, 55 ℃ 15 s, 94 ℃ 0 s作熔解曲线, 温度变化速度为0.1 ℃/s. 反应结束后, 由电脑自动分析计算出定量结果. 将不含ss-cDNA模板的PCR反应体系设为阴性对照.
| 寡核苷酸 | 序列 |
| TGF-β1.for | 5'-CACCCGCGTGCTAATGG-3' |
| TGF-β1.rev | 5'-ATGCTGTGTGTACTCTGCTTGAACT-3' |
| TGF-β R1.for | 5'-ACCTTCTGATCCATCCGTT-3' |
| TGF-β R1.rev | 5'-CGCAAAGCTGTCAGCCTAG-3' |
| Oligo-dT16 anchor primer | 5'-GACCACGCGTATCGATGTCGAC(T)16-3 |
| GAPDH.for | 5'-AGCTGAACGGGAAGCTCAC-3' |
| GAPDH.rev | 5'-GCTGTTGAAGTCAGAGGAGAC-3' |
统计学处理 数据均用mean±SD表示, 多组间率的比较采用RxC列联表卡方检验. 实时PCR结果分析用△Ct值表示[11], 即△Ct = CtTGF-CtGAPDH, χ2检验进行两两组间比较, P<0.05为差异有显著统计学意义.
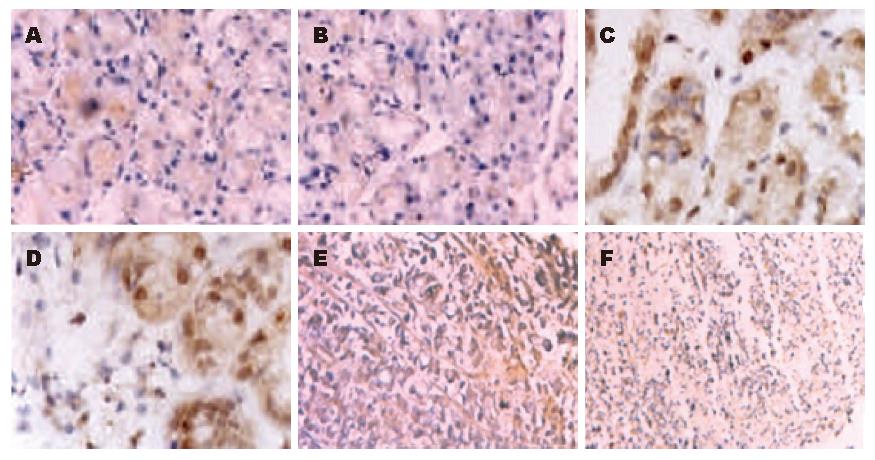
胃癌组织中TGF-β1和TGF-β R1蛋白阳性表达率显著高于正常胃组织(图1A-B)和萎缩性胃炎组(图1C-D)(P<0.01, 表2, 表3), 但萎缩性胃炎与正常对照组无显著差异(P>0.05). 棕黄色颗粒物质分布于胞核、胞质和间质中. 阳性细胞多见于癌巢坏死区的周边, 有时密集成团, 部分黏液腺癌的阳性物质弥漫分布于间质或腺体的腔膜面或腺腔中(图1E-F). 低分化胃癌组织TGF-β1, TGF-β R1阳性表达率高于高/中分化组(9/10, 9/10 vs 2/13, 3/13; 16/27, 16/27), 差异均有显著性(P<0.05). 27例TGF-β1阳性组织中, TGF-β R1阳性22例; 23例TGF-β1阴性组织中TGF-β R1阴性18例, 两者表达阳性率呈正相关(P<0.05).
恶性肿瘤在体内发生发展是一个错综复杂的过程, 受到多种相关基因的调控. 多种肿瘤组织TGF表达增高, 并参与肿瘤增殖、分化及凋亡等病理生理过程[12-16]. TGF-β是一族结构和功能密切相关的活性多肽, TGF-β1是这一家族的主要成员. TGF-β1是多类细胞增殖抑制剂, 广泛参与细胞的分化、增殖、形态改变、黏附、转移、细胞外基质产生及凋亡等[17-20].
在体外TGF-β1可通过阻止细胞从G1→S期, 对上皮起源细胞有明显的生长抑制作用[14], 恶性肿瘤中常有TGF-β1表达降低或缺失[21]. 近年, 国内外学者发现TGF-β1和TGF-β R1的表达与肝癌、肠癌的生长、转移、浸润及其预后有着较密切关系[22-23]. 阳性表达者TGF-β1表达增多, 肿瘤生长慢、不易转移和浸润, 预后良好. 本组资料也显示, 组织学分级Ⅰ级、癌细胞浸润未至深肌层和无淋巴结转移的胃癌其TGF-β1和TGF-β R1阳性率明显高于组织学分级Ⅲ级(癌细胞浸润至深肌层或浆膜层和淋巴结转移)的胃癌, 提示 TGF-β1和TGF-β R1可能在抑制胃癌生长、转移和浸润方面有重要作用.
TGF-β信号转导通路的机制是[12]: TGF-β 配体与膜受体(最常见的是Ⅰ和Ⅱ型)结合后, 形成Ⅰ和Ⅱ型两种受体异聚体, 该异聚体可以活化(磷酸化)下游的Smad2、Smad3蛋白, 进而与Smad4结合形成转录复合物进入细胞核内, 调节靶基因的转录, 发挥抑制生长效应. 因此, TGF-β和Smad4是TGF-β转导通路中起瓶颈作用的关键因子. 但依细胞类型和生理环境不同, TGF-β1可以表现出促进和抑制两方面的作用. Yanagihara et al[24]研究表明, TGF-β1在体外能抑制胃癌细胞株HSC-39和HSC-43的增殖, 并诱导其凋亡; 本研究结果显示, TGF-β1蛋白在肿瘤中高表达, 且随着胃癌分化程度降低而升高, 其说明TGF-β1在肿瘤恶性转化及增殖中可能起一定作用, 这与Naef et al[25]的研究结果一致. 另外, TGF-β1在肿瘤中高表达的原因还可能由于胃癌组织细胞失去了对TGF-β1的敏感性[26], 导致TGF-β1的反馈性表达升高; 而升高的TGF-β1表达失去TGF-β1抑制肿瘤生长的作用, 却没有丧失对NK, LAK等免疫细胞的抑制作用[27-29], 因此TGF-β1高表达可能是促进肿瘤细胞发生免疫逃逸的原因之一. 有研究发现[30], TGF-β1可以明显诱导原代培养的小鼠肝细胞发生凋亡, 在经TGF-β1处理的正常小鼠肝细胞中凋亡阳性率为55%, 而未经TGF-β1处理的细胞样本中阳性率仅为20%; Saito et al[31]研究发现TGF-β1在胃癌组织中的表达明显与血管内皮生长因子呈正比, 提示TGF-β1可能与肿瘤血管生成也有一定关系.
Hirayama et al[32]报告, 早期穿透型胃癌组织中即有TGF和TGF-β受体的高表达, 并认为与此型胃癌较强的生长浸润能力有关. Mahara et al[33]报道, 多种从硬癌类型的胃癌组织建立的细胞株(如Kato-Ⅲ)TGF-β1分泌明显增高, 并促进肿瘤细胞的增生及大量胶原间质的沉积. TGF-β1为DPC4基因的信号传递蛋白, Smad4的分子结构及其作用类似于TGF-β1, 两者在恶性肿瘤的表达存在正相关关系. 本研究表明, 肿瘤组织TGF-β1和TGF-β R1蛋白及其前体mRNA的表达均明显高于正常对照组和萎缩性胃炎组, 结果提示, TGF-β1和TGF-β R1的表达可能与胃癌的发生和发展有关. 另外本研究还发现, 低分化胃癌组织中TGF-β1和TGF-β R1的阳性表达率明显高于高或中度分化组, 提示, TGF-β1和TGF-β R1的表达可能也与组织的分化程度有关. 虽然伴中、重度肠腺化生的萎缩性胃炎组织中TGF-β1和TGF-β R1的表达略高于正常胃组织, 但差异无显著性. 因此TGF-β1和TGF-β R1能否作为判断癌前病变的指标需要更多的病例及随访观察来证明.
胃癌是最常见的恶性肿瘤之一. 最近研究发现, 转化生长因子-β(TGF-β)家族的分泌紊乱及其传导通路的中断与肿瘤的发生发展关系密切, 与恶性肿瘤的发展及转移有重要影响.
吴健雄, 教授, 中国医学科学院中国协和医科大肿瘤研究所肿瘤医院腹部外科
据统计中国胃癌患者的死亡率占全部恶性肿瘤的首位. 与其他恶性肿瘤一样, 胃癌的发生机制不明. 最近研究发现, 转化生长因子-β与肿瘤的发生发展关系密切. 研究热点在于探讨胃癌组织中TGF-β1、TGF-β R1蛋白及其前体mRNA在胃癌组织表达及其生物学意义.
近年, 国内外学者发现TGF-β1和TGF-β R1的表达与肝癌、肠癌的生长、转移、侵润及其预后有着密切关系. 阳性表达者TGF-β1表达增多, 肿瘤生长慢、不易转移和侵润, 预后良好.
胃癌组织细胞中TGF-β1和TGF-β R1的表达的研究为临床胃癌早期诊断和预后判断提供的有价值的实验依据.
本文研究方法尚严谨, 数据分析欠规范, 文章讨论部分欠佳, 内容条理尚可, 所得结论有科学价值.
编辑: 程剑侠 电编: 郭海丽
| 1. | Wrana JL, Attisano L, Wieser R, Ventura F, Massagué J. Mechanism of activation of the TGF-beta receptor. Nature. 1994;370:341-347. [PubMed] [DOI] |
| 2. | 李 京红. 转化生长因子β受体研究进展. 国外医学生理病理科学与临床分册. 1998;18:28-30. |
| 3. | Xu Y, Pasche B. TGF-beta signaling alterations and susceptibility to colorectal cancer. Hum Mol Genet. 2007;16 Spec No 1:R14-R20. [PubMed] [DOI] |
| 4. | Bian Y, Knobloch TJ, Sadim M, Kaklamani V, Raji A, Yang GY, Weghorst CM, Pasche B. Somatic acquisition of TGFBR1*6A by epithelial and stromal cells during head and neck and colon cancer development. Hum Mol Genet. 2007;16:3128-3135. [PubMed] [DOI] |
| 5. | Cox DG, Penney K, Guo Q, Hankinson SE, Hunter DJ. TGFB1 and TGFBR1 polymorphisms and breast cancer risk in the Nurses' Health Study. BMC Cancer. 2007;7:175. [PubMed] [DOI] |
| 6. | Bedossa P, Peltier E, Terris B, Franco D, Poynard T. Transforming growth factor-beta 1 (TGF-beta 1) and TGF-beta 1 receptors in normal, cirrhotic, and neoplastic human livers. Hepatology. 1995;21:760-766. [PubMed] |
| 7. | Takanami I, Imamura T, Hashizume T, Kikuchi K, Yamamoto Y, Kodaira S. Transforming growth factor beta 1 as a prognostic factor in pulmonary adenocarcinoma. J Clin Pathol. 1994;47:1098-1100. [PubMed] [DOI] |
| 9. | O'Brien C. New tumor suppressor found in pancreatic cancer. Science. 1996;271:294. [PubMed] [DOI] |
| 10. | Jin C, Naruse S, Kitagawa M, Ishiguro H, Muxin W, Nakajima M, Yokohata K, Ito O, Hayakawa T. Motilin regulates interdigestive gastric blood flow in dogs. Gastroenterology. 2002;123:1578-1587. [PubMed] [DOI] |
| 11. | Bodin L, Beaune PH, Loriot MA. Determination of cytochrome P450 2D6 (CYP2D6) gene copy number by real-time quantitative PCR. J Biomed Biotechnol. 2005;2005:248-253. [PubMed] [DOI] |
| 12. | Massagué J. TGF-beta signal transduction. Annu Rev Biochem. 1998;67:753-791. [PubMed] [DOI] |
| 13. | Hsiao YW, Liao KW, Chung TF, Liu CH, Hsu CD, Chu RM. Interactions of host IL-6 and IFN-gamma and cancer-derived TGF-beta1 on MHC molecule expression during tumor spontaneous regression. Cancer Immunol Immunother. 2008;57:1091-1104. [PubMed] [DOI] |
| 14. | Mincione G, Di Marcantonio MC, Artese L, Vianale G, Piccirelli A, Piccirilli M, Perrotti V, Rubini C, Piattelli A, Muraro R. Loss of expression of TGF-beta1, TbetaRI, and TbetaRII correlates with differentiation in human oral squamous cell carcinomas. Int J Oncol. 2008;32:323-331. [PubMed] |
| 15. | Langenskiöld M, Holmdahl L, Falk P, Angenete E, Ivarsson ML. Increased TGF-beta 1 protein expression in patients with advanced colorectal cancer. J Surg Oncol. 2008;97:409-415. [PubMed] |
| 16. | Ehata S, Hanyu A, Hayashi M, Aburatani H, Kato Y, Fujime M, Saitoh M, Miyazawa K, Imamura T, Miyazono K. Transforming growth factor-beta promotes survival of mammary carcinoma cells through induction of antiapoptotic transcription factor DEC1. Cancer Res. 2007;67:9694-9703. [PubMed] [DOI] |
| 17. | Yasuda K, Aoshiba K, Nagai A. Transforming growth factor-beta promotes fibroblast apoptosis induced by H2O2. Exp Lung Res. 2003;29:123-134. [PubMed] [DOI] |
| 18. | Yeh YY, Chiao CC, Kuo WY, Hsiao YC, Chen YJ, Wei YY, Lai TH, Fong YC, Tang CH. TGF-beta1 increases motility and alphavbeta3 integrin up-regulation via PI3K, Akt and NF-kappaB-dependent pathway in human chondrosarcoma cells. Biochem Pharmacol. 2008;75:1292-1301. [PubMed] [DOI] |
| 19. | Lee KB, Jeon JH, Choi I, Kwon OY, Yu K, You KH. Clusterin, a novel modulator of TGF-beta signaling, is involved in Smad2/3 stability. Biochem Biophys Res Commun. 2008;366:905-909. [PubMed] [DOI] |
| 20. | Buijs JT, Henriquez NV, van Overveld PG, van der Horst G, ten Dijke P, van der Pluijm G. TGF-beta and BMP7 interactions in tumour progression and bone metastasis. Clin Exp Metastasis. 2007;24:609-617. [PubMed] [DOI] |
| 21. | Nabokikh A, Ilhan A, Bilban M, Gartner W, Vila G, Niederle B, Nielsen JH, Wagner O, Base W, Luger A. Reduced TGF-beta1 expression and its target genes in human insulinomas. Exp Clin Endocrinol Diabetes. 2007;115:674-682. [PubMed] [DOI] |
| 22. | Cao Y, Deng C, Townsend CM, Ko TC. TGF-beta inhibits Akt-induced transformation in intestinal epithelial cells. Surgery. 2006;140:322-329. [PubMed] [DOI] |
| 23. | Ji GZ, Wang XH, Miao L, Liu Z, Zhang P, Zhang FM, Yang JB. Role of transforming growth factor-beta1-smad signal transduction pathway in patients with hepatocellular carcinoma. World J Gastroenterol. 2006;12:644-648. [PubMed] [DOI] |
| 24. | Yanagihara K, Tsumuraya M. Transforming growth factor beta 1 induces apoptotic cell death in cultured human gastric carcinoma cells. Cancer Res. 1992;52:4042-4045. [PubMed] |
| 25. | Naef M, Ishiwata T, Friess H, Büchler MW, Gold LI, Korc M. Differential localization of transforming growth factor-beta isoforms in human gastric mucosa and overexpression in gastric carcinoma. Int J Cancer. 1997;71:131-137. [PubMed] [DOI] |
| 26. | Fukumura Y, Suda K, Mitani K, Takase M, Kumasaka T. Expression of transforming growth factor beta by small duct epithelium in chronic, cancer-associated, obstructive pancreatitis: an in situ hybridization study and review of the literature. Pancreas. 2007;35:353-357. [PubMed] [DOI] |
| 27. | Kim R, Emi M, Tanabe K, Uchida Y, Toge T. The role of Fas ligand and transforming growth factor beta in tumor progression: molecular mechanisms of immune privilege via Fas-mediated apoptosis and potential targets for cancer therapy. Cancer. 2004;100:2281-2291. [PubMed] [DOI] |
| 28. | Weller M, Wick W, Platten M. Role of TGF-beta in oncogenesis. Microsc Res Tech. 2001;52:353. [PubMed] [DOI] |
| 29. | Weller M, Fontana A. The failure of current immunotherapy for malignant glioma. Tumor-derived TGF-beta, T-cell apoptosis, and the immune privilege of the brain. Brain Res Brain Res Rev. 1995;21:128-151. [PubMed] [DOI] |
| 30. | Arendt E, Ueberham U, Bittner R, Gebhardt R, Ueberham E. Enhanced matrix degradation after withdrawal of TGF-beta1 triggers hepatocytes from apoptosis to proliferation and regeneration. Cell Prolif. 2005;38:287-299. [PubMed] [DOI] |
| 31. | Saito H, Tsujitani S, Oka S, Kondo A, Ikeguchi M, Maeta M, Kaibara N. The expression of transforming growth factor-beta1 is significantly correlated with the expression of vascular endothelial growth factor and poor prognosis of patients with advanced gastric carcinoma. Cancer. 1999;86:1455-1462. [PubMed] [DOI] |
| 32. | Hirayama D, Fujimori T, Satonaka K, Nakamura T, Kitazawa S, Horio M, Maeda S, Nagasako K. Immunohistochemical study of epidermal growth factor and transforming growth factor-beta in the penetrating type of early gastric cancer. Hum Pathol. 1992;23:681-685. [PubMed] [DOI] |
| 33. | Mahara K, Kato J, Terui T, Takimoto R, Horimoto M, Murakami T, Mogi Y, Watanabe N, Kohgo Y, Niitsu Y. Transforming growth factor beta 1 secreted from scirrhous gastric cancer cells is associated with excess collagen deposition in the tissue. Br J Cancer. 1994;69:777-783. [PubMed] [DOI] |