修回日期: 2008-03-06
接受日期: 2008-03-10
在线出版日期: 2008-03-18
目的: 研究山东省临朐县胃癌高发区人群中胃黏膜病变与细胞增殖、凋亡的关系.
方法: 通过对1523例受试者进行胃内窥镜检查, 在胃内不同部位取胃黏膜活检进行病理学诊断, 明确胃黏膜病变的分布. 采用免疫组化方法检测Ki-67表达, 采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL), 评价不同病变细胞凋亡状况.
结果: 在受检人群中, 93.8%患有慢性萎缩性胃炎、肠上皮化生或异型增生. 各种病变在胃内分布不同, 在胃体大弯处, 正常或浅表性胃炎占84.56%, 异型增生仅占0.07%, 而在胃角处正常或浅表性胃炎为19.19%, 而异型增生则为5.26%. 研究还发现, 细胞增殖与病变程度相对应, 随着病变的加重, 增殖趋于活跃, 不同病变之间存在明显差异, 但细胞凋亡程度未见明显差异(P = 0.159).
结论: 在大样本人群研究中, 明确了肠上皮化生、异型增生等癌前病变与胃癌发生部位的一致关系及细胞增殖和凋亡的失调.
引文著录: 潘凯枫, 张阳, 张联, 马峻岭, 冯国双, 周彤, 李吉友, 游伟程. 胃癌高发区人群胃黏膜病变与细胞增殖、凋亡的关系. 世界华人消化杂志 2008; 16(8): 844-849
Revised: March 6, 2008
Accepted: March 10, 2008
Published online: March 18, 2008
AIM: To evaluate the relationship between gastric lesions and cell proliferation and apoptosis activity.
METHODS: A total of 1523 subjects received an endoscopic examination and five biopsies were obtained from standard sites of the stomach. Expression of Ki-67 was assessed by immunohistochemistry, and apoptotic cells were detected with the terminal deoxynucleotide transferase mediated dUTP nick end-labeling (TUNEL) method.
RESULTS: Among the subjects screened by endoscopic examination, 93.8% had chronic atrophic gastritis, intestinal metaplasia or dysplasia. The prevalence rates of gastric lesions varied in different sites of the stomach. In the greater curvature of the body, the proportion of normal mucosa or superficial gastritis was 84.56%, but dysplasia was only 0.07%. In the angulus, the proportion of normal mucosa or superficial gastritis was reduced to 19.19%, while the proportion of dysplasia reached 5.26%. Furthermore, gastric lesions were positively associated with cell proliferation activity, showing a tendency to increase Ki-67 labeling index according to the severity of gastric lesions. However, no significant association was seen between gastric lesion and cell apoptosis (P = 0.159).
CONCLUSION: Advanced gastric lesions, such as intestinal metaplasia and dysplasia, tend to occur along the lesser curvature of stomach, where gastric cancer occurs. Imbalance in cell proliferation and apoptosis can be observed in advanced gastric lesions.
- Citation: Pan KF, Zhang Y, Zhang L, Ma JL, Feng GS, Zhou T, Li JY, You WC. Relationship between precancerous gastric lesions and cell proliferation and apoptosis in a high-risk population. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 844-849
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.844
胃癌在中国及世界范围内居各类恶性肿瘤死因的第二位[1-3]. 我国每年大约有36-40万人死于胃癌[4]. 胃癌的发生是多因素参与的多阶段病理变化过程, 是多基因改变累积的结果, 最终引起上皮细胞的增殖失控或凋亡受阻而导致胃癌的发生[5-6].
细胞增殖和凋亡的异常在胃癌的发病中起重要作用, 已有大量相关研究的报道[7-8]. 然而, 由于胃癌的异质性和生物学行为的复杂性, 从胃癌细胞系或动物模型获得的研究结果难以准确反映胃黏膜长期演变过程中细胞增殖和凋亡的异常演变. 因此, 对不同胃黏膜病变阶段细胞增殖和凋亡状况进行研究, 对理解胃癌的发生、发展机制具有重要意义.
目前已有幽门螺杆菌感染与细胞增殖和凋亡关系的研究报道[9-11], 但尚缺乏从浅表性胃炎、慢性萎缩性胃炎到异型增生阶段胃黏膜演变过程的系统研究. 山东省临朐县是我国北方的胃癌高发区之一, 1980年胃癌标化死亡率为38/10万, 其中男性为70/10万, 胃癌组织学类型以肠型为主[12]. 自1983年起我们在临朐县建立了胃癌高发现场, 在高危人群中开展了一系列胃癌及癌前病变的病理流行特征、癌前病变的渐变过程及环境因素、遗传因素的研究, 并针对病因学开展了干预试验[13-20]. 在此基础上, 本研究对不同胃黏膜病变的分布及与细胞增殖、凋亡的关系进行研究.
2002年, 我们在山东省临朐县胃癌高发区采用整群随机抽样的方法在5个乡镇中随机选择12个自然村, 以35-64岁(2002-01的实足年龄)居民为研究对象. 在12个村中, 除精神异常、怀孕、病重、长期外出人口外, 共登记3167人, 其中2850人参加了体检和静脉抽血, 占登记人口的90.0%. 经过体检, 适合接受胃内窥镜检查者为2734人, 完成胃内窥镜检查者2638人, 受检率为96.5%. 在受检者中有2579例(97.8%)完成胃黏膜病理学诊断. 在进行胃内窥镜检查的同时收集详细的人口学资料、吸烟及饮酒资料.
在上述人群中随机选择1523例具有不同胃黏膜病变的受试者为本次研究对象. 其中, 有吸烟资料的为1472例, 有饮酒资料的为1469例.
本研究经过北京大学临床肿瘤学院伦理道德委员会审查通过, 所有受试者均签署了知情同意书.
1.2.1 胃内窥镜检查及病理学诊断: 受检者在常规体检后, 空腹进行胃内窥镜检查. 检查前用1%地卡因进行喉部局部麻醉, 然后由1-2名主治医师以上的消化科医师及2名助手用日产Olympus-Q20胃内窥镜对食道及全胃进行检查. 在胃内窥镜直视下, 观察并描述胃黏膜状况, 并根据Sydney分类系统[21]推荐的五个标准部位取胃黏膜活检. 在胃内窥镜检查后的d 2, 由专门的医师对受检者进行回访.
在胃镜检查时对胃窦大弯、胃窦小弯、胃角、胃体大弯和胃体小弯5处标准部位分别取胃黏膜活检组织, 并进行病理学诊断. 胃黏膜活检组织经40 g/L福尔马林固定、石蜡包埋、切片、HE. 染色, 由3名副主任医师以上病理医生按照Sydney[21]和Padova国际分类[22]标准对每个活检组织分别进行诊断. 在全部完成5个部位病理诊断后, 受检者以取材部位中最严重病变为最高病理诊断. 胃黏膜病变由轻至重依次诊断为: 浅表性胃炎(superficial gastritis, SG)、慢性萎缩性胃炎(chronic atrophic gastritis, CAG)、肠上皮化生(intestinal metaplasia, IM)、不确定性异型增生(indefinite dysplasia, Ind DYS)和异型增生(dysplasia, DYS). 在本研究人群中, 由于诊断为正常胃黏膜的受试者很少, 因此, 在分析中将正常胃黏膜与SG合并(SG/N)进行分析.
1.2.2 细胞增殖水平(Ki-67)的免疫组化检测: 将石蜡切片经过二甲苯脱蜡, 梯度酒精(100%→95%→90%→85%→80%)水化后, 加入30 mL/L H2O2封闭内源性过氧化物酶, 室温10 min. PBS洗5 min×3次. 切片放入0.01 mol/L枸橼酸钠抗原修复液中, 450 W微波加热, 92-95 ℃ 5 min×2次, 室温冷却. 滴加50 g/L脱脂牛奶封闭, 37 ℃水浴30 min. 倾去多余牛奶, 滴加一抗(Ki-67 mAb, 1:100稀释, 北京中杉金桥公司), 4 ℃冰箱过夜. PBS洗5 min×3次. 滴加通用二抗IgG(PV-9000 Immuno-Bridge, 美国GBI公司), 37 ℃水浴30 min, PBS洗5 min×3次. 用新鲜配制的二氨基联苯氨(DAB)显色液进行显色, 封片, 用光学显微镜进行观察.
细胞核被染成棕黄色或深棕黄色为阳性细胞, 以3-5个高倍视野(×40倍)内计数500个上皮细胞, 以平均100个细胞中阳性细胞的个数为Ki-67标记指数(Ki-67 labeling index).
1.2.3 组织标本凋亡细胞的原位检测: 本实验采用原位凋亡检测试剂盒(TACS. XLTM-Basic, R&D Systems, Inc.)对凋亡细胞进行原位检测. 该试剂盒是根据脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal-deoxynucleotidyl transferase mediated nick and labeling, TUNEL)原理进行检测. 主要步骤为首先制备4 μm的石蜡包埋的组织切片, 进行脱蜡、再水化, 加入蛋白酶K溶液(试剂盒提供), 37 ℃消化30 min, 将切片置于1×TdT标记溶液中5 min, 加50 μL标记反应混合液, 置37 ℃湿盒中孵育1 h, 终止反应后, 加入50 μL稀释的抗体溶液, 37 ℃孵育1 h, 再加入Streptavidin-HRP溶液, 室温孵育20 min. 用DAB试剂盒(北京中杉金桥公司)进行显色, 再用甲基绿复染, 封片, 用光学显微镜进行观察.
每次实验均设立一个阳性对照和阴性对照, 以监测实验过程中标记、染色和复染过程. 该公司提供的阳性对照片为细胞涂片, 但考虑到细胞涂片与我们要检测的组织切片在细胞通透性等方面有一定的差距, 因此采用与检测的组织切片具有相同来源的切片, 用蛋白酶K消化后, 用DNase I处理作为阳性对照, 切片不加TdT酶做为阴性对照. 凋亡细胞以细胞核被染成棕黄色或深棕黄色为阳性. 由于胃镜取材较小, 并且凋亡细胞数较少, 因此在病变部位胃黏膜上皮细胞内出现的凋亡细胞全部计数(一般为5-7个高倍视野).
统计学处理 将胃黏膜病变按病理诊断轻重依次赋值为1-5(1 = SG/N, 2 = CAG, 3 = IM, 4 = Ind DYS, 5 = DYS), 为有序分类变量. 胃内5个部位(1 = 胃体小弯, 2 = 胃体大弯, 3 = 胃角, 4 = 胃窦小弯, 5 = 胃窦大弯)为无序分类变量. 对研究对象的基本资料采用一般的统计学描述分析, 无序分类变量采用卡方检验进行分析, 多个有序分类变量采用Ridit(relative to an identified distribution)分析.
年龄、性别、吸烟及饮酒状况与不同癌前病变的关系及不同癌前病变与细胞凋亡程度之间的关系采用Ridit分析, 不同癌前病变与细胞增殖程度之间的关系采用Kruskal-Wallis非参数检验方法进行分析. Ridit分析用Excel实现, 其他分析均以SAS 8.2(SAS Institute, Cary, NC, USA)统计软件实现, P值取双侧, 以0.05为临界值.
在1523例受试者中, 有最高诊断的为1475例, 男780例, 占52.9%, 平均年龄51.0±6.5岁; 女695例, 占47.1%, 平均年龄50.5±6.3岁, 受试者不同胃黏膜病变的年龄、性别、吸烟及饮酒状况分布见表1.
| SG/N | CAG | IM | Ind DYS | DYS | 合计 | |
| 年龄(岁) | ||||||
| <45 | 9 | 67 | 73 | 119 | 14 | 282 |
| ≥45 | 83 | 264 | 318 | 403 | 125 | 1193 |
| 性别 | ||||||
| 男 | 71 | 190 | 176 | 259 | 84 | 780 |
| 女 | 21 | 141 | 215 | 263 | 55 | 695 |
| 吸烟状况 | ||||||
| 吸烟 | 49 | 125 | 113 | 181 | 66 | 534 |
| 不吸烟 | 43 | 204 | 278 | 341 | 72 | 938 |
| 饮酒状况 | ||||||
| 饮酒 | 46 | 137 | 125 | 191 | 68 | 567 |
| 不饮酒 | 46 | 192 | 265 | 329 | 70 | 902 |
从表1可以看出, 各种癌前病变在不同性别间存在明显差异(P = 0.03), 而年龄、吸烟及饮酒状况在不同病变中的分布均无明显差别(P>0.05).
在1475例有最高诊断的受试者中, SG/N 92例(6.2%)、CAG 331例(22.4%)、IM 391例(26.5%)、Ind DYS 522例(35.4%)、DYS 139例(9.4%).
因每位受试者均在胃内五个标准部位取胃黏膜活检, 理论上1523例受试者应有标本数7615个, 但实际操作中由于取材未达黏膜肌层或其他原因, 实际分析标本数为7504个, 其中诊断为SG/N 3076(41.0%)、CAG 1909(25.4%)、IM 1196(16.0%)、Ind DYS 1143(15.2%)、DYS 180(2.4%).
我们对各种癌前病变在胃内发生部位进行了比较(表2), 结果显示: 胃体大弯主要以SG/N为主, 占84.56%, 随着病变的加重, 检出比例逐渐下降. 相反, 发生在胃角和胃窦小弯的SG/N比例明显低于胃体大弯, 而随着病变的加重, 重度病变的检出比例明显高于胃体大弯, 说明重度病变多集中在胃角和胃窦小弯处.
| 胃内部位 | SG/N | CAG | IM | Ind DYS | DYS | 合计(n) |
| 胃体小弯 | 47.43 | 18.34 | 19.00 | 13.32 | 1.91 | 1516 |
| 胃体大弯 | 84.56 | 9.48 | 3.25 | 2.65 | 0.07 | 1509 |
| 胃角 | 19.19 | 31.58 | 19.85 | 24.12 | 5.26 | 1501 |
| 胃窦小弯 | 19.11 | 31.56 | 22.81 | 23.01 | 3.50 | 1486 |
| 胃窦大弯 | 34.12 | 36.53 | 14.88 | 13.20 | 1.27 | 1492 |
经Ridit分析显示, 癌前病变的严重程度在胃黏膜的不同部位之间存在明显差异(P<0.0001). 胃内不同部位的平均Ridit值分别为: 胃体大弯0.27、胃体小弯0.48、胃窦大弯0.51、胃窦小弯0.62、胃角0.63, 表明胃体大弯的病变最轻, 其次为胃体小弯和胃窦大弯, 而胃角和胃窦小弯的病变程度最重.
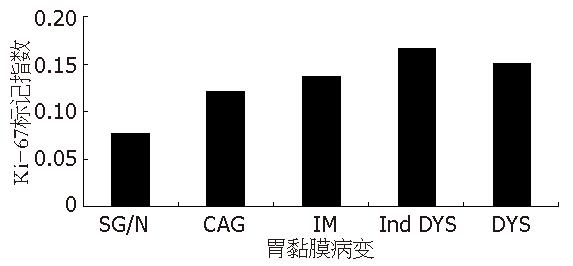
为了比较不同胃黏膜病变细胞增殖水平, 我们对五个部位胃黏膜组织标本的Ki-67标记指数进行了分析. 共有7300例组织标本完成了Ki-67免疫组化检测, 结果显示: Ki-67标记指数的均值和中位数均有随着病变的加重而逐渐增加趋势(图1), SG/N均值为0.102±0.085(中位数: 0.078)、CAG均值为0.136±0.091(中位数: 0.122)、IM均值为0.157±0.102(中位数: 0.138)、Ind DYS均值为0.181±0.111(中位数: 0.166)、DYS均值为0.189±0.117(中位数: 0.152), 经趋势检验有显著性差异(P<0.0001). 对胃内不同部位Ki-67标记指数进行比较, 结果发现, 胃体大弯处Ki-67标记指数的均值最低, 为0.095±0.079(中位数: 0.070), 其次为胃体小弯, 均值为0.128±0.101(中位数: 0.100), 胃窦大弯和胃窦小弯的均值分别为0.145±0.097(中位数: 0.126)和0.149±0.101(中位数: 0.130), 而胃角处的均值最高, 为0.152±0.105(中位数: 0.130), 经趋势检验有显著性差异(P<0.0001).
共有7401例胃黏膜组织标本进行了凋亡细胞的原位检测. 将细胞凋亡水平划分为四个数量级, 分别为: 凋亡细胞数为0, 小于等于2, 3-10及大于10个. 通过对不同胃黏膜病变细胞凋亡水平进行比较(表3), 不同病变之间和解剖部位之间细胞凋亡水平没有明显差异(P = 0.159, P = 0.397).
| 凋亡 | 胃黏膜病变(%) | |||||
| SG/N | CAG | IM | Ind DYS | DYS | 合计(n) | |
| 0 | 43.18 | 22.33 | 17.14 | 15.03 | 2.32 | 4044 |
| ≤2 | 40.84 | 27.23 | 14.53 | 14.96 | 2.44 | 1638 |
| 3-10 | 37.36 | 28.55 | 15.45 | 16.20 | 2.43 | 1191 |
| >10 | 31.06 | 37.50 | 12.31 | 16.29 | 2.84 | 528 |
本研究对一组胃癌高危人群胃内不同部位7000多例胃黏膜组织标本进行分析, 采用分子流行病学、病理学等多学科合作方式, 对不同胃黏膜病变的分布及不同病变细胞增殖、凋亡状况进行了系统研究, 在国内外尚属首次.
1988年Correa提出了肠型胃癌的发病假说[23], 即在慢性胃炎病变基础上, 组织发生了肠上皮化生和异型增生的多阶段变化过程, 最终导致胃癌. 我们在临朐县开展的前瞻性研究发现, 患有重度肠上皮化生和中重度异型增生的人群发展为胃癌的危险性分别增加20及100余倍[12], 这种高强度关联充分证明胃癌的发生经历了多阶段的癌前病变过程.
由浅表性胃炎到异型增生的一系列病变在胃内不同部位存在明显差异. 我们前期对临朐县胃癌及癌前病变进行分析发现, 70%的胃癌发生在胃窦或胃角, 肠上皮化生和异型增生呈灶状分布但也多集中在胃窦或胃角[12,24]. 进一步对应分析表明, 胃癌发生部位与肠上皮化生和异型增生高度对应. 本次研究也发现, 在胃癌高发区人群中, 90%以上的人患有慢性萎缩性胃炎、肠上皮化生和异型增生, 并且重度病变多集中在胃角和胃窦小弯. 这一结果再一次证明胃癌与癌前病变密切相关, 是多阶段演变过程导致的最终结果.
在正常情况下, 细胞增殖和凋亡处于平衡, 胃黏膜上皮才能维持生理功能, 在慢性炎症时, 在炎症因子或其他因素的持续作用下, 细胞生长调控系统发生紊乱, 导致细胞过度增殖, 凋亡受阻, 平衡失调[8,10], 最终导致胃癌的发生.
在明确胃黏膜病理形态学变化的同时, 对不同病变细胞增殖和凋亡进行比较, 发现随着胃黏膜病变的加重, 细胞增殖水平逐渐增高, 不同病变之间差异明显, 两者存在明显的相关性. 另外, 研究还发现, 细胞增殖状况在胃内并非随机分布, Ki-67标记指数在浅表性胃炎分布较为集中的胃体大弯处最低, 而以肠上皮化生和异型增生较为集中的胃角和胃窦小弯处最高, 再一次证明两者高度相关, 既随着病变的加重, 细胞增殖水平逐渐增加.
与细胞增殖一样, 细胞凋亡对维持胃黏膜正常机能发挥同等重要作用. 在对7000余例组织标本研究发现, 随着病变加重, 细胞增殖趋于活跃, 但细胞凋亡程度并未相应增加, 因而造成细胞增殖和凋亡失衡, 增加发生癌变的危险. 韩国Lee et al[25]研究发现, 在幽门螺杆菌感染组, 细胞增殖和凋亡水平均明显增加, 并且随着病变的加重, 从慢性萎缩性胃炎到肠上皮化生细胞凋亡指数和增殖指数的比值逐渐降低. 一些研究也表明, 幽门螺杆菌感染能促进胃黏膜上皮细胞的增殖和凋亡, 并且, 不同幽门螺杆菌菌株之间存在明显差异[9,10,26]. 另外, 研究还发现, 不同病变之间细胞增殖、凋亡相关基因如p53、Bax、Bcl-2的表达也存在差异[27-30]. 然而, 在不同胃黏膜病变阶段包括从浅表性胃炎到异型增生这一系列病变过程中细胞增殖和凋亡状况如何, 尚未见报道. 我们的结果表明, 在癌前病变阶段, 随着病变的加重, 细胞增殖的速度明显增加, 但细胞凋亡程度却未见差异, 说明在癌前病变阶段已经存在细胞增殖和凋亡失衡, 并且可能随着病变的加重, 这种失衡状态越明显.
本研究尚存在一些不足之处. 首先, 我们只分析了不同胃黏膜病变的细胞增殖和凋亡状况, 对细胞增殖、凋亡相关基因的表达状况尚未深入研究. 其次, 未对幽门螺杆菌感染与细胞增殖和凋亡的关系进行分析.
总之, 本研究通过在胃癌高发区大样本的人群流行病学研究, 再次明确了不同胃黏膜病变的分布规律, 并发现随着胃黏膜病变的加重, 细胞增殖水平逐渐加快, 但细胞凋亡程度在不同病变之间未见差异, 从而导致癌前病变的进展, 增加胃癌发生的风险.
细胞增殖和凋亡的异常在胃癌的发病中起重要作用. 山东省临朐县是我国北方的胃癌高发区, 在高发区大样本人群中对不同胃黏膜病变细胞增殖和凋亡状况进行研究, 对明确胃癌的发生机制、指导胃癌预防具有重要意义.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室
目前关于胃癌发生过程中细胞增殖和凋亡状况的研究主要来自于胃癌细胞系或动物模型, 尚未见在大样本人群中的研究报道.
本文对胃癌高危人群胃内不同部位7000多例胃黏膜组织标本进行分析, 在国内外尚属首次. 结果表明在癌前病变阶段已经存在细胞增殖和凋亡失衡, 并且可能随着病变的加重, 失衡状态越明显.
本研究结果为明确胃癌发生机制提供了重要依据.
本文条理清楚, 文笔流畅, 重点突出, 样本数大, 具有很好的科学意义.
编辑: 程剑侠 电编: 何基才
| 1. | Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J Cancer. 2001;37 Suppl 8:S4-66. [PubMed] [DOI] |
| 2. | Parkin DM, Muir CS. Cancer Incidence in Five Continents. Comparability and quality of data. IARC Sci Publ. 1992;45-173. [PubMed] |
| 3. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 4. | 游 伟程. 胃癌. 第1版. 北京: 中国医药科技出版社 2006; 52-61. |
| 5. | Fuchs CS, Mayer RJ. Gastric carcinoma. N Engl J Med. 1995;333:32-41. [PubMed] [DOI] |
| 6. | Peek RM, Blaser MJ. Helicobacter pylori and gastrointestinal tract adenocarcinomas. Nat Rev Cancer. 2002;2:28-37. [PubMed] [DOI] |
| 7. | Shiotani A, Iishi H, Ishiguro S, Tatsuta M, Nakae Y, Merchant JL. Epithelial cell turnover in relation to ongoing damage of the gastric mucosa in patients with early gastric cancer: increase of cell proliferation in paramalignant lesions. J Gastroenterol. 2005;40:337-344. [PubMed] [DOI] |
| 8. | Konturek PC, Kania J, Konturek JW, Nikiforuk A, Konturek SJ, Hahn EG. H. pylori infection, atrophic gastritis, cytokines, gastrin, COX-2, PPAR gamma and impaired apoptosis in gastric carcinogenesis. Med Sci Monit. 2003;9:SR53-SR66. [PubMed] |
| 9. | Yu J, Leung WK, Go MY, Chan MC, To KF, Ng EK, Chan FK, Ling TK, Chung SC, Sung JJ. Relationship between Helicobacter pylori babA2 status with gastric epithelial cell turnover and premalignant gastric lesions. Gut. 2002;51:480-484. [PubMed] [DOI] |
| 10. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 11. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 12. | You WC, Li JY, Blot WJ, Chang YS, Jin ML, Gail MH, Zhang L, Liu WD, Ma JL, Hu YR. Evolution of precancerous lesions in a rural Chinese population at high risk of gastric cancer. Int J Cancer. 1999;83:615-619. [PubMed] [DOI] |
| 13. | You WC, Li JY, Zhang L, Jin ML, Chang YS, Ma JL, Pan KF. Etiology and prevention of gastric cancer: a population study in a high risk area of China. Chin J Dig Dis. 2005;6:149-154. [PubMed] [DOI] |
| 14. | 游 伟程. 胃癌及癌前病变的研究与干预--23年胃癌高发现场的实践. 北京大学学报(医学版). 2006;38:565-570. |
| 15. | Liu F, Pan K, Zhang X, Zhang Y, Zhang L, Ma J, Dong C, Shen L, Li J, Deng D. Genetic variants in cyclooxygenase-2: Expression and risk of gastric cancer and its precursors in a Chinese population. Gastroenterology. 2006;130:1975-1984. [PubMed] [DOI] |
| 16. | Zhang L, Shen L, Ma JL, Pan KF, Liu WD, Li J, Xiao SD, Lin SR, Classen M, You WC. Eradication of H. pylori infection in a rural population: one-day quadruple therapy versus 7-day triple therapy. World J Gastroenterol. 2006;12:3915-3918. [PubMed] [DOI] |
| 17. | Lu W, Pan K, Zhang L, Lin D, Miao X, You W. Genetic polymorphisms of interleukin (IL)-1B, IL-1RN, IL-8, IL-10 and tumor necrosis factor {alpha} and risk of gastric cancer in a Chinese population. Carcinogenesis. 2005;26:631-636. [PubMed] [DOI] |
| 18. | You WC, Zhang L, Gail MH, Chang YS, Liu WD, Ma JL, Li JY, Jin ML, Hu YR, Yang CS. Gastric dysplasia and gastric cancer: Helicobacter pylori, serum vitamin C, and other risk factors. J Natl Cancer Inst. 2000;92:1607-1612. [PubMed] [DOI] |
| 19. | You WC, Zhang L, Yang CS, Chang YS, Issaq H, Fox SD, Utermahlen WE, Zhao L, Keefer L, Liu WD. Nitrite, N-nitroso compounds, and other analytes in physiological fluids in relation to precancerous gastric lesions. Cancer Epidemiol Biomarkers Prev. 1996;5:47-52. [PubMed] |
| 20. | You WC, Brown LM, Zhang L, Li JY, Jin ML, Chang YS, Ma JL, Pan KF, Liu WD, Hu Y. Randomized double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions. J Natl Cancer Inst. 2006;98:974-983. [PubMed] [DOI] |
| 21. | Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996;20:1161-1181. [PubMed] [DOI] |
| 22. | Rugge M, Correa P, Dixon MF, Hattori T, Leandro G, Lewin K, Riddell RH, Sipponen P, Watanabe H. Gastric dysplasia: the Padova international classification. Am J Surg Pathol. 2000;24:167-176. [PubMed] [DOI] |
| 23. | Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:3554-3560. [PubMed] |
| 24. | You WC, Blot WJ, Chang YS, Li JY, Jin M, Zhao YX, Kneller RW, Xie YQ, Zhang L, Xu GW. Comparison of the anatomic distribution of stomach cancer and precancerous gastric lesions. Jpn J Cancer Res. 1992;83:1150-1153. [PubMed] [DOI] |
| 25. | Lee KM, Lee DS, Yang JM, Ahn BM, Lee EH, Yoo JY, Kim YJ, Chung IS, Sun HS, Park DH. [Effect of Helicobacter pylori on gastric epithelial cell kinetics and expression of apoptosis-related proteins in gastric carcinogenesis]. Korean J Gastroenterol. 2003;42:12-19. [PubMed] |
| 26. | Zhang Z, Yuan Y, Gao H, Dong M, Wang L, Gong YH. Apoptosis, proliferation and p53 gene expression of H. pylori associated gastric epithelial lesions. World J Gastroenterol. 2001;7:779-782. [PubMed] [DOI] |
| 27. | Kurosawa A, Miwa H, Hirose M, Tsune I, Nagahara A, Sato N. Inhibition of cell proliferation and induction of apoptosis by Helicobacter pylori through increased phosphorylated p53, p21 and Bax expression in endothelial cells. J Med Microbiol. 2002;51:385-391. [PubMed] [DOI] |
| 28. | Wang J, Chi DS, Kalin GB, Sosinski C, Miller LE, Burja I, Thomas E. Helicobacter pylori infection and oncogene expressions in gastric carcinoma and its precursor lesions. Dig Dis Sci. 2002;47:107-113. [PubMed] [DOI] |
| 29. | Vukobrat-Bijedić Z, Radović S, Husić-Selimović A, Gornjaković S. Tumor suppresser gene p53 expression in premalignant lesions and gastric carcinoma - prognostic value. Bosn J Basic Med Sci. 2007;7:7-10. [PubMed] |
| 30. | Feng CW, Wang LD, Jiao LH, Liu B, Zheng S, Xie XJ. Expression of p53, inducible nitric oxide synthase and vascular endothelial growth factor in gastric precancerous and cancerous lesions: correlation with clinical features. BMC Cancer. 2002;2:8. [PubMed] [DOI] |