修回日期: 2008-02-19
接受日期: 2008-02-25
在线出版日期: 2008-03-18
目的: 研究非酒精性脂肪肝家兔肝纤维化形成过程中肝窦壁层粘连蛋白(LN)及透明质酸(HA)的变化.
方法: 用高脂饲料诱发脂肪肝的方法建立家兔非酒精性肝病动物模型, 取肝组织用扫描电镜、特殊染色等进行病理组织形态学观察; 免疫组化检测LN; 放射免疫法测定血清HA, 研究非酒精性脂肪肝家兔在肝纤维化形成过程中肝窦壁基底膜成分的动态变化.
结果: 肝窦毛细血管化, 即窗孔消失、基底膜形成; 肝窦壁LN表达(面积百分比)和血清HA含量(mg/L)均随着肝纤维化形成逐渐增加, 在8 wk末阳性最强, 均与对照组有显著性差异(LN: 25.2±1.0 vs 5.1±0.7, P<0.01; 血清HA: 1422.18±20.9 vs 1189.3±13.1, P<0.01), 停止造模后逐渐下降, 但停药8 wk均强于正常组.
结论: 家兔肝纤维化形成过程中, 肝窦壁功能性基底膜被破坏, 发生肝窦毛细血管化. 血清HA含量的变化与电镜下SEC去窗孔的改变, 以及LN的变化相一致.
引文著录: 赵迎庆, 王炳元. 家兔非酒精性脂肪肝肝纤维化形成中层粘连蛋白及透明质酸的变化. 世界华人消化杂志 2008; 16(8): 823-828
Revised: February 19, 2008
Accepted: February 25, 2008
Published online: March 18, 2008
AIM: To observe the changes of laminin (LN) and hyaluronic acid (HA) on the formation of non-alcoholic fatty liver fibrosis in rabbits.
METHODS: Firstly, the rabbit models of fatty liver and liver fibrosis were set up by hypercholesteremia. Liver tissues were collected and the histopathological changes were observed using transmission endoscopy and staining methods. Immunohistochemistry was used to detect LN expression and radioimmunoassy was used the measure serum HA concentration. Successive observation was used to outline the dynamic changes of basement membrane of hepatic sinusoid during the formation of non-alcoholic fatty liver fibrosis in rabbits.
RESULTS: Sinusoidal capillarization was characterized by defenestration of sinusoidal endothelial cells (SEC) and formation of basement membrane. Along with the formation of liver fibrosis, the positive expression (area percentage) of LN on sinusoidal wall and the concentration (mg/L) of serum HA increased gradually, and both of them reached the peak at 8 wk; there were significant differences in contrast with those in the normal group (LN: 25.2 ± 1.0 vs 5.1 ± 0.7, P < 0.01; serum HA: 1422.18 ± 20.9 vs 1189.3 ± 13.1, P < 0.01). After stopping high-sterone feeding, the positive expression of LN and concentration of HA decreased gradually.
CONCLUSION: The changes of serum HA concentration are in accordance with the defenestration of hepatic sinusoid and LN changes. LN and HA may be used as cardinal markers for hepatic sinusoidal capillarization and liver fibrosis.
- Citation: Zhao YQ, Wang BY. Successive observation of laminin and hyaluronic acid on the formation of non-alcoholic fatty liver fibrosis in rabbits. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 823-828
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/823.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.823
多种原因可导致肝纤维化, 但形成的机制至今仍然不清. 有人认为肝窦内皮细胞(liver sinusoids endothelial cell, LSEC)的失窗孔化和肝窦毛细血管化(sinusoid capillarization)的形成是其中的发病机制之一[1-5], 而肝窦内皮下基底膜的形成是肝纤维化过程中肝窦毛细血管化的一个重要特征[6-9]. 有关基底膜的主要成分层粘连蛋白(laminin, LN), 以及反映肝窦内皮细胞功能的透明质酸(hyaluaric acid, HA)含量在非酒精性脂肪肝肝纤维化过程中动态变化尚缺乏系统的研究. 我们采用Buyssens的方法[10]成功地建立了实验性高胆固醇血症家兔肝纤维化模型, 对此领域进行初步的探讨.
新西兰白种家兔40只, 体质量2.5-3.5 kg, 由中国医科大学实验动物部提供, 用平衡饲料喂养1 wk后随机分模型组25只, 对照组15只, 分笼饲养. 模型组家兔给予高脂饲料喂养, 即在普通平衡饲料基础上加2%胆固醇, 该剂量持续8 wk末, 之后停用胆固醇, 用平衡饲料再继续观察8 wk(共16 wk); 对照组给予普通平衡饲料喂养16 wk. 于2、4、8、12、16 wk末分别处死模型组家兔各5只及对照组家兔各3只. 经ip麻醉后, 经心脏灌流固定, 从肝右叶中部切取肝组织, 40 g/L甲醛溶液固定, 制备光镜标本.
1.2.1 肝脏组织病理学检测: HE染色及VG苦味酸染色, VG苦味酸染色结果用病理图像分析仪(北京微电子所PJ2000型)分析, 测定胶原纤维面积百分比. 每张切片选取四周及中央5个区域, 均取该区域中胶原纤维含量最多的视野(每个视野至少包括1个中央静脉), 10倍物镜下测定胶原纤维面积百分比(胶原纤维面积/肝组织面积×100%), 取平均值. 另取肝组织, 25 mg/L戊二醛溶液固定后, 制备电镜标本.
1.2.2 层粘连蛋白免疫组织化学染色: 按免疫组化ABC法染色. 兔抗人层粘连蛋白多克隆抗体ABC试剂盒及DAB显色试剂均购自武汉博士德公司. 免疫组化染色结果用病理图象分析仪分析, 以细胞膜/细胞质中有棕黄色颗粒或线状沉积为阳性, 测定阳性反应面积比, 每张切片选取四周及中央5个区域, 均取该区域中阳性反应最多的视野, 10倍物镜下测定阳性反应面积比(阳性面积/肝组织面积×100%), 取平均值.
1.2.3 血浆透明质酸测定: 于2、4、8 wk末和停药后4、8 wk末分别对模型组家兔各5只及对照组家兔各3只, 耳缘静脉取血, 分离血浆, 按照上海海军医学研究所生产的放免测定试剂盒说明书测定HA的含量.
统计学处理 数据用mean±SD表示, 模型组和对照组比较采用t检验, 以P<0.05为差异有显著性.
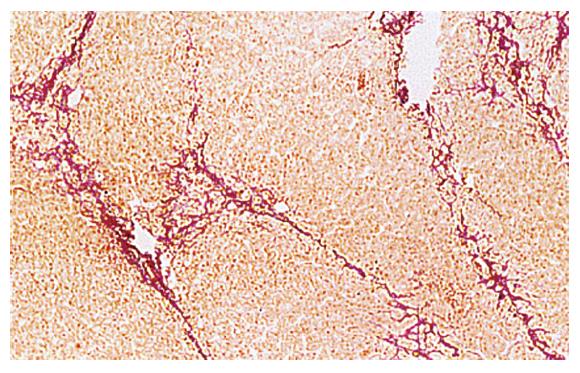
对照组HE染色可见正常中央静脉及放射状排列的肝板. VG苦味酸染色可见中央静脉及汇管区有极少量的胶原纤维. 模型组2 wk末, HE染色可见肝细胞轻度脂肪变性及点状坏死, VG苦味酸染色较对照组轻度增加. 4 wk末, 模型组HE染色可见肝细胞中重度脂肪变性, 炎性细胞浸润加重, VG苦味酸染色较前稍增加. 8 wk末模型组HE染色肝细胞坏死增多, 炎性细胞浸润成团, VG苦味酸染色终末静脉(包括中央静脉)增厚, 胶原纤维向窦周隙延伸, 窦周纤维组织较前增加(图1). 停止造模4 wk末HE染色肝细胞坏死及炎性细胞浸润明显减轻, 停止造模8 wk末可见肝细胞轻度脂肪变, VG苦味酸染色胶原纤维染色逐渐减弱, 但至16 wk末仍强于正常组. VG苦味酸染色病理图像分析结果可见模型组胶原纤维面积百分比明显高于对照组(P<0.01, 表1).
| 指标 | 分组 | t/wk | ||||
| 2 | 4 | 8 | 12 | 16 | ||
| 胶原纤维面积比 | 对照组 | 4.5±0.2 | 4.6±0.6 | 4.8±0.5 | 4.7±0.4 | 4.3±0.8 |
| 模型组 | 5.1±0.3 | 12.5±0.8a | 18.5±0.9ad | 11.1±0.7a | 6.2±0.3a | |
| LN面积比 | 对照组 | 4.4±0.1 | 4.8±0.5 | 5.1±0.7 | 5.1±0.6 | 4.9±0.7 |
| 模型组 | 5.3±0.2 | 17.7±0.8a | 25.2±1.0ad | 15.3±0.5a | 9.8±1.7a | |
| 血清HA(μg/L) | 对照组 | 1191.3±12.9 | 1188.4±15.8 | 1189.3±13.1 | 1189.9±13.1 | 1189.9±13.6 |
| 模型组 | 1211.5±21.3 | 1320.3±21.5a | 1422.18±20.9ad | 1280.4±21.1a | 1208.2±15.7 | |
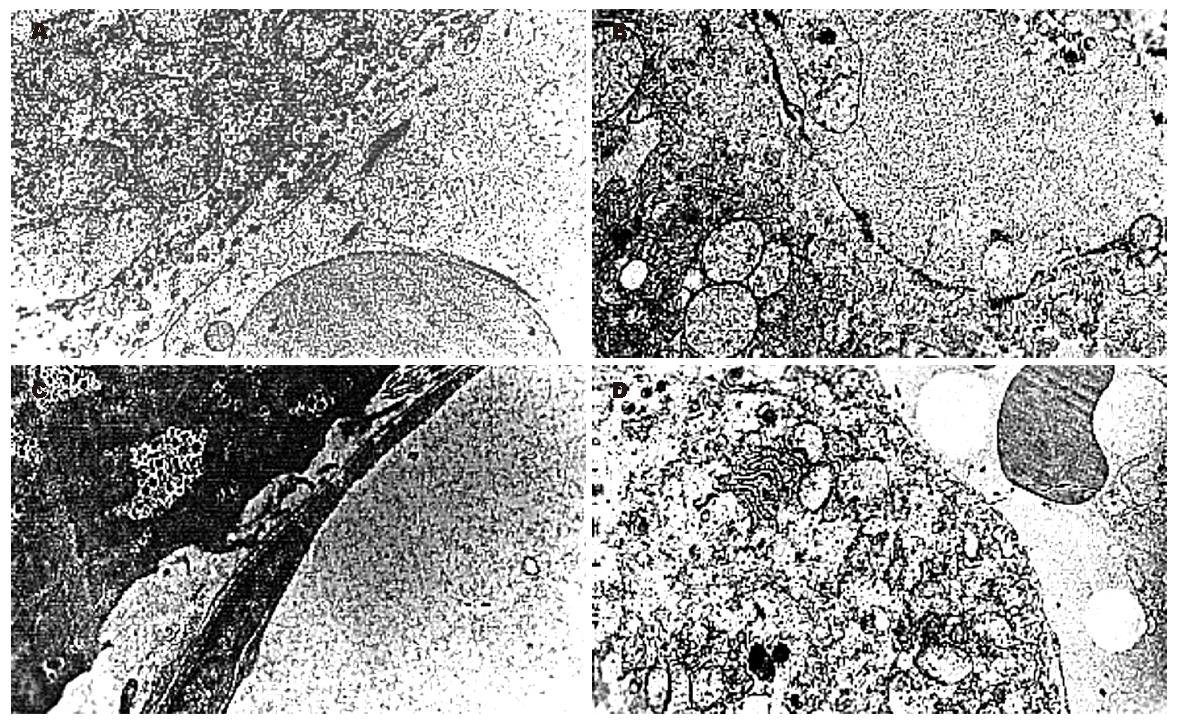
对照组的LSEC扁平, 胞核及细胞器排列规则, 远侧胞质呈薄片状, 有许多窗孔, 内皮下缺乏基底膜(BM)(图2A). 模型组2 wk末, 部分肝窦内皮细胞远侧胞质窗孔数减少, 内皮下尚未见基底膜形成; 4 wk末, 窗孔数减少或消失, 内皮下已开始有不完全的基底膜形成, 同时有功能活跃的纤维母细胞形成(图2B); 8 wk末进一步加重, 甚至可见完整的BM形成(图2C). 停止高脂饲料喂养12 wk末, 失窗孔及内皮下BM形成有所减轻, 内皮下基底膜成不连续状. 16 wk末, 失窗孔及内皮下BM形成明显减轻(图2D).
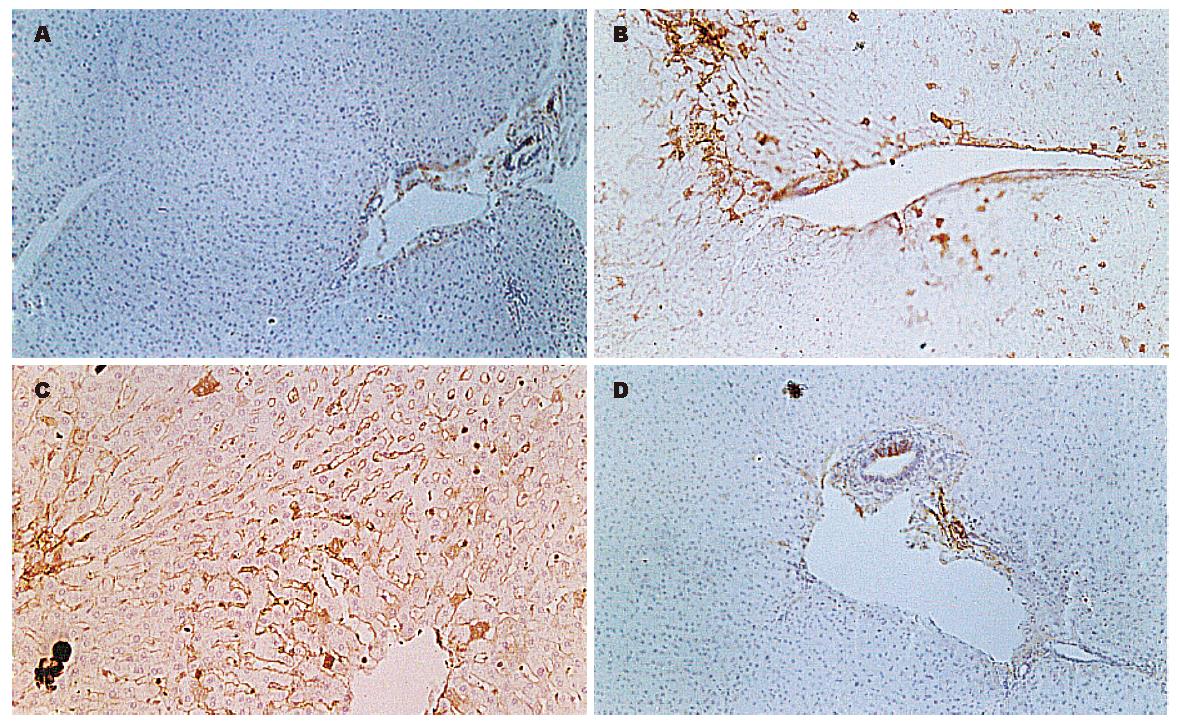
LN在正常家兔汇管区血管壁表达阳性, 肝窦壁没有层粘连蛋白表达(图3A), 以后随着肝纤维化程度的增加, 肝窦壁阳性着色增强而显著(图3B), 并沿肝窦呈连续着色. 8 wk末阳性最强(图3C), 停止造模后阳性逐渐减弱, 但至16 wk时仍强于正常组(图3D). 免疫组化病理图象分析结果见表1.
模型组2 wk末, 家兔血清HA含量开始增高, 至8 wk末时达到高峰(与对照组比较P<0.01), 停止造模后家兔血清透明质酸含量逐渐下降, 但停药8 wk时仍强于正常组(表1).
在肝纤维化的病理形成过程中, 绝大部分都经过脂肪肝的阶段, 因此研究脂肪肝的形成和脂肪肝时的病理、各种病理生理的改变, 对防止肝纤维化的发生与发展具有重要的意义[11-16]. 许多原因可引起脂肪肝, 其中长期和大量进食高脂肪、高胆固醇饮食为常见的原因. 我们用Buyssens的方法成功建立了实验性高胆固醇血症家兔脂肪肝伴小叶中心肝纤维化模型. 应用HE染色和VG苦味酸染色发现, 随造模时间的延长脂肪变性、点状坏死和炎性细胞浸润逐渐加重, 8 wk末炎性细胞侵润成团, 停药后逐渐好转; 纤维化的发生也有同样的趋势, 但停药后有所减轻并未迅速好转. 说明脂肪变性和炎性细胞浸润是一个急性过程, 较易恢复, 一旦发展到胶原的沉积, 恢复明显减慢. 该实验也再次提示重视脂肪肝的重要性[16-17].
SEC是特殊化的毛细血管内皮细胞, 在肝窦形成无隔膜、无BM的窗孔(fenestrae), 这种窗孔结构有利于肝细胞和血液之间进行物质的交换, 在维持肝脏结构和实现各种功能中起着非常重要的作用[18-21]. 各种原因导致的肝纤维化中均可见肝窦结构发生不同程度的改变, 即出现肝窦内皮细胞持续去窗孔和内皮下基底膜形成, 甚至形成肝窦毛细血管化. 肝窦毛细血管化是肝纤维化过程中的一个重要的病理改变, 肝窦内皮下基底膜形成是肝窦毛细血管化的一个重要特征[22]. 该实验中电镜下超微结构观察, 正常的SEC扁平, 胞核及细胞器排列规则, 远侧胞质呈薄片状, 有许多窗孔, 内皮下缺乏基底膜. 高胆固醇喂养2 wk末, 可见部分SEC远侧胞质窗孔数减少, 但无基底膜形成; 4 wk末, 窗孔数减少或消失, 内皮下已开始有不完全的基底膜形成, 同时有功能活跃的纤维母细胞形成; 8 wk末进一步加重, 甚至可见完整的基底膜形成; 停止高脂饲料8 wk末, 失窗孔及内皮下基底膜形成明显减轻. 结果提示在脂肪肝形成过程中就伴随着SEC的去窗孔化和基底膜的形成, 后者是肝纤维化形成的基础.
有研究表明, 一些物质可调节肝窦内皮细胞的窗孔和肝窦毛细血管化, 其中层粘连蛋白(laminin, LN)较最为重要[23-27]. LN为分子质量较大的糖蛋白, 能与Ⅳ型胶原、非胶原性糖及硫酸肝素等多种基质成分交联, 并能自身交联, 在基底膜形成过程中起重要作用. 据报道, LN在正常肝窦几乎不表达, 而在慢性肝炎碎片状坏死灶和肝硬变纤维间隔附近的肝窦明显表达, 肝硬化再生结节中的肝窦表达也增强[28]. 本实验中可见, 正常肝窦无LN分布; 随着造模时间的延长, 肝窦壁着色逐渐增强, 停止造模后逐渐减弱, 纤维化各期窦周LN着色阳性面积比差异有显著性(P<0.01). LN的变化与电镜下的基底膜变化相一致, 表明LN可作为肝窦毛细血管化基底膜形成的一个重要标志.
肝损伤过程中HA的浓度升高被认为与星状细胞合成和分泌增多, 以及SEC摄取和降解功能减退有关. 有学者认为他是反映SEC表型发生改变的标志[29]. 本实验过程中, 血清HA含量的变化与电镜下SEC去窗孔化的改变, 以及组织学中LN的变化相一致, 提示HA浓度的变化可能间接地反映肝窦毛细血管化的强弱. 我们观察到LN及HA在非酒精性脂肪肝家兔肝纤维化形成过程中的变化, 为非酒精性脂肪肝肝纤维化的发病机制提供了基础, 但LN如何诱导整合素的表达还有待深入研究.
肝窦毛细血管化是肝纤维化过程中一个重要的病理改变, 目前对肝窦毛细血管化在非酒精性脂肪肝肝纤维化中的形成过程尚少见报道. 肝窦内皮下基底膜的形成是肝纤维化过程中肝窦毛细血管化的一个重要特征, 而关于基底膜主要成分层粘连蛋白、以及反应肝窦内皮细胞功能的透明质酸含量在非酒精性脂肪肝肝纤维化过程中的动态变化尚缺乏系统的研究.
郝春秋, 副教授, 第四军医大学唐都医院传染科(全军感染病防治中心)
本文用高脂饲料诱发脂肪肝的方法建立家兔非酒精性肝病动物模型, 通过病理组织形态学观察、层粘连蛋白的免疫组化观察及血清透明质酸测定, 研究了非酒精性脂肪肝家兔在肝纤维化形成过程中肝窦壁基底膜成分的动态变化. 而有关层粘连蛋白如何诱导整合素的表达还有待深入研究.
家兔肝纤维化形成过程中, 肝窦壁功能性基底膜被破坏, 取而代之由于层粘连蛋白在肝组织中不断沉积, 并沿肝窦壁形成基底膜, 发生肝窦毛细血管化. 血清透明质酸含量的变化与电镜下肝窦内皮细胞去窗孔的改变, 以及层粘连蛋白的变化相一致, 提示层粘连蛋白及透明质酸在肝窦毛细血管化及肝纤维化的发病机制中有着重要的作用.
本研究为非酒精性脂肪肝肝纤维化的发病机制提供了基础. 对逆转肝纤维化有重要的临床意义.
肝窦毛细血管化: 各种原因导致的肝纤维化中可见肝窦结构发生不同程度的改变, 即出现肝窦内皮细胞持续去窗孔和内皮下基底膜形成.
本文实验设计合理, 内容新颖, 方法先进, 所得结果可靠, 图片资料可信, 文献引用得当, 讨论具体客观, 是一篇较好的论著.
编辑: 程剑侠 电编: 何基才
| 1. | Tamaki S, Ueno T, Torimura T, Sata M, Tanikawa K. Evaluation of hyaluronic acid binding ability of hepatic sinusoidal endothelial cells in rats with liver cirrhosis. Gastroenterology. 1996;111:1049-1057. [PubMed] [DOI] |
| 2. | Cogger VC, Warren A, Fraser R, Ngu M, McLean AJ, Le Couteur DG. Hepatic sinusoidal pseudocapillarization with aging in the non-human primate. Exp Gerontol. 2003;38:1101-1107. [PubMed] [DOI] |
| 3. | Xu GF, Wang XY, Ge GL, Li PT, Jia X, Tian DL, Jiang LD, Yang JX. Dynamic changes of capillarization and peri-sinusoid fibrosis in alcoholic liver diseases. World J Gastroenterol. 2004;10:238-243. [PubMed] |
| 4. | Xu B, Broome U, Uzunel M, Nava S, Ge X, Kumagai-Braesch M, Hultenby K, Christensson B, Ericzon BG, Holgersson J. Capillarization of hepatic sinusoid by liver endothelial cell-reactive autoantibodies in patients with cirrhosis and chronic hepatitis. Am J Pathol. 2003;163:1275-1289. [PubMed] [DOI] |
| 5. | Lu X, Liu P, Liu C, Xu G, Wang X, Chen W, Li F. [Role of hepatic sinusoidal endothelium injury in hepatic fibrogenesis induced by dimethylnitrosamine in rats]. Zhonghua Gan Zang Bing Za Zhi. 2002;10:441-444. [PubMed] |
| 6. | Franceschini B, Ceva-Grimaldi G, Russo C, Dioguardi N, Grizzi F. The complex functions of mast cells in chronic human liver diseases. Dig Dis Sci. 2006;51:2248-2256. [PubMed] [DOI] |
| 7. | Wang BY, Ju XH, Fu BY, Zhang J, Cao YX. Effects of ethanol on liver sinusoidal endothelial cells-fenestrae of rats. Hepatobiliary Pancreat Dis Int. 2005;4:422-426. [PubMed] |
| 8. | Maru Y, Hirosawa H, Shibuya M. An oncogenic form of the Flt-1 kinase has a tubulogenic potential in a sinusoidal endothelial cell line. Eur J Cell Biol. 2000;79:130-143. [PubMed] [DOI] |
| 9. | Neubauer K, Krüger M, Quondamatteo F, Knittel T, Saile B, Ramadori G. Transforming growth factor-beta1 stimulates the synthesis of basement membrane proteins laminin, collagen type IV and entactin in rat liver sinusoidal endothelial cells. J Hepatol. 1999;31:692-702. [PubMed] [DOI] |
| 10. | Buyssens N, Kockx MM, Herman AG, Lazou JM, Van den Berg K, Wisse E, Geerts A. Centrolobular liver fibrosis in the hypercholesterolemic rabbit. Hepatology. 1996;24:939-946. [PubMed] [DOI] |
| 11. | Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Dannenberg AJ. Dietary saturated fatty acids reverse inflammatory and fibrotic changes in rat liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:638-644. [PubMed] |
| 12. | Martinez-Hernandez A, Martinez J. The role of capillarization in hepatic failure: studies in carbon tetrachloride-induced cirrhosis. Hepatology. 1991;14:864-874. [PubMed] [DOI] |
| 13. | Festi D, Colecchia A, Sacco T, Bondi M, Roda E, Marchesini G. Hepatic steatosis in obese patients: clinical aspects and prognostic significance. Obes Rev. 2004;5:27-42. [PubMed] [DOI] |
| 14. | Lieber CS. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol. 2004;34:9-19. [PubMed] [DOI] |
| 15. | Saadeh S. Nonalcoholic Fatty liver disease and obesity. Nutr Clin Pract. 2007;22:1-10. [PubMed] [DOI] |
| 16. | Leclercq IA. Pathogenesis of steatohepatitis: insights from the study of animal models. Acta Gastroenterol Belg. 2007;70:25-31. [PubMed] |
| 17. | Day CP. Pathogenesis of steatohepatitis. Best Pract Res Clin Gastroenterol. 2002;16:663-678. [PubMed] [DOI] |
| 18. | Nakamura S, Muro H, Suzuki S, Sakaguchi T, Konno H, Baba S, Syed AS. Immunohistochemical studies on endothelial cell phenotype in hepatocellular carcinoma. Hepatology. 1997;26:407-415. [PubMed] [DOI] |
| 19. | Luna G, Paez J, Cardier JE. Expression of the hematopoietic stem cell antigen Sca-1 (LY-6A/E) in liver sinusoidal endothelial cells: possible function of Sca-1 in endothelial cells. Stem Cells Dev. 2004;13:528-535. [PubMed] [DOI] |
| 20. | Alonso CR, George J, Pesce CG, Bissell DM, Kornblihtt AR. Fibronectin transcription in liver cells: promoter occupation and function in sinusoidal endothelial cells and hepatocytes. Biochem Biophys Res Commun. 2002;295:1077-1084. [PubMed] [DOI] |
| 21. | Deaciuc IV, Bagby GJ, Niesman MR, Skrepnik N, Spitzer JJ. Modulation of hepatic sinusoidal endothelial cell function by Kupffer cells: an example of intercellular communication in the liver. Hepatology. 1994;19:464-470. [PubMed] [DOI] |
| 22. | Lu X, Liu P, Xu GF, Liu CH, Li FH, Liu C. [The role of hepatic sinusoid capillarization during the formation of portal hypertension in fibrotic rats induced by dimethylnitrosamine]. Zhonghua Gan Zang Bing Za Zhi. 2003;11:595-598. [PubMed] |
| 23. | Matsumoto S, Yamamoto K, Nagano T, Okamoto R, Ibuki N, Tagashira M, Tsuji T. Immunohistochemical study on phenotypical changes of hepatocytes in liver disease with reference to extracellular matrix composition. Liver. 1999;19:32-38. [PubMed] [DOI] |
| 24. | Yao L, Yao ZM, Yu T. Influence of BOL on hyaluronic acid, laminin and hyperplasia in hepatofibrotic rats. World J Gastroenterol. 2001;7:872-875. [PubMed] [DOI] |
| 25. | Drakes ML, Lu L, McKenna HJ, Thomson AW. The influence of collagen, fibronectin, and laminin on the maturation of dendritic cell progenitors propagated from normal or Flt3-ligand-treated mouse liver. Adv Exp Med Biol. 1997;417:115-120. [PubMed] [DOI] |
| 26. | Straub AC, Stolz DB, Ross MA, Hernández-Zavala A, Soucy NV, Klei LR, Barchowsky A. Arsenic stimulates sinusoidal endothelial cell capillarization and vessel remodeling in mouse liver. Hepatology. 2007;45:205-212. [PubMed] [DOI] |
| 27. | Leite AR, Corrêa-Giannella ML, Dagli ML, Fortes MA, Vegas VM, Giannella-Neto D. Fibronectin and laminin induce expression of islet cell markers in hepatic oval cells in culture. Cell Tissue Res. 2007;327:529-537. [PubMed] [DOI] |