修回日期: 2008-01-22
接受日期: 2008-01-15
在线出版日期: 2008-03-18
目的: 探讨丹参降门脉压作用是否与促进NOS表达有关.
方法: 制备丹参浸膏, 借助细胞免疫组化的方法观察丹参对一氧化氮合酶(NOS)iNOS和eNOS表达的影响.
结果: 丹参可促进活化的HSCs iNOS表达, 其棕色吸光度值增加, 同干预前相比有显著性差异(0.053±0.002 vs 0.034±0.001, P<0.05), 而eNOS表达无明显变化.
结论: 丹参可促进活化的HSCs iNOS表达.
引文著录: 姚冬梅, 房澍名, 杨川杰, 姚希贤. 丹参对肝星状细胞一氧化氮合酶表达的影响. 世界华人消化杂志 2008; 16(8): 819-822
Revised: January 22, 2008
Accepted: January 15, 2008
Published online: March 18, 2008
AIM: To investigate the effect of radix salviae miltiorrhizae (RSM) on the expression of nitric oxide synthase (NOS) in hepatic stellate cells (HSCs).
METHODS: RSM cream was prepared, and then we examined the effects of RSM on the expression of inducible NOS and endothelial NOS in HSCs by the immunocytochemistry.
RESULTS: In the activated HSCs, RSM increased the expression of inducible NOS, and the absorbency increased from 0.034 ± 0.001 to 0.053 ± 0.002 (P < 0.05). However, there were no significant changes in the expression of endothelial NOS.
CONCLUSION: RSM increased the expression of iNOS in the activated HSCs.
- Citation: Yao DM, Fang SM, Yang CJ, Yao XX. Effect of radix salviae miltiorrhizae on expression of nitric oxide synthase in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 819-822
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/819.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.819
近年来学者们对丹参(radix salviae miltiorrhizae, RSM)、丹参复方制剂及丹参有效成分在慢性肝病治疗中作用进行了深入研究, 已得到广泛共识, 并通过动物实验与临床研究证实了其抗肝纤维化的作用机制[1-3], 但目前尚缺乏其在肝硬化门脉高压治疗中的研究, 李校天通过胆总管结扎法, 制备犬肝硬变门脉高压模型, 表明丹参可降低肝硬变犬门静脉压力[4-5], 但其机制尚未完全阐明, 肝星状细胞(hepatic stellate cells, HSCs)收缩是介导肝硬化门脉高压的主要因素, 丹参降门脉压作用是否与促进HSCs一氧化氮合酶(nitric oxide synthase, NOS)表达有关, 目前尚无定论. 因此, 本课题通过采用细胞免疫组化的方法观察制备的丹参浸膏对HSCs一氧化氮合酶(nitric oxide synthase, NOS)-诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)表达的影响, 为进一步从细胞水平探讨丹参降门脉压作用的机制提供理论依据.
肝星状细胞株CFSC由美国Greenwel教授建株并惠赠, 其表型为活化的HSCs. 兔抗一氧化氮合酶2(iNOS)抗体购于武汉博士德生物工程公司, 兔抗一氧化氮合酶3(eNOS)抗体购于美国Santa Cruz公司, 兔SP试剂盒购于北京中山生物技术有限公司, 丹参购自石家庄市乐仁堂, 其他试剂均为进口或国产分析纯.
1.2.1 丹参浸膏提取: 丹参500 g, 加蒸馏水文火煮沸20 min, 取药液纱布过滤. 共2次, 将2次药液混合后以4000 r/min离心15 min, 取上清, 加950 mL/L乙醇至60%-80%体积, 0-4 ℃静置过夜. 弃沉淀, 取上清于旋转蒸发仪负压蒸馏, 蒸干乙醇和水分后即得丹参浸膏, 并稀成50 g生药/L备用.
1.2.2 细胞培养: 将冷冻保存于液氮中的HSCs复苏后接种于含100 mL/L胎牛血清、1×105 IU/L青霉素、1×105 µg/L链霉素、4 mmol/L L-谷氨酰胺及1 mol/L HEPES的10% RPMI 1640培养液(pH7.4)中, 37 ℃、50 mL/L CO2条件下培养. 当细胞呈单层致密状时, 用0.25%胰蛋白酶消化后以1:3传代, 24 h换液, 72 h再次传代.
每次实验均在呈指数生长的细胞中进行, 将2 cm×2 cm盖玻片预先放置在6孔培养板, 细胞消化后以1.0×107/L的密度接种2 mL制备爬片, 培养箱中孵育至细胞80%融合时, 弃培养液, 换不含胎牛血清的细胞培养液继续培养24 h, 使细胞基本同步化于G0期后进行实验.
1.2.3 细胞爬片制备: 细胞消化后以1.0×107/L的密度接种1.5 mL制备爬片, 培养箱中孵育至细胞90%融合时, 弃培养液, 换不含胎牛血清的细胞培养液继续培养24 h, 使细胞基本同步化于G0期后进行实验. 根据预试验结果, 丹参的干预浓度为4.22 g/L, 干预24 h后收集细胞爬片.
1.2.4 细胞免疫组化: 经冷PBS漂洗、120 g/L甲醇固定、冷PBST漂洗、1% Triton-X100修复, 暴露抗原、冷PBST冲洗、3%甲醇-过氧化氢封闭内源性过氧化物酶、蒸馏水漂洗、100 mL/L山羊血清封闭非特异性结合位点、加入一抗(iNOS浓度为1:200, eNOS浓度为1:100)、冷PBST漂洗、加入二抗(生物素化IgG)、漂洗、加入三抗(链霉卵白素标记的HRP)、漂洗、DAB显色、脱水封片等过程.
结果分析采用华东师范大学计算机图像分析系统免疫组织化学图像分析软件, 所取参数为阳性细胞计数比率和棕色吸光度值, 取200×高倍视野下NOS显色摄取图像, 用细胞计数软件作定量分析代表阳性细胞计数比率, 同时用同一视野测细胞吸光度代表免疫反应强度.
统计学处理 所有结果以mean±SD表示, 组间比较采用独立样本t检验, 应用SPSS10.0统计软件处理.
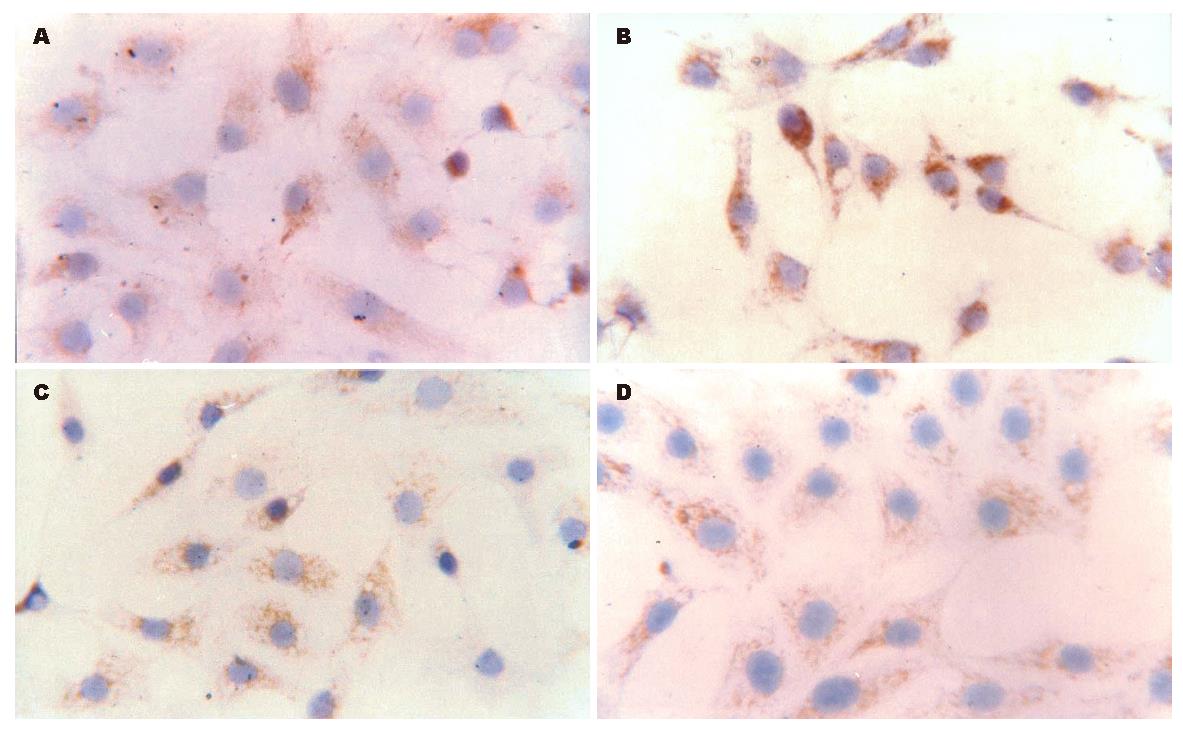
活化的HSCs胞质表达iNOS, 呈淡黄色, 经图像分析, 其阳性细胞数为84.62%±7.11%, 棕色吸光度值为0.034±0.001, 丹参干预后, 其阳性表达为棕黄色, 散在分布深棕黄色阳性细胞, 阳性细胞数为89.12%±11.01%, 同干预前相比无显著性差异, 而棕色吸光度为0.053±0.002, 同干预前相比有显著性差异(P<0.05, 表1, 图1A-B).
| 对照组 | 丹参 | |||
| 阳性细胞比率(%) | 吸光度 | 阳性细胞比率(%) | 吸光度 | |
| iNOS | 84.62±7.11 | 0.034±0.001 | 89.12±11.21 | 0.053±0.002a |
| eNOS | 91.06±7.22 | 0.023±0.005 | 89.73±4.12 | 0.028±0.002 |
丹参是目前临床应用较为广泛的主要活血化瘀药物, 以丹参为主药的系列中药组方抑肝纤、复方861合剂、扶正化瘀方、强肝胶囊以及"益肝浓缩煎剂"等已证实具有肯定的抗肝纤维化作用[1-3]. 但其在门脉高压治疗中的研究尚少, 李校天et al通过临床和动物实验研究表明, 丹参可改善肝硬化患者临床症状, 降低门静脉内径, 门静脉血流量, 同时降低肝硬化犬门静脉压, 而对平均动脉压、心率无影响[4-5]. 表明丹参既可有效降低肝硬化犬的门静脉压力, 又无全身血液动力学副作用, 为一有希望的降门脉压药物.
目前研究表明丹参对门脉高压的治疗机制可能与其减轻肝血窦阻力, 增加肝血流, 改善肝脏微循环等有关. 为了探讨丹参降门脉压力是否通过抑制HSC收缩而实现, 本研究从丹参对HSCs NOS表达进行了研究. 当前研究表明内皮素-1(endothelin-1, ET-1)与一氧化氮 (nitric oxide, NO)是调节HSCs舒缩、影响肝窦血流量及肝内阻力的主要因素[6-11]. 正常情况下, 肝窦内皮细胞(sinusoidal endothelial cell, SEC)合成、分泌NO及ET, 两者处于生理性平衡状态, 对调节肝脏微循环中发挥重要作用; 肝硬化时, SEC合成NO、ET-1减少[12-13], 但是活化的HSCs合成分泌NO、ET-1可能代偿性增加, 表明尽管硬化肝脏产生NO障碍, 但可通过代偿机制在一定程度上促使NO合成, 但ET-1、NO合成增加并不均衡, ET-1增加更为明显, 从而导致HSCs收缩性增加[12-18], 肝硬化时此种NO、ET-1生理平衡被破坏, 在肝硬化肝脏微循环障碍发生发展中具有重要意义. 因此, 通过药物促进NOS合成或拮抗ET-1作用可能对门脉高压治疗发挥作用. 本研究观察了丹参对HSCs NOS表达的影响, 结果表明, 活化的HSCs表达iNOS、eNOS两种NOS, 经丹参干预后, iNOS表达增强, 棕色吸光度同用药前相比有显著性差异, 而eNOS用药前后无明显变化, 表明丹参对HSCs的作用在一定程度上是由iNOS所诱导. 目前丹参对NOS表达的研究结论不一, 不同类型细胞作用有所不同, 有的表现为对NOS抑制[19-20], 有的为促进NOS合成[21-22], 丁惠国et al[23]观察到复方中药861可促进大鼠HSCs iNOS的表达, 本研究亦观察到复方861的君药-丹参可促进大鼠HSCs iNOS表达, 表明丹参亦可能直接作用于HSCs, 促使NO增加. 因此, 从机制上表明丹参介导门脉压力的下降至少在一定程度上是诱导iNOS的表达所致.
编辑: 程剑侠 电编: 何基才
| 2. | 王 晓玲, 刘 平, 童 普德, 谭 英姿, 钱 汝红, 胡 旭东, 蒋 文娟. 丹参对转化生长因子β1刺激的NIH/3T3细胞表达Ⅰ型胶原和c-fos mRNA的影响. 中西医结合肝病杂志. 2001;11:19-20. |
| 3. | 王 泰龄, 王 宝恩, 张 怀宏, 刘 霞, 段 钟平, 张 晶, 马 红, 李 新民, 李 宁章. 中药复方861对慢性肝炎肝纤维化治疗作用的病理研究. 胃肠病学和肝病学杂志. 1998;7:148-153. |
| 5. | Yao XX, Cui DL, Sun YF, Li XT. Clinical and experimental study of effect of Raondix Salviae Militiorrhiza and other blood-activating and stasis-eliminating Chinese herbs on hemodynamics of portal hypertension. World J Gastroenterol. 1998;4:439-442. [PubMed] [DOI] |
| 6. | Rockey DC. Hepatic blood flow regulation by stellate cells in normal and injured liver. Semin Liver Dis. 2001;21:337-349. [PubMed] [DOI] |
| 7. | Zhang JX, Pegoli W, Clemens MG. Endothelin-1 induces direct constriction of hepatic sinusoids. Am J Physiol. 1994;266:G624-G632. [PubMed] |
| 8. | Rockey DC, Weisiger RA. Endothelin induced contractility of stellate cells from normal and cirrhotic rat liver: implications for regulation of portal pressure and resistance. Hepatology. 1996;24:233-240. [PubMed] [DOI] |
| 9. | Kawada N, Tran-Thi TA, Klein H, Decker K. The contraction of hepatic stellate (Ito) cells stimulated with vasoactive substances. Possible involvement of endothelin 1 and nitric oxide in the regulation of the sinusoidal tonus. Eur J Biochem. 1993;213:815-823. [PubMed] [DOI] |
| 10. | Rockey DC, Chung JJ. Inducible nitric oxide synthase in rat hepatic lipocytes and the effect of nitric oxide on lipocyte contractility. J Clin Invest. 1995;95:1199-1206. [PubMed] [DOI] |
| 11. | Oda M, Han JY, Yokomori H. Local regulators of hepatic sinusoidal microcirculation: recent advances. Clin Hemorheol Microcirc. 2000;23:85-94. [PubMed] |
| 12. | Shah V, Haddad FG, Garcia-Cardena G, Frangos JA, Mennone A, Groszmann RJ, Sessa WC. Liver sinusoidal endothelial cells are responsible for nitric oxide modulation of resistance in the hepatic sinusoids. J Clin Invest. 1997;100:2923-2930. [PubMed] [DOI] |
| 13. | Sakamoto M, Uen T, Nakamura T, Hashimoto O, Sakata R, Kin M, Ogata R, Kawaguch T, Torimura T, Sata M. Estrogen upregulates nitric oxide synthase expression in cultured rat hepatic sinusoidal endothelial cells. J Hepatol. 2001;34:858-864. [PubMed] [DOI] |
| 14. | Fiorucci S, Antonelli E, Morelli O, Mencarelli A, Casini A, Mello T, Palazzetti B, Tallet D, del Soldato P, Morelli A. NCX-1000, a NO-releasing derivative of ursodeoxycholic acid, selectively delivers NO to the liver and protects against development of portal hypertension. Proc Natl Acad Sci USA. 2001;98:8897-8902. [PubMed] [DOI] |
| 15. | 姚 希贤, 姚 冬梅, 房 红梅, 杨 川杰, 张 晓岚, 刘 丽, 苏 素文, 王 川. 内皮素-1对活化肝星状细胞增殖及钙离子影响的调控机制研究. 中华消化杂志. 2004;24:659-662. |
| 16. | 姚 冬梅, 房 澍名, 杨 川杰, 修 贺明, 苏 素文, 姚 希贤. 丹参对内皮素-1介导的肝星状细胞Ca2 的影响机制. 世界华人消化杂志. 2006;14:2488-2492. [DOI] |
| 17. | Shah V, Cao S, Hendrickson H, Yao J, Katusic ZS. Regulation of hepatic eNOS by caveolin and calmodulin after bile duct ligation in rats. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1209-G1216. [PubMed] |
| 18. | Svegliati-Baroni G, Saccomanno S, van Goor H, Jansen P, Benedetti A, Moshage H. Involvement of reactive oxygen species and nitric oxide radicals in activation and proliferation of rat hepatic stellate cells. Liver. 2001;21:1-12. [PubMed] [DOI] |
| 19. | Luo WB, Wang YP. Magnesium lithospermate B inhibits hypoxia-induced calcium influx and nitric oxide release in endothelial cells. Acta Pharmacol Sin. 2001;22:1135-1142. [PubMed] |
| 21. | 谭 效锋, 田 菲. 活血保心冲剂对冠状动脉粥样硬化性心脏病心绞痛患者血一氧化氮及心血管调节肽的影响. 中国中西医结合急救杂志. 1999;6:56-58. |