修回日期: 2008-01-02
接受日期: 2008-01-15
在线出版日期: 2008-03-08
目的: 研究链激酶对大鼠肝脏缺血再灌注损伤的保护作用.
方法: 36只Wistar大鼠随机分成3组, 每组12只. 对照组大鼠肝脏经门脉10 mL乳酸林格液灌洗后, 低温4 ℃ UW液中保存24 h, 实验组大鼠肝脏经含链激酶7500 IU乳酸林格灌洗后, 分别低温或低温静脉持续氧气灌注保存24 h后, 离体常温再灌注45 min, 观察灌洗液谷氨酰胺丙氨酸转氨酶(alanine aminotransferase, ALT)、谷氨酸乳酸脱氢酶(glutamate-lactate dehydrogenase, GLDH)和嘌呤核苷磷酸化酶(purine nucleoside phosphorylase, PNP)活性及肝脏胆汁分泌量、肝组织5'核苷酸酶活性的变化.
结果: 实验组再灌注过程中灌洗液ALT、GLDH和PNP活性均明显降低于对照组(P<0.05或P<0.01); 胆汁分泌量增加[3.7±0.7 µL/(g·45 min), 9.1±0.7 µL/(g·45 min) vs 1.1±0.9 µL/(g·45 min), P<0.05, P<0.01); 5'核苷酸酶活性染色明显增强.
结论: 链激酶改善低温保存肝脏的微循环, 减轻缺血再灌注损伤.
引文著录: 宋少伟, 刘永锋, 梁健, 何三光. 链激酶对大鼠肝脏缺血再灌注损伤的保护作用. 世界华人消化杂志 2008; 16(7): 755-758
Revised: January 2, 2008
Accepted: January 15, 2008
Published online: March 8, 2008
AIM: To study the protective effect of strep-tokinase on rat liver ischemia reperfusion injury.
METHODS: Thirty-six Wistar rats were divided randomly into control group and 2 experiment groups (12 in each group). Livers from the control group were perfused with 10 mL Ringer's solution through the portal vein and stored at 4 ℃ for 24 h. Livers from the experiment group were perfused with Ringer's solution containing 7500 IU streptokinase with or without hypothermal oxygen stored at 4 ℃ for 24 h. All cold storage livers were followed by in vitro perfusion at 37 ℃ for 45 min, and stored at 4 ℃. Changes in ALT, GLDH, and activity of PNP, 5'nucleotidase and bile secretion were detected.
RESULTS: The activity of ALT, GLDH and PNP was significantly lower in the experiment groups than in the control group(P < 0.05). Bile secretion(3.7 ± 0.7 µL/g at 45 min, 9.1 ± 0.7 µL/g at 45 min vs 1.1 ± 0.9 µL/g at 45 min, P < 0.05) and 5'nucleotidase activity were significantly increased in the experiment groups compared with the control group.
CONCLUSION: Streptokinase can improve rat liver microcirculation and ischemia reperfusion injury.
- Citation: Song SW, Liu YF, Liang J, He SG. Protective effect of streptokinase on rat liver ischemia reperfusion injury. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 755-758
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/755.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.755
肝脏移植已被公认为是治疗终末期肝脏疾病的一种有效手段, 决定肝移植成功与否的一个重要因素就是肝脏移植物的活力[1], 缺血再灌注损伤是造成肝脏移植物原发无功能的主要原因, 如何保持低温保存肝脏的活性是防止缺血再灌注损伤的关键. 微循环障碍是组织细胞缺血再灌注损伤发生的重要机制, 改善微循环是防治缺血再灌注损伤综合措施中的重要环节. 链激酶可防止微血栓形成, 改善微循环, 本实验旨在探讨链激酶对大鼠肝脏缺血再灌注损伤的保护作用.
36只♂Wistar大鼠, 体质量为250-350 g, 随机分为对照组, 实验组1和实验组2, n = 12. 肌苷液、黄嘌呤氧化酶均购自Sigma公司. 比色分析采用日本岛津20分光光度计.
1.2.1 手术及灌注: 大鼠开腹后游离出胆总管并插管, 然后游离门静脉, 在其前壁剪一小口, 迅速插管原位灌注, 灌洗液分别为10 mL的林格液(对照组)和10 mL的林格液+链激酶7500 IU(实验组1和实验组2), 灌注高度为40 cm. 快速切取肝脏, 4 ℃保存于UW液, 其中实验组2在低温保存期间经肝下下腔静脉以18 mmHg的压力持续氧气灌入, 低温保存24 h后置于离体灌注装置中, 温度保持37 ℃, 200 mL Krebs-Henseleit液循环灌注45 min, 灌注的压力为1.96 kPa(20 cm H2O), 灌洗液中O2:CO2(95%:5%). 灌注0、15、30和45 min时, 从灌洗液中取样3 mL. 检测灌注液中谷氨酰胺丙氨酸转氨酶(alanine aminotransferase, ALT)和谷氨酸乳酸脱氢酶(glutamate-lactate dehydrogenase; GLDH)和嘌呤核苷磷酸化酶(purine nucleoside phosphorylase PNP)活性. 灌注结束时测量胆汁分泌量, 以µL/(g·45 min)表示. 在大鼠肝脏的左叶切取125 mm2大小的肝组织, -70 ℃液氮保存, 然后制成冰冻切片, 以备5'核苷酸酶活性的检测.
1.2.2 PNP活性检测: 取检测液0.1 mL, 与肌苷液0.1 mL、磷酸缓冲液2.5 mL(0.1 mol/L, pH7.4)、黄嘌呤氧化酶0.1 mL 37 ℃温箱孵育30 min, 3000 r/min, 离心15 min, 取上清液在分光光度计比色(λ = 293 nm).
1.2.3 5'核苷酸酶的测定具体方法: 将冰冻切片取出后, 37 ℃孵育箱中复温30 min. 同时制成180 g/L的聚乙烯乙醇Tris顺丁烯二酸缓冲液, 用氢氧化钠调至pH值为7.2后, 向培养基中加入7.2 mmol/L的硝酸铅(20 mL/L培养基)、10 mmol/L的氯化镁(10 mL/L培养基)和5 mmol/L的AMP(12.5 mL/L培养基), 混合均匀, 将复温后的冰冻切片取出, 在标本上滴入上述培养基, 然后放入37 ℃孵育箱中孵育15 min. 温水冲洗切片, 除去培养基. 再将切片浸泡于10 g/L硫化氨1 min后, 盖片固定[2].
统计学处理 所得数据均以mean±SD表示, 采用方差分析q检验. P<0.05为差异有统计学意义.
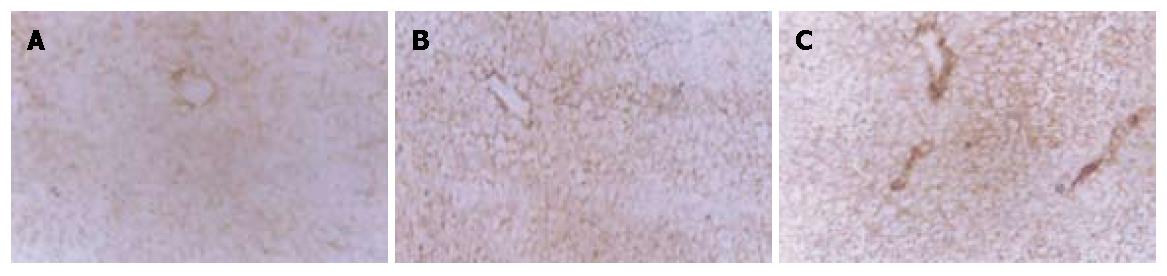
再灌注过程中实验组灌洗液中ALT、GLDH和PNP活性均明显低于对照组(P<0.05或P<0.01, 表1). 再灌注结束时, 对照组胆汁分泌量1.1±0.9 µL/(g·45 min), 明显低于实验组1[(3.7±0.7 µL/(g·45 min)](P<0.05)和实验组2[9.1±0.7 µL/(g·45 min)](P<0.01)实验组在门脉区出现5'-NT染色强度的轻度减弱; 而在对照组, 在胆小管和肝窦细胞区染色变得非常模糊, 在门脉区, 5'-NT的活性明显降低(图1).
| 再灌注 | ALT (U/L) | GLDH (U/L) | PNP[nmol/(min·mL)] | ||||||
| 对照组 | 实验组1 | 实验组2 | 对照组 | 实验组1 | 实验组2 | 对照组 | 实验组1 | 实验组2 | |
| 5 min | 62.7±5.6 | 24.8±2.9a | 13.2±1.9a | 8.9±0.9 | 4.1±0.6a | 2.6±0.4a | 32.2±1.7 | 26.4±2.3a | 16.9±2.0a |
| 15 min | 85.2±6.6 | 40.5±3.9a | 20.7±3.5b | 11.4±1.0 | 5.8±0.8a | 4.2±0.6b | 42.5±1.9 | 30.6±2.4b | 21.9±1.9a |
| 30 min | 104.3±6.9 | 53.2±4.4b | 32.0±3.9b | 14.8±1.0 | 8.4±1.0a | 6.1±0.7a | 52.1±3.1 | 35.2±3.0b | 28.2±2.4b |
| 45 min | 121.5±8.0 | 73.0±6.6a | 41.8±4.7b | 21.2±1.5 | 12.1±1.7a | 8.7±0.6b | 65.5±4.5 | 49.8±3.1b | 41.3±2.5b |
肝脏缺血再灌注损伤的机制尚未完全阐明, 近年来微血管损伤和微循环障碍在该损伤发生发展中的作用引起人们的重视, 微循环障碍及血液流变学改变在组织细胞缺血再灌注损伤中发挥重要作用. 肝脏低温保存后再灌注可发生微循环障碍, 而且是肝功能衰竭的主要原因. 微循环损伤包括红细胞集聚和微血栓形成, 目前不少研究关注肝脏微循环, 这些研究显示接触保存液后红细胞的可变性遭到了破坏, 这些红细胞能堵塞肝窦间隙从而破坏肝脏小管道影响微循环[3]. 由于微循环障碍灌注不足减少了组织细胞的氧和营养物质的供应, 从而引起组织一系列功能和代谢的紊乱, 如无氧酵解过程增强, 乳酸及脂肪酸等酸性代谢产物蓄积以及能量生成不足, 导致细胞结构受损, 细胞膜通透性增加可导致细胞水肿, 溶酶体膜通透性增加或破损引起的各种溶酶释放, 从而导致细胞的广泛溶解坏死; 肝移植后微循环的损伤将影响术后移植肝的功能恢复. 肝脏低温保存后再灌注时可发生白细胞黏附, 而且白细胞黏附是造成微循环及肝功能损害的重要因素, 再灌注后可使白细胞黏附聚集在局部并释放毒性介质, 导致内皮细胞的进一步损害, 这些积聚的白细胞和内皮细胞可阻塞肝窦, 同时引起血小板黏附血管内凝血及血栓形成, 实验发现微血栓在微循环中的形成也是影响肝脏微循环的因素[4], 加重微循环的损伤. 链激酶可以减少血小板的激活和微血栓, 减少肝窦内皮细胞凋亡的发生[5]. Yamauchi et al研究表明心脏停搏的供肝经链激酶灌注后, 可明显提高供体的质量[6-8]. 本研究发现低温保存前给予链激酶灌洗的实验组大鼠, 灌洗液中ALT和GLDH的含量明显降低, 说明肝脏功能得到明显改善. 胆汁分泌量是受微循环和肝细胞的数量影响的, 所以实验组胆汁分泌量增加也表明肝脏微循环障碍和肝实质细胞损害的程度减轻.
微循环的紊乱和肝窦"无复流"现象已经被大家认识到是缺血再灌注损伤的重要原因. 肝窦内皮细胞耐受缺氧的能力比肝细胞差, 而且已经有许多证据表明肝脏缺血再灌注后首先受到损伤的是内皮细胞, 然后才进一步损伤肝细胞. 肝窦内皮细胞损伤可致肝脏微循环障碍, 较实质细胞对移植肝脏功能的影响更具有意义. 由于肝窦内皮细胞完整性破坏和表面受体暴露导致微循环连续性和完整性破坏, 已经发现肝脏缺血再灌注损伤后, 内皮细胞表面黏附分子表达明显升高, 从而增加了中性粒细胞的聚集[9]. 缩血管因子的增加进一步影响了局部的血供, 从而导致肝脏局部的继续缺血坏死[10], 造成微循环障碍. PNP是一种位于肝窦内皮细胞和参与ATP降解的酶, 是肝窦内皮细胞损伤的指标之一[11]. 5'核苷酸酶活性的丢失是肝组织早期缺血损伤的指标, 位于胆小管和肝窦内皮细胞膜上, 随着冷缺血时间的延长, 降低, 并且分布的部位也发生改变. 本研究发现实验组PNP活性明显降低和5'核苷酸酶活性组化染色强于对照组, 表明链激酶可减轻冷保存过程中肝窦内皮细胞的损伤.
近年来关于使用机器灌注保存的研究获得了很大重视[12-14], 机器灌注保存与简单冷保存相比, 主要优点是能持续给肝细胞提供维持其基本功能的能量底物, 但使用机器灌注所需设备复杂繁多, 费用昂贵, 限制其在临床应用. 因此本实验采用简单的氧气持续灌注代替机器灌注. 经静脉系统氧气持续灌注是防止各种缺血实质性器官组织无氧损伤的有效办法. 研究表明这种保存策略可延长猪原位肝移植的生存率[15]. 在缺血低温保存过程中, 氧利于保持肝窦内皮细胞结构的完整, 持续氧灌注还可减少黏附因子-1的表达和MHCⅡ的表达, 从而减少白细胞的黏附, 改善微循环和防止排斥反应的发生[16]. 我们的研究表明链激酶灌洗和低温静脉系统氧气连续灌注这两种方法具有协同作用, 更加利于缺血再灌注损伤肝脏的功能恢复.
肝脏缺血再灌注损伤病理生理过程复杂, 迄今尚无明确认识, 故对其发生机制的研究已成为医学界关注的热点, 越来越多的研究表明缺血再灌注损伤是造成移植物原发无功能的原因之一, 其发生率为2%-23%, 甚至因此而被迫对患者进行再次移植. 近年来随着抗排斥反应药物的近展, 移植物排斥反应得到了有效的控制, 如何有效地减少移植物的缺血再灌注损伤, 目前成为移植界的主要难题之一.
房林, 副教授, 同济大学附属上海市第十人民医院普通外科
有研究报道心脏停搏的供肝经链激酶灌注后, 可明显提高供体的质量.
链激酶可减轻肝脏缺血再灌注损伤, 可应用于临床的肝脏保存.
本文设计简单, 结果明确, 对临床有一定的指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 2. | van Gulik TM, Nio CR, Frederiks WM, Klopper PJ, van der Heyde MN. An in vitro method for comparing the efficacy of two preservation solutions in one canine liver using the 5'-nucleotidase assay. Transpl Int. 1993;6:8-13. [PubMed] |
| 3. | Chmiel B, Cierpka L. Organ preservation solutions impair deformability of erythrocytes in vitro. Transplant Proc. 2003;35:2163-2164. [PubMed] [DOI] |
| 4. | Okajima K, Harada N, Kushimoto S, Uchiba M. Role of microthrombus formation in the development of ischemia/reperfusion-induced liver injury in rats. Thromb Haemost. 2002;88:473-480. [PubMed] [DOI] |
| 5. | Tolba RH, Yonezawa K, Song S, Burger C, Minor T. Synergistic value of fibrinolysis and hypothermic aerobic preservation with oxygen in the protection of livers from non-heart-beating donors: an experimental model. Transplant Proc. 2004;36:2927-2930. [PubMed] [DOI] |
| 6. | Yamauchi JI, Richter S, Vollmar B, Menger MD, Minor T. Warm preflush with streptokinase improves microvascular procurement and tissue integrity in liver graft retrieval from non-heart-beating donors. Transplantation. 2000;69:1780-1784. [PubMed] [DOI] |
| 7. | Yamauchi J, Schramm R, Richter S, Vollmar B, Menger MD, Minor T. Improvement of microvascular graft equilibration and preservation in non-heart-beating donors by warm preflush with streptokinase. Transplantation. 2003;75:449-453. [PubMed] [DOI] |
| 8. | Hachenberg A, Tolba RH, Akbar S, Minor T. Improvement of postpreservation viability of livers from non-heart-beating donors by fibrinolytic preflush with streptokinase upon graft retrieval. Transplant Proc. 2001;33:2525-2526. [PubMed] [DOI] |
| 9. | El-Wahsh M, Seifalian AM, Fuller BJ, Rolles K, Davidson BR. Induction of adhesion molecule expression in liver ischaemia-reperfusion injury is associated with impaired hepatic parenchymal microcirculation. Br J Surg. 2004;91:1034-1039. [PubMed] [DOI] |
| 10. | McCuskey RS. Morphological mechanisms for regulating blood flow through hepatic sinusoids. Liver. 2000;20:3-7. [PubMed] [DOI] |
| 12. | Lauschke H, Olschewski P, Tolba R, Schulz S, Minor T. Oxygenated machine perfusion mitigates surface antigen expression and improves preservation of predamaged donor livers. Cryobiology. 2003;46:53-60. [PubMed] [DOI] |
| 13. | Minor T, Sitzia M, Dombrowski F. Kidney transplantation from non-heart-beating donors after oxygenated low-flow machine perfusion preservation with histidine-tryptophan-ketoglutarate solution. Transpl Int. 2005;17:707-712. [PubMed] [DOI] |
| 14. | Lindell SL, Compagnon P, Mangino MJ, Southard JH. UW solution for hypothermic machine perfusion of warm ischemic kidneys. Transplantation. 2005;79:1358-1361. [PubMed] [DOI] |
| 15. | Minor T, Saad S, Nagelschmidt M, Kötting M, Fu Z, Paul A, Isselhard W. Successful transplantation of porcine livers after warm ischemic insult in situ and cold preservation including postconditioning with gaseous oxygen. Transplantation. 1998;65:1262-1264. [PubMed] [DOI] |