修回日期: 2008-01-15
接受日期: 2008-01-22
在线出版日期: 2008-03-08
目的: 基因重组技术构建重组质粒pEGFP-C1-ERβ并检测其在结肠癌细胞株Caco-2中的表达.
方法: 应用RT-PCR从人结肠癌手术患者正常切缘组织中分离、扩增目的基因片段, 将所得cDNA定向克隆到真核表达载体pEGFP-C1中, 采用双酶切和测序分析鉴定插入基因的序列; 脂质体介导重组质粒pEGFP-C1-ERβ瞬时转染Caco-2并上流式细胞仪分选, 获得比较单一的转染细胞; 分别采用RT-PCR、Western blot检测转染前后ERβ基因不同分子水平表达.
结果: 酶切鉴定和测序分析表明重组表达质粒pEGFP-C1-ERβ构建无误; RT-PCR和Western blot分析均表明, 与转染空质粒pEGFP-C1组和空白对照组细胞相比, 转染重组表达质粒pEGFP-C1-ERβ组细胞ERβ基因表达水平明显提高.
结论: 成功构建重组质粒pEGFP-C1-ERβ并在Caco-2细胞株中表达, 为进一步研究ERβ如何通过雌激素受体通路调控下游靶基因表达和参与结肠癌表遗传学发生机制奠定了基础.
引文著录: 翟荣林, 王国斌, 蔡开琳, 许飞, 田元. ERβ重组质粒的构建及其在结肠癌细胞株Caco-2中的表达. 世界华人消化杂志 2008; 16(7): 706-710
Revised: January 15, 2008
Accepted: January 22, 2008
Published online: March 8, 2008
AIM: To construct the recombinant plasmid pEGFP-C1-ERβ with gene recombinant technique and detect its expression in Caco-2 cells.
METHODS: ERβ gene in total RNA was isolated from human normal colon tissue of colorectal cancer patients and its segments were amplified by RT-PCR. The obtained cDNA was cloned into eukaryotic expression vector pEGFP-C1 to generate recombinant pEGFP-C1-ERβ. Sequence of the inserted gene was identified and analyzed after restriction enzyme digestion. Liposome-mediated recombinant plasmid pEGFP-C1-ERβ was transfected into Caco-2 cells and identified by flow cytometry (FCM). RT-PCR and Western blot were used to detect expression of the ERβ gene at molecular level before and after transfection.
RESULTS: Recombinant pEGFP-C1-ERβ was confirmed by restriction enzyme digestion and sequence analysis. The expression of Caco-2 cells transfected with pEGFP-C1-ERβ was higher than that of other controls.
CONCLUSION: Recombinant pEGFP-C1-ERβ can be successfully constructed and expressed in Caco-2 cells, which lays a foundation for further study on ERβ gene in carcinogenesis by regulating the expression of down stream target gene through estrogenic hormone receptor.
- Citation: Zhai RL, Wang GB, Cai KL, Xu F, Tian Y. Recombination of ERβ eukaryotic expression vector and its expression in Caco-2 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 706-710
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.706
大量流行病学和实验证据显示雌激素与结直肠癌发生密切相关[1-2]. Franceschi et al[3]研究表明绝经后的妇女罹患结直肠癌的风险较绝经前妇女高. Nanda et al[4]报道应用雌激素替代疗法可以降低绝经期妇女患结直肠癌的风险约30%-40%. 雌激素属于甾体类激素, 发挥生物学活性需要结合靶器官中雌激素受体(estrogen receptor, ER). ER分为α和β两个亚型, 在结肠黏膜组织中, 主要是ERβ表达, ERα不表达或很少表达[5]. 与正常结肠黏膜组织相比, 结直肠癌组织中ERβ表达显著降低, 作为一种防护因素, ERβ表达失活与结直肠癌发生密切相关[6]. 本研究拟通过基因重组技术克隆构建ERβ真核表达载体并转染结肠癌细胞株Caco-2, 以期重新恢复ERβ的表达, 探讨ERβ如何通过雌激素受体通路调控下游靶基因表达和参与结肠癌表遗传学发生机制.
空质粒pEGFP-C1购自上海吉凯公司, DMEM、胎牛血清、感受态细菌DH5a、LB培养基、限制性内切酶和T4 DNA连接酶均为Gibco公司产品, 脂质体Lipofectamine2000和DNA Ladder购自Invitrogen公司, 鼠抗人ERβ mAb购自武汉晶美生物, 结肠癌细胞株Caco-2由本室保存.
1.2.1 目的基因ERβ的扩增及纯化: 根据GenBank中人ERβ基因cDNA编码系列(Gene ID: BC024181), 设计2条PCR引物, 由上海生工生物工程技术服务有限公司合成, 并分别在上下游引物中引入XhoⅠ和SacⅡ限制性内切酶位点. 上游引物: 5'-CCG CTCGA GCT ATG GAT ATA AAA AAC TCA CCA TC-3', 下游引物: 5'-TCC CCG CGG TCG CAT TTC CCC TCA TCC-3'. 从人结肠癌手术患者正常切缘组织中提取总RNA, 并用上述引物通过RT-PCR法扩增得到目的基因cDNA片段, 使用琼脂糖凝胶回收试剂盒回收PCR产物.
1.2.2 重组质粒pEGFP-C1-ERβ的体外构建: 将PCR产物和空质粒pEGFP-C1用XhoⅠ和SacⅡ进行双酶切, 分别回收并纯化972 bp和4.7 kb的片段; 用T4 DNA连接酶将972 bp的目的基因片段连入线性化的pEGFP-C1中, 转化感受态大肠杆菌DH5a, 挑选单个阳性菌落接种于含卡那霉素的液体LB培养基中, 37 ℃振荡过夜, 以碱裂解法大量提取质粒. 用XhoⅠ和SacⅡ双酶切鉴定, 获得的阳性克隆命名为pEGFP-C1-ERβ, 取适量纯化的重组质粒样品送上海生工测序分析.
1.2.3 脂质体介导的pEGFP-C1-ERβ瞬时转染及流式分选: 结肠癌细胞株Caco-2体外常规培养并传代维持, 取状态良好的细胞以2×108/L接种于6孔板内. 待细胞80%融合时, 采用Lipofectamine2000介导分别转染pEGFP-C1-ERβ、pEGFP-C1到Caco-2细胞中. 实验共分三组, 转染重组质粒组(pEGFP-C1-ERβ组), 转染空质粒组(pEGFP-C1组), 同时设空白对照组, 只加入等量质脂体, 其余步骤同上, 每组设3复孔. 转染24、48和72 h后, 荧光显微镜下观察细胞内绿色荧光蛋白表达情况, 评价转染效率. 72 h后收集各组细胞行流式细胞仪分选转染和未转染的Caco-2细胞.
1.2.4 目的基因ERβ在Caco-2中的表达: 针对流式分选获得的各组Caco-2细胞, 每组取105个细胞, TRIzol一步法提取细胞总RNA, 并用先前设计的上下游引物, RT-PCR检测ERβ mRNA的表达. PCR扩增的条件为: 94 ℃变性5 min后, 按下述参数循环30次: 94 ℃变性60 s, 55 ℃退火45 s, 72 ℃延伸60 s; 最后72 ℃延伸5 min, 4 ℃保存. 15 g/L琼脂糖凝胶电泳分析各组PCR产物并拍照保存. 另每组取5×106个细胞, 加100 μL细胞裂解液和2 μL蛋白酶抑制剂, 提取细胞总蛋白. 取50 μg细胞总蛋白, 10 g/L SDS-PAGE电泳, 转PVDF膜, 1:200稀释的鼠抗人ERβ单抗, 碱性磷酸酶标记的兔抗鼠二抗, DAB显色, Western blot检测核内ERβ蛋白表达水平.
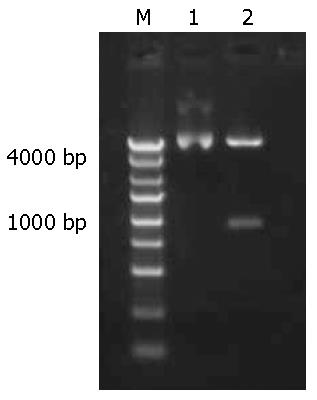
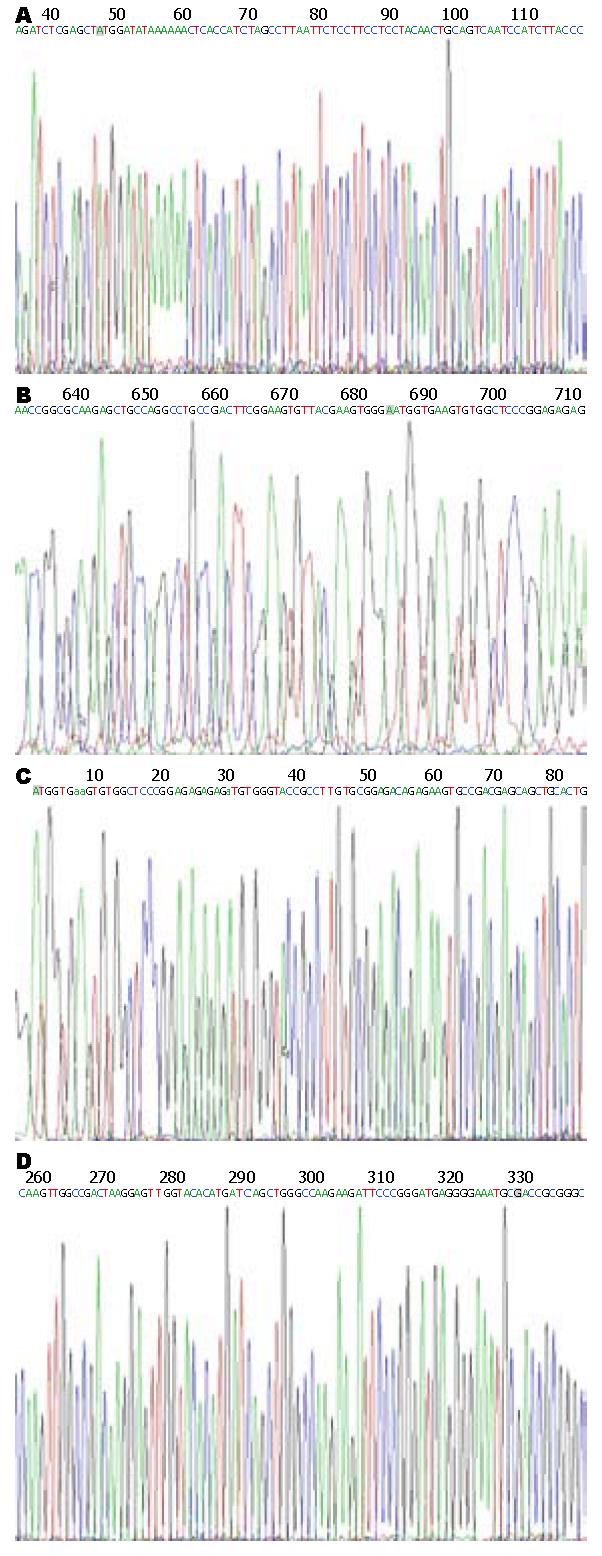
对构建的重组质粒pEGFP-C1-ERβ以及空质粒分别采用限制性内切酶Xho Ⅰ和Sac Ⅱ双酶切, 并行15 g/L琼脂糖凝胶电泳分析. 空质粒酶切后电泳显示为单一的5600 bp左右的条带; 而重组质粒双酶切后, 则可同时获得972 bp和4700 bp左右的2条片段, 其中前者为目的基因片段, 后者为空质粒片段, 说明空质粒pEGFP-C1中已插入ERβ基因片段, 且插入方向无误(图1). 选取经酶切鉴定正确的重组质粒进行核苷酸序列测定, 结果表明, 测序序列与GenBank中人ERβ基因原始序列完全相同, 重组质粒pEGFP-C1-ERβ构建成功(图2).
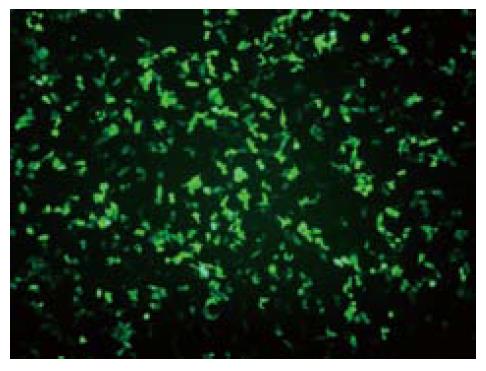
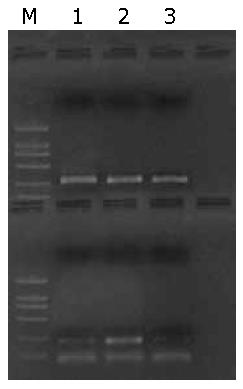
转染24 h后在荧光显微镜下观察可见, 除空白对照组外, pEGFP-C1-ERβ组与pEGFP-C1组细胞都能发出特异性的绿色荧光, 48 h后荧光明显加强, 72 h后通过粗略计数可以发现转染效率在33%左右(图3), 经流式分选后则为比较单一的转染细胞. RT-PCR分析表明, 只有pEGFP-C1-ERβ组样本在约1.0 kb处有一特异性扩增条带, 而pEGFP-C1组和空白对照组均未见明显的特异性扩增条带(图4). 这表明, 结肠癌细胞株Caco-2在导入重组质粒pEGFP-C1-ERβ后, 目的基因ERβ mRNA转录与其他组相比显著提高.
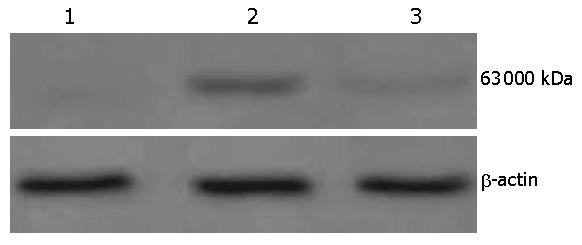
将空质粒pEGFP-C1及重组表达质粒pEGFP-C1-ERβ分别导入结肠癌细胞株Caco-2, 流式分选后收集各组细胞, 提取总蛋白进行SDS-PAGE, 用ERβ抗体进行Western blot检测. 结果表明, 转染重组表达质粒pEGFP-C1-ERβ组的Caco-2细胞表达了相对分子量约为63 000 kDa的ERβ蛋白, 与转染空质粒pEGFP-C1组以及空白对照组细胞相比, ERβ蛋白表达水平明显提高(图5).
Wada-Hiraike et al[7-8]研究均表明, ERβ在维持正常结肠上皮细胞生长以及结肠隐窝构造方面发挥重要作用, ERβ基因敲除后, 大鼠处于增殖状态的细胞数目明显增多, 细胞凋亡明显减少, 细胞从结肠隐窝基地部向肠腔表面迁徙的速率明显增快, 上皮细胞标志物CK20、层黏连蛋白以及半桥粒蛋白的表达均显著降低. 结肠正常黏膜细胞中只有ERβ表达[5], 因此, 雌激素替代治疗对降低绝经后的妇女患结肠癌的风险的效应, 应该是通过结肠黏膜中的唯一雌激素受体ERβ来介导的. 在雌激素存在时, 雌激素受体ERβ结合于靶基因启动子中的雌激素反应元件上, 对基因的转录发挥反式调控作用, 但其作用结果与ERα不同, 更倾向抑制细胞增殖, 促进分化[9], 这可解释雌激素促进乳腺等其他一些以ERα为主的靶器官发生肿瘤, 而对结肠肿瘤发生的保护和抑制作用, 也与ERβ基因表达与结肠恶变进展的负相关现象相符合[6].
女性结肠癌患者肿瘤组织与正常组织相比, ERβ表达水平明显降低, 与男性患者相比, ERβ1 mRNA表达水平也显著降低[10]. 这意味着ERβ对女性群体来说是一种保护因素, 一旦其表达降低, 保护作用消失, 罹患结肠癌的风险就明显增加. Xie et al[11]和Foley et al[12]的研究都发现, 结直肠癌组织与相应的正常结肠组织相比, ERβ蛋白水平显著降低, 而在mRNA水平上两者的表达并没有显著的不同, ERβ表达失活促进结肠上皮细胞的恶性转化可能是基于某种转录后的机制. 前列腺癌和乳腺癌的研究也表明, ERβ在癌组织中的表达水平显著降低, 并且这种降低与肿瘤细胞恶性程度呈明显的负相关[13-14]. 越来越多的证据提示, ERβ基因可能是作为一个抑癌基因发挥重要作用[15]. 目前, 通过外源导入ERβ来研究其相关功能的研究已有报道[16], 不过因为ERβ基因发现较晚, 类似的报道并不多. 本研究特别把ERβ表达水平较低的Caco-2细胞株作为研究对象, 通过构建并转染ERβ真核表达载体, 来重新恢复ERβ在Caco-2中的正常表达. 结果表明, ERβ基因核酸序列插入正确, 重组载体导入Caco-2后ERβ基因表达水平明显增高, 为进一步研究ERβ基因通过雌激素受体通路如何调控下游靶基因的表达以及如何参与结直肠癌表遗传学发生机制奠定了基础.
大量流行病学和实验证据显示雌激素与结直肠癌发生密切相关, 应用雌激素替代疗法(ERT)可以显著降低绝经期妇女患结直肠癌的风险.
姚登福, 教授, 南通大学附属医院分子医学中心
ERβ基因作为结肠黏膜细胞中的优势受体, 其表达失活与结肠癌发生密切相关. 最新的研究则提示, ERβ基因很可能是作为一个抑癌基因发挥重要作用.
Klinge et al研究指出, 雌激素存在时, ERβ结合于靶基因启动子中的雌激素反应元件(ERE)上, 对基因的转录发挥反式调控作用, 但其作用结果与ERα不同, 更倾向抑制细胞增殖, 促进分化.
本文采用基因重组技术体外构建ERβ真核表达质粒, 并在脂质体的介导下转染进入结肠癌细胞株Caco-2, 以期恢复ERβ基因在结肠癌细胞中的正常表达水平和功能.
本文为深入了解ERβ基因在结直肠癌发生中的作用以及ERβ基因对雌激素受体通路靶基因的调控方式奠定了基础.
本文研究设计合理, 条理分明, 结论明确, 反映了我国胃肠病学基础研究的水平.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Grodstein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorectal cancer: a review and meta-analysis. Am J Med. 1999;106:574-582. [PubMed] [DOI] |
| 2. | Crandall CJ. Estrogen replacement therapy and colon cancer: a clinical review. J Womens Health Gend Based Med. 1999;8:1155-1166. [PubMed] [DOI] |
| 3. | Franceschi S, Gallus S, Talamini R, Tavani A, Negri E, La Vecchia C. Menopause and colorectal cancer. Br J Cancer. 2000;82:1860-1862. [PubMed] [DOI] |
| 4. | Nanda K, Bastian LA, Hasselblad V, Simel DL. Hormone replacement therapy and the risk of colorectal cancer: a meta-analysis. Obstet Gynecol. 1999;93:880-888. [PubMed] [DOI] |
| 5. | Takeyama J, Suzuki T, Inoue S, Kaneko C, Nagura H, Harada N, Sasano H. Expression and cellular localization of estrogen receptors alpha and beta in the human fetus. J Clin Endocrinol Metab. 2001;86:2258-2262. [PubMed] |
| 6. | Konstantinopoulos PA, Kominea A, Vandoros G, Sykiotis GP, Andricopoulos P, Varakis I, Sotiropoulou-Bonikou G, Papavassiliou AG. Oestrogen receptor beta (ERbeta) is abundantly expressed in normal colonic mucosa, but declines in colon adenocarcinoma paralleling the tumour's dedifferentiation. Eur J Cancer. 2003;39:1251-1258. [PubMed] [DOI] |
| 7. | Wada-Hiraike O, Warner M, Gustafsson JA. New developments in oestrogen signalling in colonic epithelium. Biochem Soc Trans. 2006;34:1114-1116. [PubMed] [DOI] |
| 8. | Wada-Hiraike O, Imamov O, Hiraike H, Hultenby K, Schwend T, Omoto Y, Warner M, Gustafsson JA. Role of estrogen receptor beta in colonic epithelium. Proc Natl Acad Sci USA. 2006;103:2959-2964. [PubMed] [DOI] |
| 9. | Klinge CM. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 2001;29:2905-2919. [PubMed] [DOI] |
| 10. | Campbell-Thompson M, Lynch IJ, Bhardwaj B. Expression of estrogen receptor (ER) subtypes and ERbeta isoforms in colon cancer. Cancer Res. 2001;61:632-640. [PubMed] |
| 11. | Xie LQ, Yu JP, Luo HS. Expression of estrogen receptor beta in human colorectal cancer. World J Gastroenterol. 2004;10:214-217. [PubMed] |
| 12. | Foley EF, Jazaeri AA, Shupnik MA, Jazaeri O, Rice LW. Selective loss of estrogen receptor beta in malignant human colon. Cancer Res. 2000;60:245-248. [PubMed] |
| 13. | Leav I, Lau KM, Adams JY, McNeal JE, Taplin ME, Wang J, Singh H, Ho SM. Comparative studies of the estrogen receptors beta and alpha and the androgen receptor in normal human prostate glands, dysplasia, and in primary and metastatic carcinoma. Am J Pathol. 2001;159:79-92. [PubMed] [DOI] |
| 14. | Zhao C, Lam EW, Sunters A, Enmark E, De Bella MT, Coombes RC, Gustafsson JA, Dahlman-Wright K. Expression of estrogen receptor beta isoforms in normal breast epithelial cells and breast cancer: regulation by methylation. Oncogene. 2003;22:7600-7606. [PubMed] [DOI] |
| 15. | Bardin A, Boulle N, Lazennec G, Vignon F, Pujol P. Loss of ERbeta expression as a common step in estrogen-dependent tumor progression. Endocr Relat Cancer. 2004;11:537-551. [PubMed] [DOI] |