修回日期: 2007-04-22
接受日期: 2007-06-15
在线出版日期: 2008-02-28
目的: 探讨兔肝VX2瘤活体二维多体素1H-MRS (2D 1H-MRS)最佳成像技术.
方法: 经腹腔瘤块种植法行肝内VX2瘤种植成功的新西兰大白兔8只, 2-4 wk内采用1.5 T磁共振仪行常规MRI平扫及活体2D 1H-MRS检查. 采用膝关节线圈, 在其他参数不变的条件下分别用不同的TR、TE和NEX进行活体2D 1H-MRS扫描, 观察2D 1H-MRS谱图, 以波谱图基线情况和信噪比为指标进行统计学分析.
结果: 在成功获得的可析性2D 1H-MRS谱图上最多可看到6个主要的代谢物波峰: 脂质的甲基峰(Lip1)、脂质的亚甲基峰(Lip2)、含双碳键的脂质亚甲基峰(Lip3), 谷氨酰胺和谷氨酸复合物(Glx), 胆碱化合物(Cho), 糖原和葡萄糖复合物(Glyu). TR逐渐延长(1000 ms、2000 ms、3000 ms)基线情况和信噪比无显著性差异. TE = 30 ms与TE = 144 ms的基线情况未见明显差异, 除了Glx的信噪比在TE = 30 ms时稍高(1.95±0.36 vs 1.24±0.26, P<0.05)以外, 其他几种代谢物的信噪比在不同TE无显著性差异. 激励次数(number of excitation, NEX)增大(4次、8次、16次), 谱图基线差别较大(χ2 = 10.000, P<0.01), 主要代谢物信噪比均随着NEX的增大而增大. NEX = 16次时基线最平稳, 信噪比最高.
结论: 利用1.5 T磁共振仪进行兔肝VX2瘤活体2D 1H-MRS检查可行, 为肝脏2D 1H-MRS的临床应用提供了基础. 通过加强制动、预扫描使匀场和抑水效果达到水峰FWHM≤10Hz, WS≥98%、使用膝关节线圈、选择TR = 1000 ms、TE = 30 ms和较大的NEX(16次)等有利于成功获得较高质量的可析性波谱图.
引文著录: 颜荣华, 肖恩华, 梁斌. 兔肝VX2瘤活体二维多体素1H-MRS的成像技术. 世界华人消化杂志 2008; 16(6): 613-620
Revised: April 22, 2007
Accepted: June 15, 2007
Published online: February 28, 2008
AIM: To investigate the best techniques of in vivo two-dimension multi-voxel 1H magnetic resonance spectroscopy (2D 1H-MRS) for rabbit liver VX2 tumor.
METHODS: The liver of 8 New Zealand white rabbits was implanted directly and respectively with VX2 tumor lump after abdominal cavity was opened. 2D 1H-MRS acquisition in vivo and unenhanced MRI was performed respectively from the 2nd week to 4th week after VX2 tumor was implanted. With knee coil, in vivo 2D 1H-MRS acquisitions were performed respectively with different TR, different TE and different NEX at 1.5 T MR scanner when other parameters were the same. The distinction between groups was analyzed by SPSS11.0 with baseline and signal-noise ratio (SNR).
RESULTS: From the qualified MRS spectrum, there were up to 6 peaks which could be identified: methyl lipids (Lip1), methylene lipids (Lip2), methylene lipids with double carbon bond (Lip3), glutamine and glutamate complex (Glx), Choline (Cho), and glycogen and glucose complex (Glyu). Baseline and SNR had no significant differences between TR = 1000 ms, 2000 ms and 3000 ms. Baseline had no significant difference between TE = 30 ms and 144 ms. Except that SNR of Glx with 30 ms in TE was higher than that with 144 ms in TE (1.95 ± 0.36 vs 1.24 ± 0.26, P < 0.05), SNR of other metabolites were similar. With NEX increasing, the distinctions of baseline between NEX = 4, 8 and 16 were significant (χ2 = 10.000, P < 0.01). SNR of all metabolites increased when NEX was increased gradually. Both of baseline and SNR were the best when NEX was 16.
CONCLUSION: It's practical of in vivo two-dimension multi-voxel 1H-MRS on the rabbit liver VX2 tumor by a 1.5 T MR scanner. Immobilization, pre-scan (reaching FWHM ≤ 10 Hz and WS ≥ 98%), knee coil, TR = 1000 ms, TE = 30 ms and NEX = 16 may be the best to acquire highly qualified spectra.
- Citation: Yan RH, Xiao EH, Liang B. Technology of in vivo two-dimension multi-voxel 1H magnetic resonance spectroscopy for rabbit liver VX2 tumor. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 613-620
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/613.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.613
近年来国内外对肝脏活体1H-MRS的研究逐渐增多, 但还远不及脑部和前列腺等器官, 尚处于实验阶段, 且多局限于肝脏弥漫性病变[1-5]. 肝癌的磁共振研究以常规MRI研究为主[6-7], 1H-MRS的研究很少, 尤其是针对肝肿瘤活体二维多体素1H-MRS的检查技术, 国内外尚缺乏系统性研究. 我们以兔肝VX2瘤为实验对象, 对活体二维多体素1H-MRS(in vivo two-dimension multi-voxel 1H magnetic resonance spectroscopy, 2D 1H-MRS)有关扫描技术手段和参数的优选进行探讨, 以期为该技术的临床应用奠定基础.
健康的新西兰大白兔8只, 5-6 mo, 体质量1.7-2.2 kg/只, 雌雄不限(由中南大学湘雅二医院动物实验中心提供). VX2瘤株为VX2鳞状细胞癌(由第四军医大学友情提供), 均采用经腹腔瘤块种植法成功建立兔肝VX2瘤移植模型. 种植后2-4 wk内对所有荷瘤兔进行常规MRI及2D 1H-MRS检查, 所用机器为美国GE公司的1.5 T Signa Twin Speed磁共振仪. 所有荷瘤兔采用30 g/L戊巴比妥钠耳缘静脉麻醉, 并留置针头, 在扫描过程中不断添加少量戊巴比妥钠以持续保持兔深度麻醉状态. 常规行快速扰相梯度回波序列(FSPGR)T1WI和快速反转快速自旋回波脉冲序列(FRFSE)FRFSE T2WI横断面扫描, 人膝关节线圈, 扫描参数如下: FSPGR T1WI: TR = 400 ms, TE = Minful, 矩阵256×192, FOV = 20 cm×20 cm, 层厚5 mm, 间距0 mm, 激励次数(number of excitation, NEX) = 4次, 扫描时间5'12"; FRFSE T2WI: TR = 3000 ms, TE = 80 ms, 矩阵320×256, FOV = 20 cm×20 cm, 层厚5 mm, 间距0 mm, NEX = 4, 扫描时间3'18".
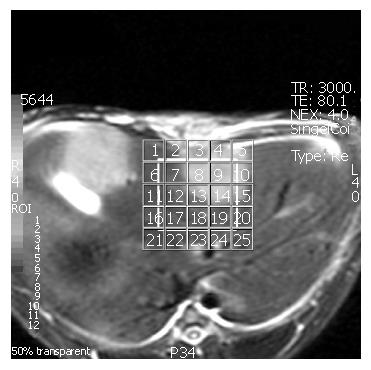
2D 1H-MRS预实验显示用人膝关节线圈+兔躯干周围紧密填塞随机器附带的填塞垫, 可达到对动物固定和腹部加压制动的效果; 预扫描匀场和抑水的效果达到水峰的半高宽(full width at half max, FWHM)≤10 Hz, 抑水率(water suppression, WS)≥98%时才获得较稳定的波谱. 正式试验检测不同的TR, 不同的TE, 不同的NEX对2D 1H-MRS的影响. 8只兔分别用不同的TR: 1000 ms, 2000 ms和3000 ms, 而其他参数相同(表1)条件下进行2D 1H-MRS扫描, 频率方向: A/P, 自动中心频率: 水, 自动水抑制优化. 8只兔分别用不同的TE: 30 ms和144 ms, 而其他参数相同条件下进行2D 1H-MRS扫描(表1). 8只兔分别用不同的NEX: 4次、8次和16次, 而其他参数相同条件下进行2D 1H-MRS扫描(表1). 感兴趣区(voxel of interest, VOI): 以T2WI为波谱解剖定位图, VOI范围包括肿瘤中心部分、肿瘤周围部分及瘤周正常肝组织. 同一个肿瘤每次扫描尽量选取大小、位置相同的VOI, 尽量避开大的胆管和血管, 远离膈肌、皮下脂肪和肠管(图1). 预扫描: 在每次扫描前, 均采用机器自动预扫描进行匀场和抑水, 达到FWHM≤10 Hz, WS≥98%时才进行正式的波谱采集.
| 线圈 | 序列 | TR(ms) | TE(ms) | NEX | FOV(cm) | 相位矩阵 | 层厚(mm) | 扫描时间 | |
| TR: | 膝关节 | STEAM | 1000 | 30 | 8 | 10×10 | 10×10 | 10 | 13'28" |
| 膝关节 | STEAM | 2000 | 30 | 8 | 10×10 | 10×10 | 10 | 26'56" | |
| 膝关节 | STEAM | 3000 | 30 | 8 | 10×10 | 10×10 | 10 | 40'24" | |
| TE: | 膝关节 | STEAM | 1000 | 30 | 8 | 10×10 | 10×10 | 10 | 13'28" |
| 膝关节 | STEAM | 1000 | 144 | 8 | 10×10 | 10×10 | 10 | 13'28" | |
| NEX: | 膝关节 | STEAM | 1000 | 30 | 4 | 10×10 | 10×10 | 10 | 6'44" |
| 膝关节 | STEAM | 1000 | 30 | 8 | 10×10 | 10×10 | 10 | 13'28" | |
| 膝关节 | STEAM | 1000 | 30 | 16 | 10×10 | 10×10 | 10 | 26'48" |
MRS采集所得的数据经机器自带的分析软件FuncTool 2处理, 可同时获得四种图形, 即化学位移图、波谱图、代谢图和以T2WI作为解剖图的代谢与解剖叠加图(简称代-解图). 观察不同参数扫描所获得的波谱图, 观察指标包括基线情况和代谢物波峰的信噪比(signal-to-noise ratio, SNR). 基线: 越平稳的基线代表波峰分析越可靠[8]. 根据波谱图基线是否平稳、主要波峰是否可辨认及背景噪声对主要波峰的影响大小等综合判断, 将所得MRS波谱图的基线分为4个等级: 0级-基线光滑平稳, 代谢物波峰显示清晰, 靠近水峰和脂质(Lipids)峰处代谢物波峰无明显增宽、畸变, 主要代谢物波峰无明显重叠. 1级-基线轻度失稳, 但主要代谢物波峰可清晰辨认, 靠近水峰或脂质峰处基线上抬、代谢物波峰轻度增宽, 主要代谢物波峰稍有重叠, 重叠部分小于波峰的1/2. 2级-基线不稳, 包括脂质峰在内的波峰增宽, 共振峰移位或畸变, 相邻波峰重叠部分接近或大于波峰的1/2. 3级-基线严重变形, 波谱图杂乱无章, 代谢物波峰不可辨认. 波谱图经由两位放射学医师盲法观察并分别评价. 对于基线评价为2和3级的谱图由于其代谢物波峰明显失真, 难以明确界定, 不能用于下一步的分析[9-10], 只有基线为0和1级的谱图才被视为成功的可析性波谱, 能被用于下一步指标的测量. SNR是代谢物平均信号值与背景噪声标准差的比值, 通过机器自带的分析软件FuncTool 2测得. 具体方法是以0.49-0.70 ppm范围为无代谢物空白区, 测量每个体素内各个主要代谢物信号与无代谢物处背景噪声的比值. 以VOI内所有体素SNR的平均值作为该次扫描的SNR值.
统计学处理 采用SPSS11.0对所有数据进行统计学处理. 不同参数组MRS谱图的基线等级进行Friedman M检验. 不同参数组各代谢物的SNR首先进行正态性检验和方差齐性检验, 若符合条件则进行单因素方差分析(One-way ANOVA)和LSD-t检验或两独立样本t检验. 若不符合条件, 则采用Kruskal-Wallis H检验和Wilcoxon秩和检验. P<0.05为差异有显著性意义, P<0.01为差异有极显著性意义.
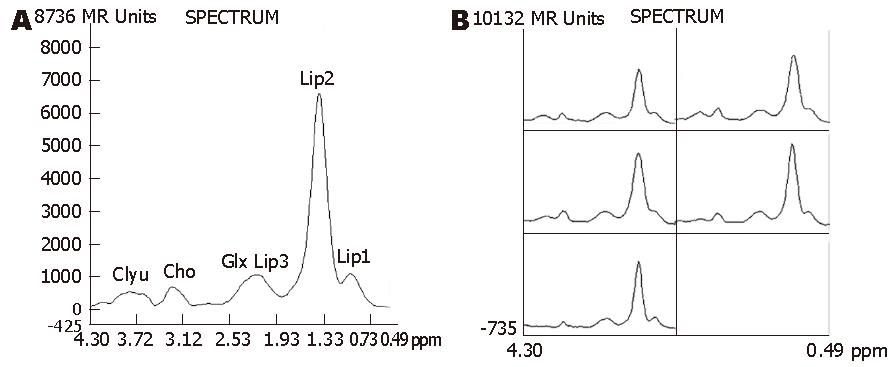
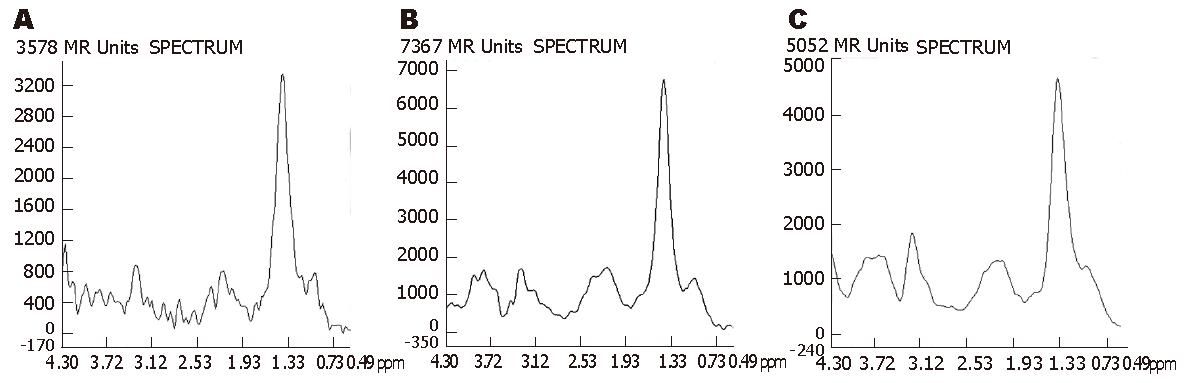
在成功获得的可析性2D 1H-MRS谱图上(取值范围0.49-4.30 ppm)最多可看到6个主要的代谢物波峰, 其化学位移分别为: 脂质(Lipids)的3个峰, 包括甲基峰(Lip1), 位于0.8-1.1 ppm亚甲基峰(Lip2), 位于1.1-1.5 ppm和含双碳键的亚甲基峰(Lip3), 位于1.9-2.3 ppm谷氨酰胺和谷氨酸复合物(glutamine and glutamate complex, Glu+Gln, Glx), 位于2.10-2.49 ppm胆碱化合物(Choline, Cho), 位于3.1-3.3 ppm糖原和葡萄糖复合物(glycogen and glucose complex, Glyu), 位于3.35 ppm-3.90 ppm[1,11-14]. 其中Lip2是波谱图上最高最明显的共振峰, Lip1峰常常与其紧密相连, 无明显分界, 有时仅表现为Lip2右侧一浅的"顿挫", 而无独立的波峰, 测量时将Lip(1+2)作为一个联合峰共同测量, 简称为Lip. Lip3也与Glx峰两者相互重叠、融合, 分界不明显, 表现为圆钝的波峰, 有时顶端可见一小的"切迹", 无尖锐的峰尖. 成功的波谱图上Cho峰和Glyu基本独立(图2).
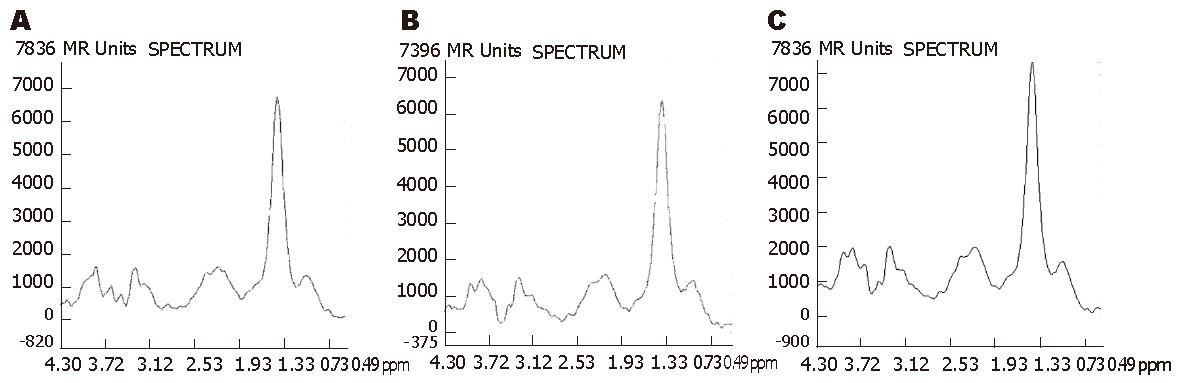
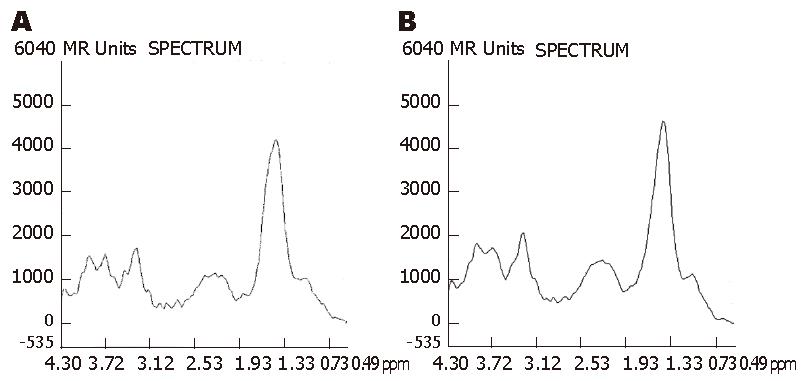
在其他参数相同的情况下, TR = 3000 ms和TR = 2000 ms的扫描时间分别是TR = 1000 ms时的3倍和2倍, 但3者基线情况无显著性差异(χ2 = 3.429, P = 0.180, 表2). 虽然TR = 3000 ms时, Lip, Glx, Cho和Glyu的SNR值均比TR = 1000 ms和2000 ms时要稍高, 但均没有统计学意义(P>0.05, 表3, 图3). 在其他参数相同的情况下, TE=30 ms和144 ms的基线情况无明显差别(χ2 = 0.200, P = 0.655, 表2). 除了Glx的信噪比在TE = 30 ms时高于TE = 144 ms(P<0.05)以外, 其他几种代谢物的信噪比无显著性差异(表4, 图4). 两者扫描时间相同. 在其他参数相同的情况下, 随着NEX的增大, 谱图基线情况明显改善(χ2 = 10.000, P = 0.007, 表2), 波峰的可分辨程度提高. 主要代谢物的SNR值也随着NEX的增大而明显增大(P<0.01). NEX = 16次时所获得的波谱基线及SNR均明显优于NEX = 4次和8次(表5, 图5), 但是, 检查时间成倍增长.
| 基线 | TR(ms) | TE(ms) | NEX(次) | |||||
| 1000 | 2000 | 3000 | 30 | 144 | 4 | 8 | 16 | |
| 0 | 1 | 2 | 2 | 1 | 2 | 0 | 1 | 4 |
| 1 | 5 | 5 | 5 | 5 | 4 | 4 | 5 | 3 |
| 2 | 2 | 1 | 1 | 2 | 1 | 3 | 2 | 1 |
| 3 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 |
| SNR | TR(ms) | F/χ2 | P | ||
| 1000 | 2000 | 3000 | |||
| Lip | 5.73±0.54 | 5.78±1.26 | 6.43±1.44 | 0.551 | 0.759 |
| Glx | 1.95±0.36 | 1.78±0.28 | 1.97±0.53 | 0.624 | 0.732 |
| Cho | 2.20±0.37 | 2.12±0.25 | 3.18±1.84 | 0.869 | 0.648 |
| Glyu | 2.01±0.23 | 2.15±0.41 | 3.54±2.35 | 1.104 | 0.576 |
| SNR | TE(ms) | t/z | P | |
| 30 | 144 | |||
| Lip | 5.73±0.54 | 3.73±0.79 | -1.121 | 0.260 |
| Glx | 1.95±0.36 | 1.24±0.26 | 2.770 | 0.020 |
| Cho | 2.20±0.37 | 1.88±0.29 | -0.801 | 0.423 |
| Glyu | 2.01±0.23 | 1.54±0.28 | 1.263 | 0.235 |
| SNR | NEX(次) | F/χ2 | P | ||
| 4 | 8 | 16 | |||
| Lip | 4.37±0.63 | 5.73±0.54 | 7.14±1.09 | 11.100 | 0.004 |
| Glx | 1.50±0.26 | 1.95±0.36 | 2.38±0.24 | 8.833 | 0.012 |
| Cho | 1.41±0.43 | 2.20±0.37 | 2.57±0.78 | 8.625 | 0.013 |
| Glyu | 1.34±0.26 | 2.01±0.23 | 2.84±0.81 | 12.599 | 0.002 |
我们利用1.5 T磁共振仪对兔肝VX2瘤动物模型进行2D 1H-MRS检查, 成功获得的谱图曲线与文献报道的肝脏活体1H-MRS检查所得的波谱曲线特征基本一致[10-14], 可观察到Lipids(包括Lip1, Lip2, Lip3), Glx, Cho和Glyu等主要代谢物波峰, 说明1.5 T磁共振仪进行兔肝VX2瘤活体二维多体素1H-MRS检查具有可行性. 由于1H-MRS敏感性相对较低, 并且受到硬件、软件、后处理技术和生理运动等因素的影响, 肝脏的1H-MRS成像的可靠性与常规应用的要求之间还存在较大的差距, 波谱图像质量, 包括分辨率及信噪比等都是限制其应用的关键. 除了原子核的自然丰度和固有敏感性、代谢物在生物体内的浓度、原子核的化学位移范围、磁场强度等一些固定的和现有设备无法改变的因素外, 检查对象的制动、匀场和抑水、线圈、VOI、TR、TE、NEX等检查技术和参数等都对多体素1H-MRS扫描成败和谱图质量产生不同程度的影响. 在目前有限肝脏活体1H-MRS文献中, 对参数和序列的选择缺乏系统的研究. 我们针对一些可能影响MRS信噪比和分辨率的因素, 结合既往的文献对有关扫描技术手段和参数的优选进行探讨.
多体素MRS的体素比单体素MRS更小, MRS数据所采集的范围针对的是多个很小的部分, 检查部位微小的移动就可能造成MRS采集的失败. 肝脏紧邻膈肌, 易受呼吸运动的影响, 多体素MRS检查时间又比较长, 所以对制动的要求更高, 检查对象的严格制动、克服呼吸运动干扰成为成功获得可析性波谱的重要前提[15-16]. 我们采取了持续深度麻醉和腹部周围紧密加压的方法. 耳缘静脉麻醉荷瘤兔后留置针头, 推注少量肝素防止凝血, 在MR扫描过程中不断添加少量3%戊巴比妥钠, 可使动物在较长时间的检查过程中持续保持深度麻醉状态, 明显减弱呼吸幅度, 而且防止了一次性注射大量的戊巴比妥钠造成兔麻醉过量死亡. 同时, 我们在动物躯干周围紧密填塞填塞垫, 增加躯体的占空比, 使腹部恰好位于线圈中央, 既限制了躯体的活动, 又减小了呼吸运动幅度. 我们曾尝试未用填塞垫加压就进行扫描, 发现所得波谱曲线均表现为基线严重变形, 呈锯齿状, 不能明确显示代谢物波峰, 由此证明腹部加压、严格制动对于成功获得高质量波谱确有帮助. MRS是利用化学位移的微小变化采集信号, 而原子核化学位移的变化极为微小, 一旦磁场不均匀就会造成信号难以测量. 非常均匀的磁场是获得高分辨率可析性波谱的必要条件[17]. 同时, 肝脏1H-MRS研究的代谢产物的含量都很低, 明显低于体内水的含量, 若水抑制效果差, 代谢物的共振峰会受到水峰的影响, 甚至淹没[2]. 1H-MRS通常用水峰FWHM和WS等指标来判断磁场均匀性和抑水程度. 匀场效果越好, FWHM的值越小, 抑水越充分, WS的值越高, 波谱的基线就越平稳. 本研究使用机器自动预扫描完成匀场和抑水过程. 我们发现, 预扫描后FWHM太高, 抑水WS太低, 所得谱图均质量不高, 靠近水峰处基线上升明显, 邻近的Glyu峰甚至Cho峰都会受到影响, 明显上抬、增宽、畸变. FWHM≤10Hz, WS≥98%时情况改善. 所以在本实验中我们限定只有当预扫描效果达到FWHM≤10Hz, WS≥98%时才进行波谱采集, 对于首次预扫描不成功或未达到上述标准者, 再进行一次预扫描, 若仍未达到则调整VOI的位置. 必要时手动高阶匀场, 务必使每一次均能达到好的匀场和抑水效果后再进行正式的扫描.
尽管头部线圈是进行头部MRS检查的标准线圈, 也是最为成熟的线圈, 而GPFLEX表面线圈也是肝脏成像最常用的线圈, 但是我们在预实验中比较了三种线圈后, 发现对于兔这一类体积较小的实验动物, 头部线圈相对太大, 而柔软线圈活动度大, 固定难度大, 两者都不利于制动. 固定和腹部加压制动效果最好的就只有人膝关节线圈. 同时, 众所周知, 接收线圈大, 被检测组织小, 信噪比就会降低, 用小的线圈接受信号, 可使信噪比提高, 所以膝关节线圈理论上也是信噪比最好的线圈. 1H-MRS的VOI的信号强度与所检测的质子核的数量成正比, VOI增大可以提高信噪比, 本研究中采用的实验动物-兔, 本身的肝脏体积就明显小于人类肝脏, 而且VOI还要包括肿瘤、瘤周和邻近正常肝组织三个部分, 所以VOI需要尽量的大, 以提高信噪比, 利于多个部位的对比. 与此同时, VOI的位置也很重要, 临近如空气和骨等两种相差显著的组织造成的磁敏感性不同可使局部磁场不均匀, 引起共振峰的增宽畸变[18-19]. 所以, VOI应尽量避开大的血管和胆管, 减少其引起的内磁场的不均匀性; 远离皮下脂肪组织, 避免VOI外的脂肪等信号污染; 远离肠管, 避免肠道内气体对MRS采集造成影响; 而且, VOI还要避开肿瘤内大的液化坏死灶. 我们发现当VOI内包括大的胆管、血管, 或者太多肿瘤中心液化坏死区时, 匀场和抑水效果都不好, 提示VOI位置的选择对2D 1H-MRS检查结果也有很大影响.
由于不同代谢物的T1和T2值不同, 所以不同的TR和TE参数可以影响波谱的测量结果. TR时间主要根据代谢物的T1决定, 大部分活体生物组织主要化合物的T1弛豫时间相近(1000-1500 ms)[8,20]. 长的TR时间允许更多的纵向弛豫, 使更多磁化分量恢复到平衡位置. TR太短, 纵向弛豫没有完全恢复, 会影响信号强度; TR太长, 则会增加扫描时间. 如果TR时间恰好等于或稍长于T1时间, 那么每次激励后的磁共振信号更强. 本实验在其他参数不变的条件下, 分别以TR = 1000 ms, 2000 ms和3000 ms进行采集, 结果基线情况并未随TR时间的延长而改善, TR的改变对SNR影响也不大, 可能与TR = 1000 ms已与肝内大部分代谢物的T1时间相近有关, 也可能是我们的动物数太少, 尚不能体现长TR的优势. 但是TR = 3000 ms和2000 ms的采集时间明显延长, 分别比TR = 1000 ms时长3倍和2倍. 权衡利弊之后, 我们认为TR取1000 ms更合适. Inglese et al[21]比较了TE=30 ms, 144 ms和288 ms时脑部2D 1H-MRS(PRESS序列)的结果, 发现TE为30 ms时脑内所有代谢物的信噪比最高, 但是, 虽然TE = 288 ms时SNR最低, 其可重复性却最好, 作者认为在临床应用中脑部1H-MRS检查采用长TE(270 ms或288 ms)会更有益于显示长T2代谢物的单峰. 而Longo et al[2]测量肝脏的脂肪浸润时, 发现在TR = 3000 ms时, TE由50 ms到200 ms逐步延长时, 脂质的信号强度会逐渐变小. 短TE可以增加信噪比, 使得一些化合物容易检测, 脂质、谷氨酰胺和谷氨酸复合物、肌醇等物质信号显示更充分. 当TE大于3倍的T2时, 由于复杂信号的相互作用, 可导致共振信号反向去相位, 会使某些化合物难以检测. 一般认为短TE适合绝大多数代谢物的T2时间[2,12], 但长TE时波谱基线较平稳[22,23]. 我们的研究发现, 在兔肝VX2瘤2D 1H-MRS检查中, TE的改变对MRS谱图基线情况和对波谱主要代谢物波峰分辨能力的影响不大. 除了Glx的信噪比在短TE时好外, 其他主要代谢物的信噪比均没有显著性差异. 这一无统计学意义的结果也可能与本研究例数太少有关. 结合既往的文献, 我们认为取短TE(30 ms)更适于兔肝VX2瘤2D 1H-MRS成像.
由于在磁共振信号采集过程中噪声的累积是随机的, 而信号的累积是相关的, 当脉冲重复采集信号时, 除了射频脉冲的相位, 其他参数均没有改变, 即在一对激励脉冲中, 用第1次相位脉冲采集的信号减去第2次反相位脉冲采集的信号, 使得第1个信号与第2个反相信号加在一起, 而其他不依赖于射频脉冲相位的错误信号将被删除. 因此在扫描过程中增加NEX会使信号在计算机中逐渐累加而增强, 而噪声被平均而分散, NEX增加n倍, 信噪比增加n1/2倍, 但是扫描时间也会增加n倍. 在本研究中我们发现NEX的改变对于兔肝VX2瘤2D 1H-MRS检查结果的影响较大, NEX由4次增加到8次, 再增加到16次, 波谱曲线的基线逐渐变得平稳, 波峰之间的重叠减少, 对代谢物波峰的分辨能力提高, 信噪比增加, 波谱质量提高, 证实NEX是2D 1H-MRS检查的重要影响因素之一, 增大NEX可以成功获得高质量的波谱图. 但是随着NEX增大, 检查时间也随之成倍增长, 由于本研究中我们采取了一系列加强制动、持续深度麻醉的措施, 所以每次26 min 48 s的扫描时间尚在动物实验可接受的范围内. 为获得成功的可析性波谱, 更好的观察实验动物模型的多体素1H-MRS特征, 我们认为在本次实验研究中NEX设定为16次更为有利. 但是检查时间过长势必会对1H-MRS临床应用的开展和推广产生阻碍, 所以关于临床检查中NEX的选择仍有待于进一步的研究.
总之, 利用1.5 T磁共振仪进行兔肝VX2瘤活体2D 1H-MRS检查具有可行性. 通过加强制动, 预扫描匀场和抑水效果达到水峰FWHM≤10 Hz、WS≥98%, 使用人膝关节线圈, 选择TR = 1000 ms, TE = 30 ms和较大的NEX(16次)等有利于兔肝VX2瘤活体2D 1H-MRS检查成功获得较高质量的可析性波谱. 本研究为肝脏活体2D 1H-MRS临床应用中扫描技术和参数优选提供了基础.
近年来国内外对肝脏活体1H-MRS的研究逐渐增多, 但还远不及脑部和前列腺等器官, 尚处于实验阶段, 且多局限于肝脏弥漫性病变. 我们针对一些可能影响MRS信噪比和分辨率的因素, 结合既往的文献对有关扫描技术手段和参数的优选进行探讨.
吕明德, 教授, 中山大学附属第一医院肝胆外科.
肝癌的磁共振研究以常规MRI研究为主, 1H-MRS的研究很少, 尤其是针对肝肿瘤活体二维多体素1H-MRS的检查技术, 国内外尚缺乏系统性研究.
本文利用1.5 T磁共振仪对兔肝VX2瘤动物模型进行2D 1H-MRS检查, 获得肝脏活体2D 1H-MRS优选参数.
本研究为肝脏活体2D 1H-MRS临床应用中扫描技术和参数优选提供了基础.
ppm: 磁共振波谱的横坐标表示不同物质中质子的进动频率, 以标准物的质子进动频率为基准, 其他代谢物中质子进动频率与标准物中质子进动频率的差别, 以百万分几(ppm)来表示.
本研究采用的技术先进, 对临床肿瘤检测及治疗有重要意义.
编辑: 程剑侠 电编: 吴鹏朕
| 1. | 1 Cho SG, Kim MY, Kim HJ, Kim YS, Choi W, Shin SH, Hong KC, Kim YB, Lee JH, Suh CH. Chronic hepatitis: in vivo proton MR spectroscopic evaluation of the liver and correlation with histopathologic findings. Radiology. 2001;221:740-746. [PubMed] [DOI] |
| 2. | Longo R, Ricci C, Masutti F, Vidimari R, Crocé LS, Bercich L, Tiribelli C, Dalla Palma L. Fatty infiltration of the liver. Quantification by 1H localized magnetic resonance spectroscopy and comparison with computed tomography. Invest Radiol. 1993;28:297-302. [PubMed] [DOI] |
| 3. | Taylor-Robinson SD, Sargentoni J, Bell JD, Saeed N, Changani KK, Davidson BR, Rolles K, Burroughs AK, Hodgson HJ, Foster CS. In vivo and in vitro hepatic 31P magnetic resonance spectroscopy and electron microscopy of the cirrhotic liver. Liver. 1997;17:198-209. [PubMed] [DOI] |
| 5. | Roser W, Stock KW. 1H MRS of liver and brain in a patient with AL amyloidosis. Magn Reson Imaging. 1997;15:993-996. [PubMed] [DOI] |
| 7. | Yang JH, You TG, Li N, Qian QJ, Wang P, Yan ZL, Wu MC. Relationship between the imaging features and pathologic alteration in hepatoma of rats. World J Gastroenterol. 2003;9:69-72. [PubMed] [DOI] |
| 8. | Kreis R, Ernst T, Ross BD. Development of the human brain: in vivo quantification of metabolite and water content with proton magnetic resonance spectroscopy. Magn Reson Med. 1993;30:424-437. [PubMed] [DOI] |
| 9. | Gonen O, Gruber S, Li BS, Mlynárik V, Moser E. Multivoxel 3D proton spectroscopy in the brain at 1.5 versus 3.0 T: signal-to-noise ratio and resolution comparison. AJNR Am J Neuroradiol. 2001;22:1727-1731. [PubMed] |
| 10. | Kuo YT, Li CW, Chen CY, Jao J, Wu DK, Liu GC. In vivo proton magnetic resonance spectroscopy of large focal hepatic lesions and metabolite change of hepatocellular carcinoma before and after transcatheter arterial chemoembolization using 3.0-T MR scanner. J Magn Reson Imaging. 2004;19:598-604. [PubMed] [DOI] |
| 11. | Tarasów E, Siergiejczyk L, Panasiuk A, Kubas B, Dzienis W, Prokopowicz D, Walecki J. MR proton spectroscopy in liver examinations of healthy individuals in vivo. Med Sci Monit. 2002;8:MT36-MT40. [PubMed] |
| 12. | Bárány M, Langer BG, Glick RP, Venkatasubramanian PN, Wilbur AC, Spigos DG. In vivo H-1 spectroscopy in humans at 1.5 T. Radiology. 1988;167:839-844. [PubMed] [DOI] |
| 13. | Bell JD, Cox IJ, Sargentoni J, Peden CJ, Menon DK, Foster CS, Watanapa P, Iles RA, Urenjak J. A 31P and 1H-NMR investigation in vitro of normal and abnormal human liver. Biochim Biophys Acta. 1993;1225:71-77. [PubMed] [DOI] |
| 14. | Lim AK, Hamilton G, Patel N, Bell JD, Taylor-Robinson SD. H MR spectroscopy in the evaluation of the severity of chronic liver disease. Radiology. 2003;226:288-289. [PubMed] [DOI] |
| 15. | Katz-Brull R, Rofsky NM, Lenkinski RE. Breathhold abdominal and thoracic proton MR spectroscopy at 3T. Magn Reson Med. 2003;50:461-467. [PubMed] [DOI] |
| 16. | Star-Lack JM, Adalsteinsson E, Gold GE, Ikeda DM, Spielman DM. Motion correction and lipid suppression for 1H magnetic resonance spectroscopy. Magn Reson Med. 2000;43:325-330. [PubMed] [DOI] |
| 17. | 吴 光耀, 孙 骏谟, 田 志雄. 活体质子磁共振波谱技术分析. 国外医学·临床放射学分册. 2001;24:347-350. |
| 18. | Li S, Williams GD, Frisk TA, Arnold BW, Smith MB. A computer simulation of the static magnetic field distribution in the human head. Magn Reson Med. 1995;34:268-275. [PubMed] [DOI] |
| 19. | Li S, Dardzinski BJ, Collins CM, Yang QX, Smith MB. Three-dimensional mapping of the static magnetic field inside the human head. Magn Reson Med. 1996;36:705-714. [PubMed] [DOI] |
| 20. | Wansapura JP, Holland SK, Dunn RS, Ball WS. NMR relaxation times in the human brain at 3.0 tesla. J Magn Reson Imaging. 1999;9:531-538. [PubMed] [DOI] |
| 21. | Inglese M, Spindler M, Babb JS, Sunenshine P, Law M, Gonen O. Field, coil, and echo-time influence on sensitivity and reproducibility of brain proton MR spectroscopy. AJNR Am J Neuroradiol. 2006;27:684-688. [PubMed] |
| 22. | Frahm J, Bruhn H, Hänicke W, Merboldt KD, Mursch K, Markakis E. Localized proton NMR spectroscopy of brain tumors using short-echo time STEAM sequences. J Comput Assist Tomogr. 1991;15:915-922. [PubMed] [DOI] |