修回日期: 2007-01-15
接受日期: 2008-01-20
在线出版日期: 2008-02-28
目的: 用电生理方法研究红霉素和阿齐霉素对胃肠感觉传入的影响.
方法: 64只SD成年大鼠随机分成8组(n = 8): 红霉素组: 对照、小剂量(0.1 mg/kg)、中剂量(0.5 mg/kg)、大剂量(1 mg/kg)组. 阿齐霉素组: 分组和剂量均与红霉素相同. 经颈静脉注射生理盐水、红霉素、阿齐霉素, 观察记录注药前和注药后30 min内膈下迷走神经传入自发放电和扩胃诱发放电两种状态下的变化.
结果: 静脉注射小剂量红霉素和阿齐霉素自发放电和对扩胃诱发放电均无显著变化, 20 min后中、大剂量红霉素和阿齐霉素注药后自发放电(红霉素: 8.34±0.37, 8.54±0.26 vs 7.78±0.23, 7.84±8.27; 阿齐霉素: 8.57±0.43, 8.28±0.38 vs 7.74±0.21, 7.86±0.30)和对扩胃诱发放电均增强(红霉素: 8.54±0.34, 8.61±0.20 vs 8.13±0.36, 8.19±0.21; 阿齐霉素: 8.54±0.30, 8.42±0.21 vs 8.24±0.22, 8.22±0.19)与相应的对照组和小剂量组间差异有统计学意义.
结论: 红霉素和阿齐霉素能显著增加胃肠感觉传入.
引文著录: 肖刚, 李静, 邓丽君, 陆杰. 红霉素和阿齐霉素对大鼠胃肠感觉传入的影响. 世界华人消化杂志 2008; 16(6): 607-612
Revised: January 15, 2007
Accepted: January 20, 2008
Published online: February 28, 2008
AIM: To investigate the effect of erythromycin and azithromycin on sensation afferent nerve functions of gastrointestinal tract in rats and its corresponding mechanism.
METHODS: Sixty-four rats were randomly divided into erythromycin group, azithromycin group, control group, low dose group (0.1 mg/kg), medium dose group (0.5 mg/kg) and high dose group (1 mg/kg). Spontaneous afferent nerve discharge and gastric distention-induced afferent nerve discharge of subdiaphragmatic vagus nerve were recorded half an hour before and after intravenous injection of different doses of erythromycin and azithromycinin.
RESULTS: Intravenous low erythromycin and azithromycin dose had no obvious exciting effect on spontaneous afferent nerve discharge and gastric distention- induced afferent nerve discharge of subdiaphragmatic vagus nerve after 20 min. Intravenous medium and high erythromycin and azithromycin dose had obvious exciting effect on spontaneous afferent nerve discharge (erythromycin: 8.34 ± 0.37, 8.54 ± 0.26 vs 7.78 ± 0.23, 7.84 ± 8.27; azithromycin: 8.57 ± 0.43, 8.28 ± 0.38 vs 7.74 ± 0.21, 7.86 ± 0.30) and gastric distention-induced afferent nerve discharge of subdiaphragmatic vagus nerve (erythromycin: 8.54 ± 0.34, 8.61 ± 0.20 vs 8.13 ± 0.36, 8.19 ± 0.21; azithromycin: 8.54 ± 0.30, 8.42 ± 0.21 vs 8.24 ± 0.22, 8.22 ± 0.19), which was statistically significant compared with the control and low dose groups.
CONCLUSION: Erythromycin and azithromycin have significant effects on sensation afferent nerve functions of gastrointestinal tract in rats.
- Citation: Xiao G, Li J, Deng LJ, Lu J. Effect of erythromycin and azithromycin on sensation afferent nerve functions of gastrointestinal tract in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 607-612
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/607.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.607
大环内酯类抗生素有多种, 如红霉素(erythro-mycin, EM)、克拉霉素、罗红霉素和阿齐霉素(azithromycin, AZM)等, 他们具有良好的抗菌作用, 在临床上应用广泛, 但胃肠道反应常见, 红霉素最为明显, 阿齐霉素等新品种则相对较轻[1-2]. 在体实验表明红霉素等大环内酯可使胃肠蠕动增加, 排空加快[3], 离体状态下可使胃肠平滑肌收缩功能增强[4]. 研究表明离体状态下红霉素的作用主要是通过胃动素受体发挥, 而在体情况下, 部分由迷走神经参与作用[5]. 临床研究表明用小剂量红霉素来治疗糖尿病胃轻瘫[6]和早产儿喂养困难等, 疗效显著[7]. 有资料表明阿齐霉素同样也是胃动素受体激动剂, 具有促进胃排空的作用, 并且比红霉素作用时间更长, 不易于其他药物发生相互作用, 有希望开发为新的治疗胃瘫的药物[8]. 他们在发挥促进胃肠运动的作用中, 迷走神经的感觉传入是否发挥作用, 目前还未见报道, 所以本实验用这两种药物作为研究, 观察大环内酯类抗生素对胃肠感觉传入的影响.
健康SD大鼠64只, 体质量200-250 g, 雌雄不限, 由重庆医科大学实验动物中心提供, 红霉素标准品(编号130307-200215)中国药品生物制品检定所生产, 阿齐霉素(编号021020)金华立信医药有限公司生产.
实验前大鼠禁食24 h, 自由饮水, 随机分为红霉素组和阿齐霉素组, 每组32只, 各组再分成4组(n = 8), 即对照组、小剂量(0.1 mg/kg)、中剂量(0.5 mg/kg)和大剂量(1 mg/kg)组. 大鼠用200 g/L乌拉坦ip麻醉, 6 mL/kg体质量. 颈部正中切开, 气管插管, 备人工呼吸用. 一侧颈静脉插管输液, 备注射药物用. 腹部剑突下皮肤正中切口, 于胃大弯膜部作切口, 将扩张用的水囊经胃大弯切口置入胃体部. 实验时向水囊内注水2-3 mL(0.5 mL/s. 水温保持37 ℃左右)扩张胃, 并维持扩张状态20 s作为对胃壁机械感受器的刺激. 在上腹部食道根部分离出膈下迷走神经前支, 并用镊子夹伤神经中枢端. 用双极铂金丝电极(直径0.3 mm, 极间距2 mm)钩上神经前支, 引导膈下迷走神经的传入电活动, 神经周围用温石蜡油保温并防止神经干燥. 引导的电位输入AVB-11生物电放大器放大后, 在VC-10型记忆示波器上显示, 并用DAB-1100直方图仪的Windows-discriminator选择综合电位中的一类电位, 作脉冲计数直方图处理. 将神经放电直方图用RJG-4022记录仪记录, BI-2000图象分析系统计算记录到的直方图面积. 整个实验中动物肛温保持在38 ℃左右, 并持续监测心电. 手术操作完成后, 各项指标在稳定15 min后进行记录作为对照.
统计学处理 实验中所记录的直方图测算面积后, 进行自然对数(ln)转换成正态分布. 数据用对数值的mean±SD表示, 采用SPSS统计软件作单向方差分析(One-way ANOVA), P<0.05为有统计学意义.
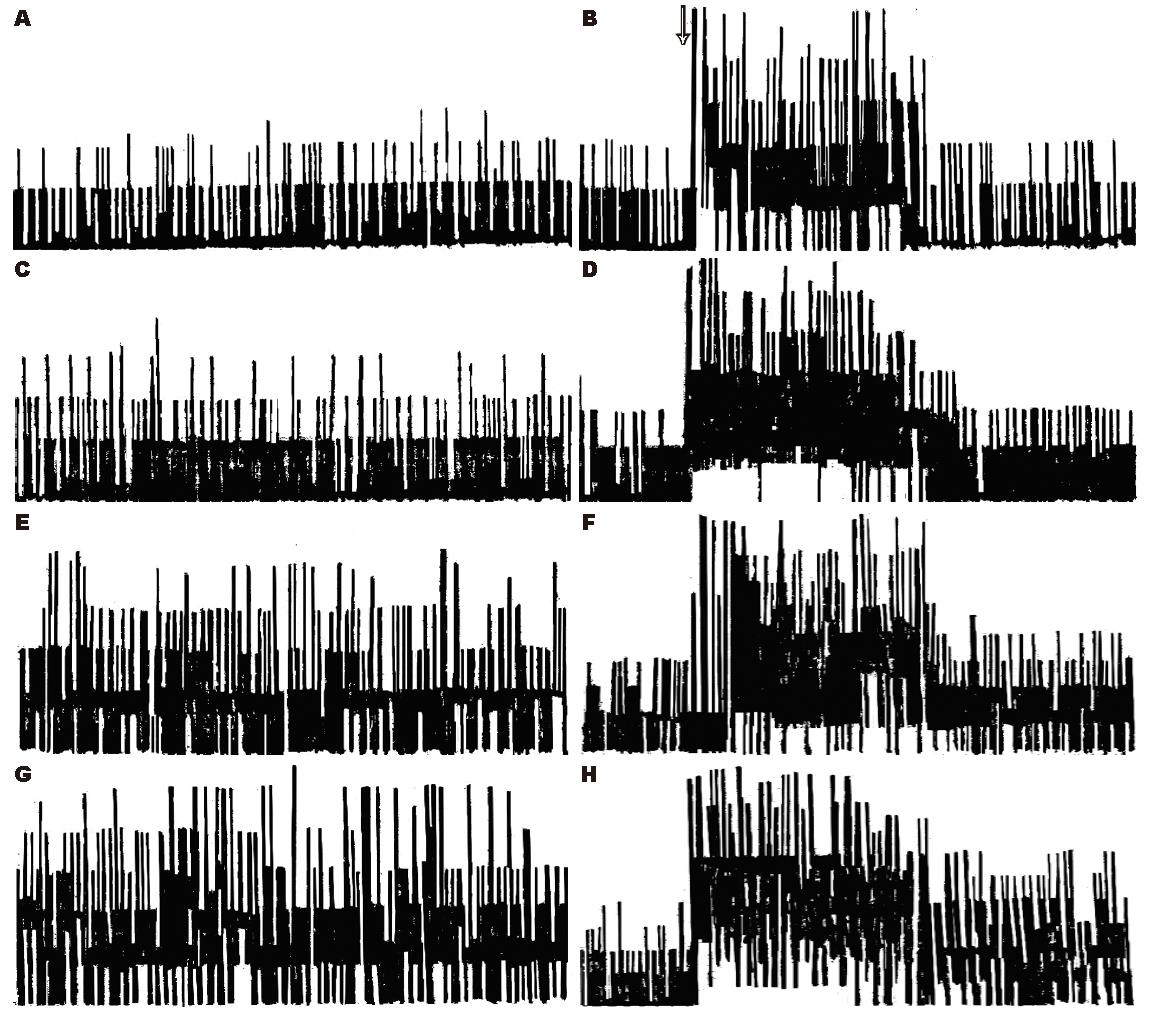
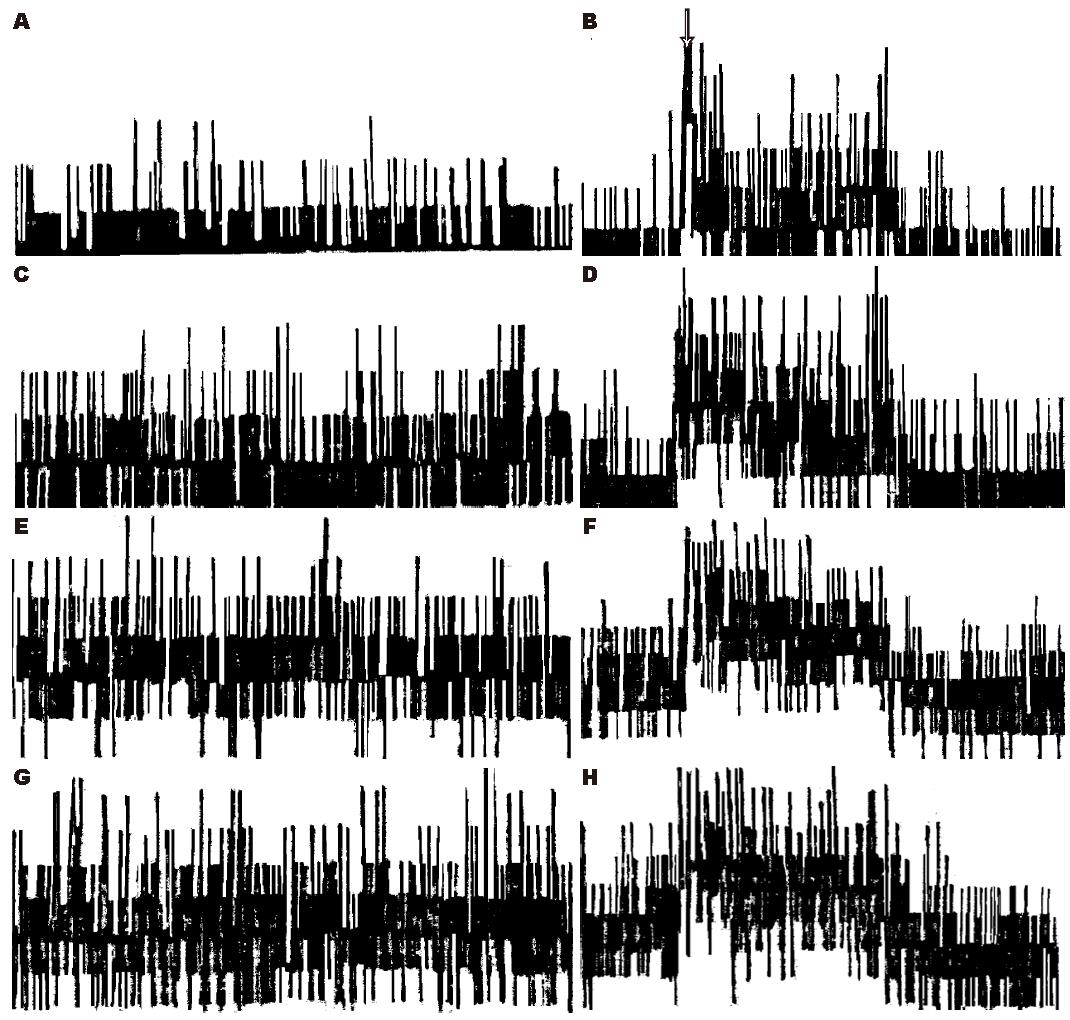
静脉注射小剂量红霉素自发放电无显著变化. 中、大剂量组注药后自发放电增多, 分别于5 min和10 min后开始有统计学意义, 中、大剂量两组间无显著差异, 而两者与对照组和小剂量组间差异有统计学意义(表1, 图1).
| 分组 | 对照组 | 0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
| 对照组 | 7.85±0.15 | 7.79±0.16 | 7.74±0.25 | 7.80±0.23 | 7.72±0.35 | 7.78±0.23 | 7.71±0.40 | 7.75±0.46 |
| 0.1 mg/kg | 7.84±0.22 | 7.85±0.22 | 7.84±0.19 | 7.90±0.24 | 7.89±0.32 | 7.84±8.27 | 7.90±0.22 | 7.81±0.42 |
| 0.5 mg/kg | 7.85±0.30 | 8.01±0.29 | 8.23±0.17ac | 8.24±0.28bc | 8.32±0.26bd | 8.34±0.37bd | 8.48±0.34bd | 8.51±0.25bd |
| 1 mg/kg | 7.85±0.45 | 7.85±0.36 | 8.18±0.36 | 8.27±0.21a | 8.48±0.24bd | 8.54±0.26bd | 8.55±0.25bd | 8.62±0.46bd |
静脉注射小剂量红霉素对扩胃诱发放电无显著影响. 中、大剂量组注药后扩胃诱发放电增强, 于15 min开始有统计学意义, 直至30 min仍维持在较高水平, 但两组间无差异显著性而与对照组和小剂量组间差异有统计学意义(表2, 图1).
| 分组 | 对照组 | 0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
| 对照组 | 8.31±0.13 | 8.21±0.23 | 8.18±0.22 | 8.23±0.16 | 8.13±0.29 | 8.13±0.36 | 8.06±0.52 | 8.13±0.30 |
| 0.1 mg/kg | 8.32±0.23 | 8.28±0.25 | 8.17±0.27 | 8.20±0.22 | 8.13±0.15 | 8.19±0.21 | 8.10±0.19 | 8.10±0.30 |
| 0.5 mg/kg | 8.30±0.34 | 8.36±0.25 | 8.40±0.27 | 8.49±0.22 | 8.59±0.26ad | 8.54±0.34ad | 8.69±0.28bd | 8.70±0.20bd |
| 1 mg/kg | 8.14±0.40 | 8.16±0.37 | 8.41±0.34 | 8.39±0.27 | 8.56±0.22bd | 8.61±0.20bd | 8.62±0.22bd | 8.74±0.32bd |
静脉注射小剂量阿齐霉素自发放电无显著变化. 中、大剂量组注药后自发放电增强, 分别于10 min和20 min开始有统计学意义, 但两组间差异无显著性而与对照组和小剂量组间有统计学意义(表3, 图2).
| 分组 | 对照组 | 0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
| 对照组 | 7.85±0.31 | 7.85±0.23 | 7.80±0.17 | 7.81±0.21 | 7.79±0.20 | 7.74±0.21 | 7.77±0.26 | 7.78±0.20 |
| 0.1 mg/kg | 7.85±0.41 | 7.84±0.31 | 7.87±0.33 | 7.86±0.24 | 7.90±0.31 | 7.86±0.30 | 7.83±0.21 | 7.83±0.40 |
| 0.5 mg/kg | 7.87±0.08 | 7.85±0.30 | 8.15±0.33 | 8.33±0.23bd | 8.43±0.31bd | 8.57±0.43bd | 8.40±0.38bd | 8.36±0.28bd |
| 1 mg/kg | 7.85±0.22 | 7.94±0.34 | 7.93±0.41 | 7.90±0.24 | 7.98±0.39 | 8.28±0.38ac | 8.28±0.38ac | 8.47±0.31bd |
静脉注射小剂量阿齐霉素对扩胃诱发放电均无显著影响. 中、大剂量组注药后扩胃诱发放电增强, 分别于15 min和20 min具有统计学意义, 但此两组间无差异显著性而与对照组和小剂量组间有统计学意义(表4, 图2).
| 分组 | 对照组 | 0 min | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
| 对照组 | 8.28±0.12 | 8.32±0.08 | 8.33±0.14 | 8.30±0.14 | 8.26±0.16 | 8.24±0.22 | 8.27±0.13 | 8.29±0.12 |
| 0.1 mg/kg | 8.29±0.28 | 8.30±0.26 | 8.25±0.29 | 8.22±0.28 | 8.29±0.16 | 8.22±0.19 | 8.21±0.23 | 8.21±0.20 |
| 0.5 mg/kg | 8.31±0.20 | 8.30±0.24 | 8.42±0.19 | 8.49±0.23 | 8.53±0.23ac | 8.54±0.30ad | 8.57±0.21ad | 8.54±0.26ad |
| 1 mg/kg | 8.30±0.17 | 8.28±0.23 | 8.33±0.18 | 8.29±0.27 | 8.36±0.36 | 8.42±0.21ac | 8.59±0.20ad | 8.67±0.22bd |
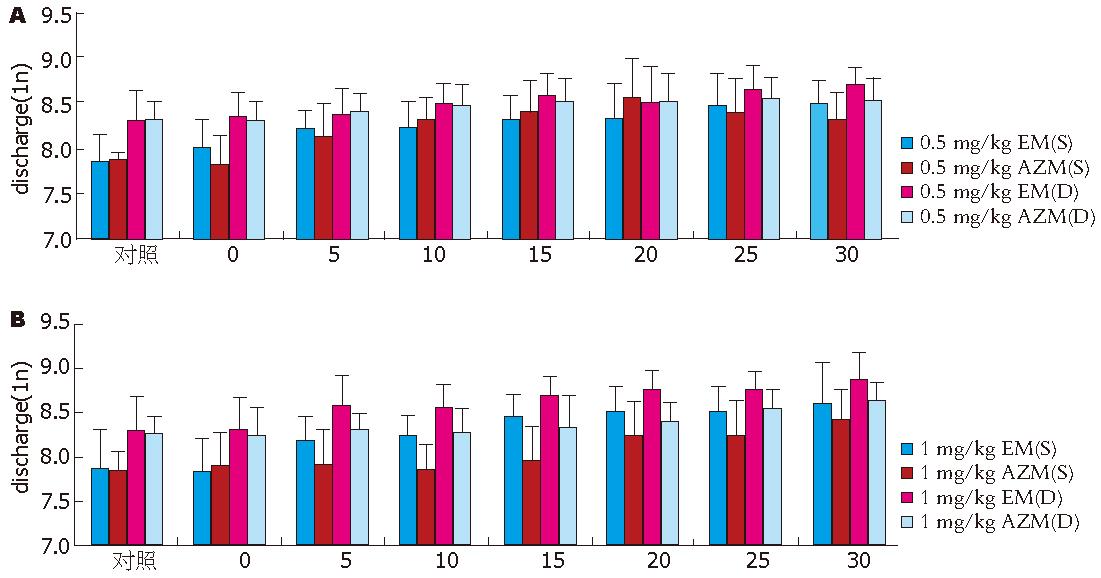
相同剂量红霉素与阿齐霉素比较(图3A-B), (1)红霉素起效时间要早于阿齐霉素: 红霉素引起自发放电显著增加的起始时间中剂量5 min和大剂量10 min, 而阿齐霉素在中剂量和大剂量分别为10 min和20 min放电显著增加. 对扩胃诱发放电的影响, 红霉素发挥显著作用的起始时间在中剂量和大剂量分别为15 min和10 min, 而阿齐霉素分别为15 min和25 min. (2)两者的作用强度不同: 无论中剂量还是大剂量, 红霉素的作用都大于阿齐霉素, 并且随剂量增大, 差异显著性也增加. (3)中剂量作用峰值不同, 对自发放电和扩胃诱发放电的影响, 阿奇霉素在20 min和25 min有一高峰, 随后稍有回落, 最终作用强度弱于红霉素.
胃肠感觉的初级传入神经元有内源性和外源两大类, 内源性初级传入神经元属肠神经系统, 位于肌间神经丛和黏膜下神经丛, 感受胃肠腔内化学物质变化、黏膜和肌层的扭曲变形[9]. 胃肠内在神经系统相对完整独立但又受外源性神经系统控制. 外源性神经元主要包括迷走神经初级传入神经元和脊髓初级传入神经元以及肠离心神经元, 这些神经元分别感受消化道内容物的化学特性和肌肉的紧张性, 并将其信号通过迷走神经传入纤维上传至节状神经节孤束核、迷走神经背核、延髓最后区, 此感觉路径主要感受生理性刺激. 浆膜及肠系膜受体感受胃肠的运动和变形、扭曲, 信号通过脊髓背根传入中枢, 此路径主要传导伤害性刺激[10]. 另外, 肠离心神经元于肠壁投射至椎前神经节, 通过交感神经传至中枢[11]. 内在神经系统和外来神经系统相互协调, 完成对胃肠功能的调节. 一个或者多个环节出现问题, 便会产生各种胃肠功能障碍.
本实验中观察到, 静脉注射中剂量红霉素和阿齐霉素对膈下迷走神经传入放电有明显作用, 无论是自发还是扩胃诱发放电在注药后5 min均增强, 30 min后维持在较高水平. 但在剂量达到1 mg/kg后胃肠感觉传入放电增加反而迟后, 并且本课题组也曾将剂量逐渐增加最大至10 mg/kg, 直视状态下能明显观察到胃十二指肠蠕动, 迷走神经传入放电增加依然较0.5 mg/kg迟后, 这也提示红霉素和阿齐霉素对膈下迷走神经传入放电的影响不具有剂量依赖性, 作用机制可能有差异. 而先前就胃动素对胃肠运动功能的研究资料也表明, 胃动素对胃的作用不是剂量依赖性的[12]. 另外杨春敏et al[13]就红霉素对狗消化间期和餐后胃肠运动影响的研究中发现在消化间期静脉注射红霉素0.5 mg/kg时、引起的胃和十二指肠肠收缩与自发MMCⅢ相一致, 随剂量增大至10 mg/kg则胃十二指肠持续收缩、或逆行收缩、甚至出现恶心呕吐. 这提示静脉注射0.5 mg/kg红霉素接近于生理剂量, 1 mg/kg及以上则可能属超生理剂量. 同样, 在用红霉素治疗喂养困难的早产儿时也发现不同剂量组3-5 mg/(kg·d), 6-9 mg/(kg·d), 10-15 mg/(kg·d)静脉缓慢滴注3-5 μg/(kg·min), 最小剂量组3-5 mg/(kg·d)效果最好[7]. 所以我们认为, 红霉素在接近生理剂量作用下, 胃肠感觉传入增强有跟胃肠运动功能是协调一致的, 产生生理反应较快; 而在超生理剂量作用下, 胃肠感觉的生理反应被抑制, 感觉传入的增加是继发于药物引起的胃十二指肠持续收缩、或逆行收缩等不良反应. 但详细机制尚待进一步证实.
红霉素和阿齐霉素同为胃动素受体激动剂, 可作用于胃窦、平滑肌和胃肠神经系统胃动素受体[14]引起膈下迷走神传入放电增强, 表明他们对胃肠感觉是有促进作用的. 以往的研究资料已经证实, 胃动素和红霉素均可通过外周或者中枢[15-16]使胃肠运动功能增强. 运动与感觉总是相互联系的, 所以红霉素及其衍生物促进两者之间的良性互动, 改善胃肠功能, 对于治疗糖尿病胃轻瘫、早产儿喂养困难等是有利的.
但他们在作用上也有一定差别, 红霉素在结构上更接近胃动素, 作用时间更早, 强度更大, 这与他们在临床应用时引起的胃肠反应强弱是一致的. 所以相同剂量阿齐霉素对胃肠运动和胃肠感觉的影响均比红霉素更小, 加上他不影响肝脏细胞色素氧化酶CYP450的活性[17-18], 更有希望成为新一代促胃动力药. 这些可能都对治疗糖尿病胃轻瘫、早产儿喂养困难等有利. 而对于大环内酯类抗生素对感觉传导的各个环节的影响及分子机制, 所引起胃肠感觉传入冲动增多有何生理意义也有待进一步探索.
本试验是在乌拉坦麻醉的大鼠上进行的, 乌拉坦麻醉对自主神经传出有兴奋[19]或者抑制[20]作用, 各种报道不相一致, 我们采用夹闭传出端的方法阻断了膈下迷走神经的传出放电, 而只记录传入放电, 避免了传出放电的干扰, 并且从对照组观察, 试验记录过程中乌拉坦麻醉对传入放电的影响无统计学意义, 所以此方法反应的结果真实可信.
红霉素和阿齐霉素在临床上广泛应用, 胃肠道副反应常见, 大量资料表明, 红霉素是胃动素激动剂, 促进胃肠道运动. 但对胃肠感觉的影响尚不清楚, 所以本文就红霉素和阿齐霉素对胃肠感觉的影响展开研究.
樊晓明, 主任医师, 复旦大学附属金山医院消化科; 周士胜, 教授, 大连大学医学院医学研究中心.
以前不少作者鉴于手术及记录方便选择颈部迷走神经作为各种研究的对象, 但其缺点是他含有的成份十分复杂, 他除了传导胃肠道信息外, 来自心血管、肺、气管等脏器的传人和传出冲动也混杂其中. 由于膈下迷走神经主要是支配胃和小肠, 并接受胃和小肠的感觉传入, 所以记录膈下迷走神经放电对了解红霉素与胃肠道的神经支配之间的联系更具说服力. 因此本实验选择了膈下迷走神经作为电生理直接观察对象, 研究了红霉素对膈下迷走神经传入冲动的影响及其相关机制.
本文对胃肠感觉传入的研究, 有利于大家全面了解胃肠激素的功能, 同时也提示迷走神经不仅在胃肠运动和胃肠液分泌中有重要作用, 在激素发挥作用时, 迷走神经的感觉传入也发挥了重要作用, 所以即使在对胃肠溃疡病的治疗中, 作迷走神经切除术也应慎重.
1 自发传入放电: 在没有给予外来刺激的情况下, 神经纤维上记录到的自发产生的放电现象.
2 扩胃诱发放电: 给予人为扩张刺激即扩张胃诱发神经纤维产生的放电现象.
本文研究具有科学性, 实验手段先进, 结果结论可信.
编辑: 程剑侠 电编: 吴鹏朕
| 3. | Ohwada S, Satoh Y, Kawate S, Yamada T, Kawamura O, Koyama T, Yoshimura S, Tomizawa N, Ogawa T, Morishita Y. Low-dose erythromycin reduces delayed gastric emptying and improves gastric motility after Billroth I pylorus-preserving pancreaticoduodenectomy. Ann Surg. 2001;234:668-674. [PubMed] [DOI] |
| 4. | Huang J, Zhou H, Mahavadi S, Sriwai W, Lyall V, Murthy KS. Signaling pathways mediating gastrointestinal smooth muscle contraction and MLC20 phosphorylation by motilin receptors. Am J Physiol Gastrointest Liver Physiol. 2005;288:G23-G31. [PubMed] [DOI] |
| 5. | Mathis C, Malbert CH. Erythromycin gastrokinetic activity is partially vagally mediated. Am J Physiol. 1998;274:G80-G86. [PubMed] |
| 8. | Moshiree B, Nicholas G, Verne GN, Philip P, Toskes PP. Azithromycin as novel treatment for gastroparesis? Am J Gastroenterol. 2005;100:S321-S326. |
| 9. | Furness JB, Jones C, Nurgali K, Clerc N. Intrinsic primary afferent neurons and nerve circuits within the intestine. Prog Neurobiol. 2004;72:143-164. [PubMed] [DOI] |
| 10. | Berthoud HR, Blackshaw LA, Brookes SJ, Grundy D. Neuroanatomy of extrinsic afferents supplying the gastrointestinal tract. Neurogastroenterol Motil. 2004;16 Suppl 1:28-33. [PubMed] [DOI] |
| 11. | Szurszewski JH, Ermilov LG, Miller SM. Prevertebral ganglia and intestinofugal afferent neurones. Gut. 2002;51 Suppl 1:i6-10. [PubMed] [DOI] |
| 12. | 陈 元方. 胃肠肽类激素基础与临床. 第1版. 北京: 北京医科大学中国协和医科大学联合出版 1997; 328. |
| 14. | Depoortere I. Motilin and motilin receptors: characterization and functional significance. Verh K Acad Geneeskd Belg. 2001;63:511-529. [PubMed] |
| 17. | Ito K, Ogihara K, Kanamitsu S, Itoh T. Prediction of the in vivo interaction between midazolam and macrolides based on in vitro studies using human liver microsomes. Drug Metab Dispos. 2003;31:945-954. [PubMed] [DOI] |
| 18. | Pai MP, Graci DM, Amsden GW. Macrolide drug interactions: an update. Ann Pharmacother. 2000;34:495-513. [PubMed] [DOI] |