修回日期: 2008-01-15
接受日期: 2008-01-23
在线出版日期: 2008-02-28
目的: 探讨MAdCAM-1在恶唑酮结肠炎中的表达及一氧化氮供体DETA NONOate和GTN对恶唑酮结肠炎的干预作用.
方法: 32只C57BL/6小鼠随机分为正常对照组(A)、恶唑酮结肠炎组(B)、GTN干预组(C)和DETA NONOate干预组(D). 除正常对照组外, 其余3组均建立小鼠恶唑酮结肠炎模型, 两个一氧化氮供体干预后处死小鼠. 评价DAI、大体评分和组织学评分; 免疫组织化学法检测MAdCAM-1及NF-κB; 硝酸还原酶法测定血清中NO含量; 测定结肠组织MPO活性.
结果: B组小鼠DAI评分自灌肠之日起逐渐增高, 而D组则变化不明显.B组小鼠大体评分、组织学评分、NF-κB的表达、MAdCAM-1的表达、MPO活性(3.13±0.84, 20.31±2.63, 30.29±8.68, 17.60±6.53, 3.83±0.60)均分别高于A组(0.38±0.52, 0.88±0.83, 7.38±2.29, 4.08±1.30, 1.75±0.25, P<0.01)和D组(1.38±0.52, 11.13±1.48, 12.60±3.54, 8.42±2.16, 2.76±0.48, P<0.01), 而C组则与B组相近. B组小鼠血清NO浓度高于A组(54.51±22.28 vs 32.17±14.88, P<0.05), 而低于D组和C组(54.51±22.28 vs 88.53±24.77, 80.12±19.79, 均P<0.05). B组MAdCAM-1的表达与组织学评分、MPO活性、NF-κB P65 IA值呈正相关(r = 0.786, r = 0.833, r = 0.833, P<0.05).
结论: 小鼠恶唑酮结肠炎中结肠固有层MAdCAM-1的表达增加, DETA NONOate可能是治疗溃疡性结肠炎的有价值药物.
引文著录: 张丽航, 欧阳钦. MAdCAM-1及NF-κB在小鼠恶唑酮结肠炎中的表达及一氧化氮供体的干预作用. 世界华人消化杂志 2008; 16(6): 596-601
Revised: January 15, 2008
Accepted: January 23, 2008
Published online: February 28, 2008
AIM: To investigate the expression of MAdCAM-1 and nuclear factor kappa B (NF-κB) as well as the intervention of nitric oxide (NO) donor DETA NONOate and GTN in oxazolone-induced colitis.
METHODS: Thirty two C57BL/6 mice were randomly divided into 4 groups: group A, B, C and D. The oxazolone experimental colitis model was established in group B, C and D. Mice of group C were treated with GTN and group D with DETA NONOate. The disease activity index (DAI), macroscopic score and histological score in each group were evaluated. The expression of MAdCAM-1 and NF-κB were determined by immunohistochemical staining. The plasma nitric oxide (NO) levels and the MPO activity in colonic tissues were also analyzed.
RESULTS: The DAI in group B and C increased since oxazolone was administered rectally, but it did not changed obviously in group D. The macroscopic score, the histological score, the expression of NF-κB, the expression of MAdCAM-1 and the MPO activity in group B (3.13 ± 0.84, 20.31 ± 2.63, 30.29 ± 8.68, 17.60 ± 6.53, 3.83 ± 0.60), which were significantly higher than those in group A, respectively (0.38 ± 0.52, 0.88 ± 0.83, 7.38 ± 2.29, 4.08 ± 1.30, 1.75 ± 0.25, P < 0.01) and group D (1.38 ± 0.52, 11.13 ± 1.48, 12.60 ± 3.54, 8.42 ± 2.16, 2.76 ± 0.48, P < 0.01), but similar to those of group C. The level of plasma NO in group B was significantly higher than that of group A (54.51 ± 22.28 vs 32.17 ± 14.88, P < 0.05), but significantly lower than that of group D and C (54.51 ± 22.28 vs 88.53 ± 24.77, 80.12 ± 19.79, all P < 0.05). There were significant positive correlations between the expression of MAdCAM-1 and the histological score, the MPO activity and IA of NF-κB (r = 0.786, r = 0.833, r = 0.833, P < 0.05).
CONCLUSION: The expression of MAdCAM-1 increases significantly in lumina propria of colonic tissues in oxazolone-induced colitis of mice. According to these results, DETA NONOate may serve as a valuable biological agent for UC treatment.
- Citation: Zhang LH, Ouyang Q. Expression of MAdCAM-1 and nuclear factor kappa B and the intervention effect of nitric oxide donor in oxazolone-induced colitis. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 596-601
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/596.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.596
炎症性肠病(inflammation bowel disease, IBD)是一种病因未明的慢性反复发作的非特异性肠道炎症性疾病, 活动期的特征性表现为大量白细胞在肠黏膜间质内广泛浸润. 黏膜地址素细胞黏附分子-1(mucosal addressin cell adhesion molecule-1, MAdCAM-1)是一种选择性表达于肠道血管内皮的黏附分子, 极少表达于肠外组织, 他与淋巴细胞表面配体的结合, 参与了淋巴细胞附壁滚动和黏附, 介导特定淋巴细胞亚群向肠道黏膜淋巴组织的归巢. 一氧化氮(nitric oxide, NO)是一种多效性的自由基信号分子. 有研究报道NO供体可以抑制MAdCAM-1在肠道的表达. 本文主要研究恶唑酮(oxazolone)结肠炎动物模型结肠黏膜上皮MAdCAM-1的表达和NO供体二亚乙基三胺-NO(Diethylenetriaamine NONOate, DETA NONOate)对MAdCAM-1表达的影响, 观察其用于治疗的潜在价值.
32只C57BL/6♂小鼠, 周龄6-8 wk, 购自四川大学华西试验动物中心. 恶唑酮(oxazolone)(Sigma公司), DETA NONOate(Cayman Chemical公司), 硝酸甘油(glyceryl trinitrate, GTN)(华西药房), MAdCAM-1抗体(MECA-367)(BD Pharmingen公司), 核因子-κB(nuclear factor-κB, NF-κB)P65mAb(Sant Cruz公司), 免疫组化染色试剂盒(SP-9000)(北京中杉金桥生物技术有限公司), 浓缩型3, 3, -二氨基联苯胺(DAB)试剂盒(北京中杉金桥生物技术有限公司), NO试剂盒、髓过氧化物酶(myeloperoxidase, MPO)试剂盒隐血检测试剂盒(南京建成生物工程研究所), UV-2201紫外-可见分光光度仪(岛津公司), BX41-32H02-FLB3荧光显微镜和DP12-PC微镜数码相机系统(Olympus公司).
1.2.1 动物模型及干预方法: 将32只实验小鼠随机分为4组: 正常对照组、恶唑酮结肠炎组、GTN干预组和DETA NONOate干预组. 参照Heller et al[1]描述的方法建立恶唑酮模型, 0, 1 d应用3%(w/v)恶唑酮酒精溶液灌肠150 μL/只致敏. GTN及DETA NONOate干预组于小鼠灌肠前24 h开始, 每天分别以GTN 2 mg/(kg·d)和DETA NONOate 1 mg/(kg·d) ip, 共4次至处死.
1.2.2 观察, 收集标本及结肠炎症的评价: 每日记录各组小鼠体质量, 大便性状变化, 检查小鼠粪便隐血. 灌肠后3 d小鼠心脏取血, 立即离心取血清, -20 ℃冰箱保存. 小鼠开腹分离结肠及回盲部, 肉眼观察肠黏膜有无损伤、充血水肿及溃疡, 估算溃疡面积与受损面积之比. 选择炎症严重部位取1 cm左右组织福尔马林固定, 石蜡包埋待检. 取一段新鲜结肠组织, 检测MPO. 按Okayasu评分标准计算疾病活动指数(disease activity index, DAI)[2]; 大体损伤按Ekstrom标准[3], 组织学损伤按韩英et al[4]标准.
1.2.3 MPO测定: 准确称量结肠组织重量, 以十六烷基三甲基溴化铵(HTAB)溶液制备50 g/L组织匀浆, 加入邻联茴香胺-H2O2反应体系中, 通过邻联茴香胺供氢后生成黄色化合物, 比色测定各管A值, 从而推算出MPO的活力.
1.2.4 NO的测定: 取0.1 mL血清置测定管, 0.1 mL硝酸钾标准液置标准管, 0.1 mL双蒸水置空白管, 试剂按说明书操作, 于550 nm波长处比色, 分别读取测定管和标准管吸光值, 计算NO含量.
1.2.5 免疫组化检测NF-κB和MAdCAM-1: 结肠组织石蜡切片常规脱蜡、水化; 高压抗原热修复, 修复液为0.01 mmol/L柠檬酸盐缓冲液; 用30 mL/L H2O2消除内源性过氧化物酶活性: 正常山羊血清封闭; NF-κB一抗为小鼠IgG mAb(稀释度1:500), 4 ℃冰箱过夜, MAdCAM-1一抗为大鼠来源的抗小鼠IgG2α抗体(稀释度1:50), 37 ℃孵育2.5 h; 滴加各自相应生物素化二抗; 滴加辣根酶标记链霉卵白素; DAB显色, 苏木素复染, 梯度酒精脱水、二甲苯透明, 中性树胶封片. 每次实验均设立空白对照, 以0.01 mol/L PBS代替一抗作为空白对照. 应用ImagePro-Plus生物图像分析软件统计免疫组化切片累积光密度(integrated optical density, IA)值.
统计学处理 应用软件SPSS13.0进行统计分析, 计量资料采用mean±SD表示. 计量资料的多组间用ONE-WAY ANOVA, 两组间采用t检验, 两组间相关性用Spearman秩相关分析. 双侧检验, 以P<0.05有统计学意义.
正常对照组小鼠体质量逐渐增高, 大便性状正常, 而唑酮结肠炎组和GTN组小鼠灌肠后体质量明显下降, 表现为稀便或不成形黏肛便, 便血或粪便隐血阳性, DAI评分逐渐升高, DETA NONOate干预组小鼠体质量较轻, DAI评分比恶唑酮结肠炎组低.
正常对照组小鼠结肠黏膜无充血水肿、糜烂及溃疡形成, 而恶唑酮结肠炎组和GTN治疗组小鼠结肠黏膜可见明显充血水肿、糜烂, 浅小溃疡多少不等, 附有脓性分泌物, 病变连续分布, 大体评分高于正常对照组(P<0.01), DETA NONOate干预组小鼠可见充血水肿, 但糜烂及溃疡少见, 无脓性分泌物, 大体评分较恶唑酮结肠炎组及GTN干预组均低(P<0.01). 组织学上, 正常对照组小鼠结肠黏膜上皮完整, 腺体形态正常、排列整齐, 黏膜及黏膜下层无炎症细胞浸润, 未见糜烂及溃疡. 恶唑酮结肠炎组及GTN干预组小鼠结肠黏膜上皮损伤、缺失、糜烂及溃疡形成, 腺体变形、排列紊乱, 黏膜及黏膜下层见密集分布的淋巴细胞和单核细胞浸润. DETA NONOate干预组小鼠可见结肠黏膜上皮损伤, 偶见糜烂, 未见溃疡形成, 腺体排列基本正常, 黏膜及黏膜下层白细胞浸润少(表1).
恶唑酮结肠炎组小鼠结肠组织的MPO活性较正常对照组小鼠明显增高(P<0.01), 而DETA NONOate干预组小鼠结肠组织的MPO活性较恶唑酮结肠炎组(P<0.01)及GTN干预组小鼠低(P<0.05, 表1).
恶唑酮结肠炎组小鼠血清NO浓度较正常对照组小鼠增高(P<0.05), GTN干预组和DETA NONOate干预组小鼠血清NO浓度高于恶唑酮结肠炎组(P<0.05, 表1).
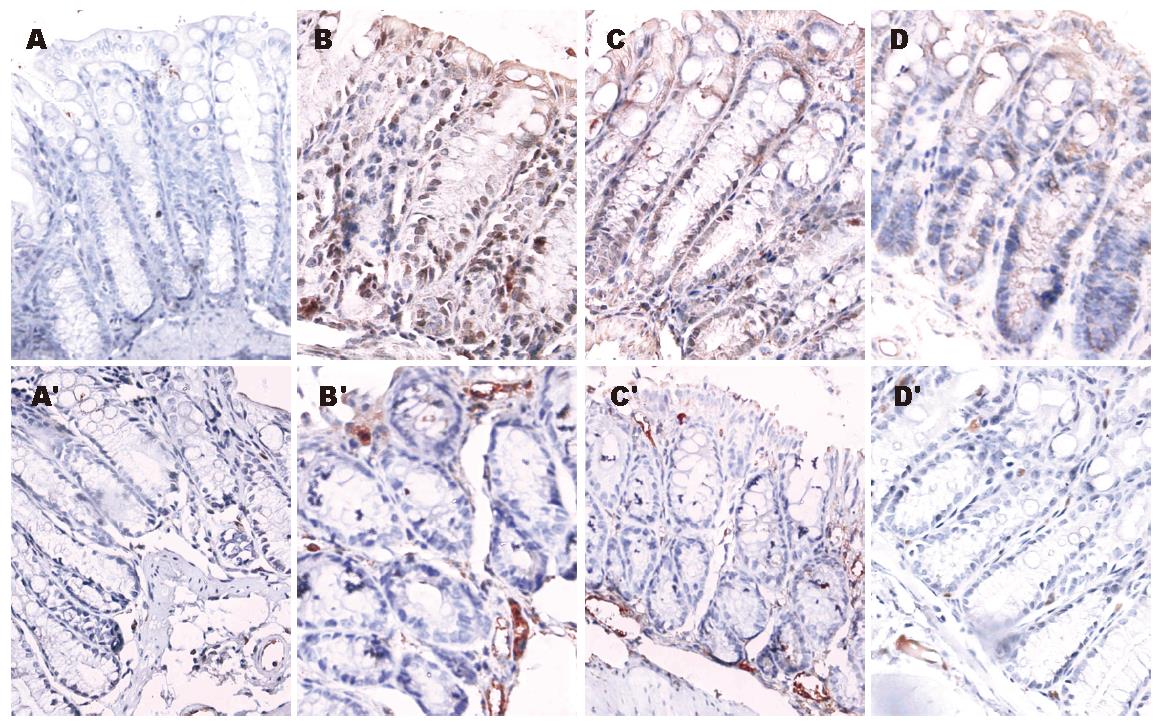
正常对照组小鼠结肠黏膜上皮细胞、隐窝上皮、固有层单个核细胞只微弱或不表达NF-κB P65, 而恶唑酮结肠炎组小鼠结肠黏膜NF-κB P65表达增强, 且上皮表达呈连续分布, 阳性细胞胞质和胞核都含有棕黄色颗粒, 以胞核表达为主. 用GTN干预后, 小鼠结肠黏膜NF-κB P65表达无明显改变, 而用DETA NONOate干预后结肠黏膜NF-κB P65表达明显降低, IA值与恶唑酮结肠炎组相比有统计学意义(P<0.01). 正常对照组小鼠结肠派伊尔结(PP), 黏膜固有层中血管没有或者很少表达MAdCAM-1, 黏膜上皮细胞不表达MAdCAM-1, 恶唑酮结肠炎组和GTN干预组小鼠结肠PP, 黏膜固有层中血管内皮均明显地表达MAdCAM-1, IA值明显高于正常对照组(P<0.01), 而DETA NONOate干预组小鼠结肠PP, 黏膜固有层中血管MAdCAM-1表达明显降低, IA值与恶唑酮结肠炎组及GTN组相比都有统计学意义(P<0.05). 而且, MAdCAM-1 IA值与组织学评分(r = 0.786, P<0.05)、MPO活性(r = 0.833, P<0.05)和NF-κB P65累积光密度值(r = 0.833, P<0.05)均呈正相关(图1, 表2).
炎症性肠病组织学上均有白细胞, 特别是淋巴细胞, 自血管向肠道组织内的渗出, 从而导致慢性肠道炎症, 淋巴细胞向肠道组织的归巢是由各种归巢受体调节的. 在正常情况下, 人类MAdCAM-1分子特异性地表达于派伊尔结(peyer's patch, PP)、肠系膜淋巴结的高内皮静脉, 以及大、小肠黏膜固有层中的扁平血管内皮细胞表面, 极少表达于肠道外组织[5].
本研究发现, MAdCAM-1在恶唑酮结肠炎结肠黏膜固有层及黏膜下层微血管的表达明显高于正常对照组, 并且与组织学评分、MPO活性和NF-κB P65 IA值呈正相关. 这与以往的研究结果是相吻合的, Arihiro et al[6]对手术切除标本MAdCAM-1的表达研究发现, IBD炎症黏膜的小静脉丰富地表达MAdCAM-1. 在人类IBD中, MAdCAM-1表达的增加提示其可能介导淋巴细胞与内皮细胞的结合及向炎症部位的渗出.
最近, 开发阻断淋巴细胞向肠黏膜浸润的药物成为一类新型的生物治疗方向, 针对黏附分子的生物治疗剂开始应用于临床试验, 如抗细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)反义寡核苷酸(ISIS-2302, Alicaforsen)[7]和抗α4-整合素的抗体(Natalizumab), 但是有报道应用Natalizumab可能导致致死性的进行性多灶性白质脑病[8]. 由于MAdCAM-1在胃肠道表达的选择性, 使MAdCAM-1成为一个值得考虑的靶标. 已有研究应用抗体[5]及反义核苷酸[9]抑制MAdCAM-1的表达研究, 但至今还没有应用NO抑制MAdCAM-1表达的报道.
以往的研究提示肠道炎症时存在内皮细胞功能异常及NO合成的失调[10]. 在TNBS诱导的结肠炎模型中, NO-美沙拉嗪(NCX-456)比美沙拉嗪更有效地缓解了肠道的炎症[11], 提示NO可能在结肠炎中具有重要的保护作用. DETA NONOate属于NO供体中的偶氮烯嗡醇盐类(Diazeniumdiolates, NONOates), 这一类药物可以预知NO的释放速率, 在溶液中可自发产生NO. 在0.1 mol磷酸盐缓冲液(pH7.4)中, DETA NONOate的半衰期在37 ℃及22-25 ℃中分别是20 h及56 h. 本实验显示长效的DETA NONOate比短效的GTN可以更有力地抑制MAdCAM-1在肠道组织的表达, 从而起抗炎的作用, 而且持续的NO对MAdCAM-1的抑制是必须, 这与Oshima et al[12]的研究结果相符. 同时, 也有研究提示DETA NONOate可以通过抑制ICAM-1, P-选择素等黏附分子的表达, 减少白细胞的聚集及致炎因子的合成, 从而显著地改善DSS结肠炎[13].
本实验发现MAdCAM-1的表达与NF-κB的表达呈正相关. 对小鼠内皮细胞培养基及多种动物结肠炎模型的研究都表明, 在应用肿瘤坏死因子(tumor necrosis factor-α, TNF-α), 白介素-1β(interleukin-1β, IL-1β)等炎症因子刺激后, MAdCAM-1的表达增加, 然而, 其信号传导途径仍未完全清楚, 研究提示可能需要NF-κB的活化. TNF-α, IL-1β与其对应受体相互作用, 通过激活NF-κB诱导激酶(NF-κB-inducing kinase, NIK), 最终导致NF-κB抑制因子(inhibitor-κB, IκBα)的降解, IκBα与NF-κB p50/p65异二聚体脱离, NF-κB移位至细胞核, 结合到hMAdCAM-1基因后激活了MAdCAM-1的基因转录[14-15]. NO供体可能通过清除细胞因子诱导的信号性氧化剂或抑制信号途径中对多肽如IκB的共价修饰, 从而抑制NF-κB对MAdCAM-1转录的激活. 其他信号通路如p38, p42/44丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)和转录因子如SP1可能也参与NF-κB依赖基因的活化和NO介导细胞因子对MAdCAM-1的调节作用[16]. 对这些信号途经的理解可能使我们更好地揭示MAdCAM-1在IBD中的作用.
MAdCAM-1分子在肠道黏膜组织的选择性表达提示其在肠道黏膜免疫中具有重要作用, 以MAdCAM-1为靶标的生物治疗可以减少副作用. 对MAdCAM-1分子在IBD慢性炎症中的表达及抑制其表达的研究, 有利于进一步认识IBD发病的病理生理过程, 为设计以MAdCAM-1分子为基础的预防与治疗措施提供全新的思路.
MAdCAM-1与淋巴细胞表面配体α4β7-整合素及L-选择素的结合, 参与了淋巴细胞附壁滚动, 活化与黏附, 介导特定淋巴细胞亚群向肠道黏膜淋巴组织如派伊尔结及固有层的归巢. 淋巴细胞向肠道的渗出, 诱导并维持肠道的慢性炎症.
李永哲, 副教授, 中国医学科学院中国协和医科大学, 北京协和医院检验科.
多个对IBD患者及动物模型的研究中, 均发现在IBD肠道血管内皮细胞MAdCAM-1的表达明显增高, 而且UC与CD的表达模式是不同的; MAdCAM-1在多种动物结肠炎模型的表达均增加, 而免疫中和MAdCAM-1在结肠炎模型中可以缓解炎症和黏膜的损害.
已有研究应用抗体及反义核苷酸抑制MAdCAM-1的表达及应用NO抑制其他黏附分子表达的研究, 但至今尚未有应用NO抑制MAdCAM-1表达的报道. 由于MAdCAM-1特异性表达于胃肠道, 以MAdCAM-1为靶标的生物治疗可以减少以其他黏附分子为靶标的生物治疗所带来的肠道外副作用.
淋巴细胞归巢: 是淋巴细胞的定向游动, 包括成熟淋巴细胞向外周淋巴器官归巢, 淋巴细胞再循环, 以及淋巴细胞向炎症部位迁移. 其分子基础是称之为淋巴细胞归巢受体的黏附分子与内皮细胞上相应的血管地址素黏附分子的相互作用.
本文研究内容较新, 实用性强, 具有一定的临床参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Heller F, Fuss IJ, Nieuwenhuis EE, Blumberg RS, Strober W. Oxazolone colitis, a Th2 colitis model resembling ulcerative colitis, is mediated by IL-13-producing NK-T cells. Immunity. 2002;17:629-638. [PubMed] [DOI] |
| 2. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] |
| 3. | Ekström GM. Oxazolone-induced colitis in rats: effects of budesonide, cyclosporin A, and 5-aminosalicylic acid. Scand J Gastroenterol. 1998;33:174-179. [PubMed] [DOI] |
| 5. | Briskin M, Winsor-Hines D, Shyjan A, Cochran N, Bloom S, Wilson J, McEvoy LM, Butcher EC, Kassam N, Mackay CR. Human mucosal addressin cell adhesion molecule-1 is preferentially expressed in intestinal tract and associated lymphoid tissue. Am J Pathol. 1997;151:97-110. [PubMed] |
| 6. | Arihiro S, Ohtani H, Suzuki M, Murata M, Ejima C, Oki M, Kinouchi Y, Fukushima K, Sasaki I, Nakamura S. Differential expression of mucosal addressin cell adhesion molecule-1 (MAdCAM-1) in ulcerative colitis and Crohn's disease. Pathol Int. 2002;52:367-374. [PubMed] [DOI] |
| 7. | Yacyshyn BR, Chey WY, Goff J, Salzberg B, Baerg R, Buchman AL, Tami J, Yu R, Gibiansky E, Shanahan WR. Double blind, placebo controlled trial of the remission inducing and steroid sparing properties of an ICAM-1 antisense oligodeoxynucleotide, alicaforsen (ISIS 2302), in active steroid dependent Crohn's disease. Gut. 2002;51:30-36. [PubMed] [DOI] |
| 8. | MacDonald JK, McDonald JW. Natalizumab for induction of remission in Crohn's disease. Cochrane Database Syst Rev. 2007;CD006097. [PubMed] [DOI] |
| 9. | Goto A, Arimura Y, Shinomura Y, Imai K, Hinoda Y. Antisense therapy of MAdCAM-1 for trinitrobenzenesulfonic acid-induced murine colitis. Inflamm Bowel Dis. 2006;12:758-765. [PubMed] [DOI] |
| 10. | Kocaman O, Sahin T, Aygun C, Senturk O, Hulagu S. Endothelial dysfunction in patients with ulcerative colitis. Inflamm Bowel Dis. 2006;12:166-171. [PubMed] [DOI] |
| 11. | Santucci L, Wallace J, Mencarelli A, Farneti S, Morelli A, Fiorucci S. Different sensitivity of lamina propria T-cell subsets to nitric oxide-induced apoptosis explains immunomodulatory activity of a nitric oxide-releasing derivative of mesalamine in rodent colitis. Gastroenterology. 2005;128:1243-1257. [PubMed] [DOI] |
| 12. | Oshima T, Jordan P, Grisham MB, Alexander JS, Jennings M, Sasaki M, Manas K. TNF-alpha induced endothelial MAdCAM-1 expression is regulated by exogenous, not endogenous nitric oxide. BMC Gastroenterol. 2001;1:5. [PubMed] [DOI] |
| 13. | Salas A, Gironella M, Salas A, Soriano A, Sans M, Iovanna J, Piqué JM, Panés J. Nitric oxide supplementation ameliorates dextran sulfate sodium-induced colitis in mice. Lab Invest. 2002;82:597-607. [PubMed] [DOI] |
| 14. | Ando T, Jordan P, Wang Y, Itoh M, Joh T, Sasaki M, Elrod JW, Carpenter A, Jennings MH, Minagar A. MAdCAM-1 expression and regulation in murine colonic endothelial cells in vitro. Inflamm Bowel Dis. 2005;11:258-264. [PubMed] [DOI] |
| 15. | Oshima T, Pavlick KP, Laroux FS, Verma SK, Jordan P, Grisham MB, Williams L, Alexander JS. Regulation and distribution of MAdCAM-1 in endothelial cells in vitro. Am J Physiol Cell Physiol. 2001;281:C1096-C1105. [PubMed] |
| 16. | Teramoto K, Miura S, Tsuzuki Y, Hokari R, Watanabe C, Inamura T, Ogawa T, Hosoe N, Nagata H, Ishii H. Increased lymphocyte trafficking to colonic microvessels is dependent on MAdCAM-1 and C-C chemokine mLARC/CCL20 in DSS-induced mice colitis. Clin Exp Immunol. 2005;139:421-428. [PubMed] [DOI] |