修回日期: 2008-02-10
接受日期: 2008-02-15
在线出版日期: 2008-02-28
目的: 研究植物药洪天肝康(HTGK)对小鼠实验性肝硬化的防治作用.
方法: 将ICR♀小鼠, 随机分成正常对照组、模型组、预防组和治疗组. 正常对照组: 室温下常规饲养; 模型组: ip 200 mL/L CCl4; 预防组: ip 200 mL/L CCl4同时给予HTGK灌服; 治疗组: 造模d 180开始给予HTGK灌服, 同时继续ip 200 mL/L CCl4. 模型组和预防组于60、90、180 d; 治疗组于30、60、90 d分别进行肝脏B超检测, 并取出肝脏组织进行HE、VG染色和PAS反应, 以观察其组织病理学的变化. 应用免疫组织化学方法进行肝组织中转化生长因子-β1(TGF-β1)和α-平滑肌肌动蛋白(α-SMA)的标记, 以探讨HTGK的作用途径. TGF-β1和α-SMA的阳性标记物应用图像分析仪进行定量测定.
结果: 模型组肝脏呈重度变性及炎性细胞浸润, 可见纤维条索形成; 预防组较模型组肝纤维化程度轻; 治疗组显示正常肝细胞数量增多, 肝纤维化程度明显减轻. 模型组TGF-β1、α-SMA阳性反应物与正常对照组相比显著增加(TGF-β1, 60 d: 0.269 vs 0.155; 90 d: 0.306 vs 0.155; 180 d: 0.336 vs 0.160; α-SMA, 60 d: 0.269 vs 0.150; 90 d: 0.299 vs 0.155; 180 d: 0.322 vs 0.160, 均P<0.01); 治疗组TGF-β1、α-SMA阳性反应物与模型组相比显著降低(0.220, 0.203, 0.185 vs 0.336, P<0.01; 0.245, 0.211, 0.185 vs 0.322, P<0.01).
结论: 植物药HTGK对肝硬化的形成具有积极的干预作用.
引文著录: 杨锐华, 许晴, 乔岩岩, 贾洪章, 史小林. 植物药洪天肝康防治小鼠肝硬化的药效. 世界华人消化杂志 2008; 16(6): 582-589
Revised: February 10, 2008
Accepted: February 15, 2008
Published online: February 28, 2008
AIM: To investigate the prevention and treatment of Hong Tian Gan Kang (HTGK) on experimental hepatic cirrhosis.
METHODS: The female ICR mice were allocated into traditional Chinese medicine (HTGK) prevention group, treatment group, animal model group, and control group. During the process of inducing hepatocirrhosis by CCl4 celiac injection in ICR mice, the HTGK group received HTGK per day, while the model group was created into the animal model by the above means without treatment. The mice of control group were normally raised without being created into models. The control group, animal model group and (HTGK) prevention group were sacrificed randomly at the end of the 60 d, 90 d and 180 d; while treatment group was sacrificed randomly at the end of the 30 d, 60 d and 90 d. Tissue specimens were taken. Animals received liver histopathology and ultrastructure test.
RESULTS: Up to day 180, marked hepatic fatty changes, inflammation, necrosis and fibrosis were observed in mice of model group. In contrast, these alternations were attenuated by HTGK administration although mild fatty changes remained. Compared with the CCl4-induced cirrhotic mice, histological changes of fibrosis were improved significantly in the mice treated with HTGK. Liver histopathology showed that the contents of transforming growth factor-β1 (TGF-β1) and alpha-smooth muscle actin (α-SMA) in the animal model group were significantly higher than those in the control group (TGF-β1, 60 d: 0.269 vs 0.155; 90 d: 0.306 vs 0.155; 180 d: 0.336 vs 0.160; α-SMA, 60 d: 0.269 vs 0.160; 90 d: 0.299 vs 0.150; 180 d: 0.322 vs 0.155, P < 0.01). However, the contents of TGF-β1 and α-SMA in the therapy group were significantly lower than those in the model group (0.220, 0.203, 0.185 vs 0.336, P < 0.01; 0.2451, 0.2113, 0.185 vs 0.3217, P < 0.01).
CONCLUSION: HTGK has suppressive, preventive and curative effect on hepatic fibrosis and hepatocirrhosis.
- Citation: Yang RH, Xu Q, Qiao YY, Jia HZ, Shi XL. Experimental study of herbal-based medicine Hong Tian Gan Kang on the intervention and therapy for hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 582-589
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/582.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.582
肝硬化是严重危害人类健康的常见病之一, 也是导致肝癌的主要病因, 而肝纤维化是多种慢性肝病发展为肝硬化的必经阶段, 因此防治肝纤维化和肝硬化是当今医学领域的重要课题. 各种病因引起肝细胞弥漫性炎性坏死、再生、诱发肝脏广泛地纤维结缔组织增生、肝小叶结构破坏、假小叶形成, 纤维间隔包绕再生的肝细胞形成结节, 成为肝硬化[1-4]. 近年来, 国际上虽然对肝硬化的病原学治疗如抗乙肝病毒治疗取得了一定的成效, 但西医治疗肝硬化尚无特效疗法[5-13], 而中药却在治疗上表现出独特的优势. 近年来国内对中药及中药提取物靶向制剂的研究取得了较大的进展, 但大多处在基础研究阶段, 而且对中药制剂的研究大多数是以天然单一有效成分为原料药物. 深化肝硬化的中医病因病机学研究已成为提高肝硬化临床疗效亟待解决的重要问题. 首都医科大学与北京洪天医药技术研究所共同成功研制了抑制肝纤维化、逆转肝硬化的植物药洪天肝康(Hong Tian Gan Kang, HTGK). HTGK是应用现代工艺方法提取黄芪、半枝莲、白芍等纯植物原料中的皂甙、黄酮等有效活性成分, 依据益气解毒, 扶正祛邪维持机体的动态平衡的中医理论, 达到抑制肝纤维化和逆转肝硬化促进正常肝细胞增殖的药效作用, 最终达到防治肝硬化的目的. 为进一步证实HTGK逆转肝硬化的体内疗效, 我们将制备肝硬化的动物模型, 以动态观察植物药HTGK在肝硬化形成过程中对肝组织细胞的影响, 并探讨其可能的作用机制.
清洁级4 wk龄ICR♀小鼠80只, 体质量20-30 g, 购自首都医科大学动物中心. HTGK为北京洪天力药业有限公司提供. 分析纯CCl4为北京现代东方精细化学品有限公司生产. 兔抗鼠转化生长因子-β1(transforming growth factor, TGF-β1)抗体, 小鼠抗小鼠单克隆α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体, 购自武汉博士德生物工程有限公司.
将80只小鼠随机分成4组, 正常对照组, 模型组, 预防组, 治疗组, 每组20只. 肝硬化组: 每5 d进行小鼠ip 200 mL/L CCl4橄榄油溶液5 mL/kg. 预防组在制备肝硬化模型的同时(时间剂量同模型组), 每日给予80 mg/kg HTGK灌服, 每日分2次灌服. 治疗组造模180 d后, 给予80 mg/kg HTGK灌服, 每日分2次灌服, 同时继续ip 200 mL/L CCl4(时间剂量同模型组). 水合氯醛5 mL/kg将小鼠麻醉, 脱毛剂备皮, 将小鼠固定于操作台上, 使用高分辨率小动物超声系统(Vevo 770TM), 704探头扫描肝脏, 采集图像并进行比较分析. 肝硬化组分别于d 60、90、180; 预防组分别于d 60、90、180; 治疗组分别于d 30、60、90断髓取肝脏, Bouin液固定, 常规石蜡包埋.
1.2.1 组织病理学: 将石蜡包埋的肝组织, 制成4 μm厚的切片. 分别进行HE染色, VG(Van Gieson)染色和PAS(periodic acid-schiff)反应.
1.2.2 免疫组织化学: 切片脱蜡入水, 柠檬酸钠缓冲液热抗原修复, 30 mL/L H2O2封闭内源性过氧化物酶, 100 mL/L正常山羊血清抑制非特异性表达, 分别滴加一抗(兔抗鼠TGF-β1抗体, 稀释度1:100; 小鼠抗小鼠单克隆α-SMA抗体, 稀释度1:100), 4 ℃过夜, 分别滴加二抗(生物素化山羊抗兔IgG, 稀释度1:200; 山羊抗小鼠IgG抗体-HRP多聚体, 稀释度1:200), DAB显色. 阴性对照以PBS替代TGF-β1和α-SMA抗体. 应用LEICA Q500IW自动图像分析仪检测40倍物镜下, 测定免疫反应阳性细胞的吸光度(A). 并求其平均吸光度A值.
统计学处理 实验所得数据采用SPSS11.0统计软件进行单因素方差分析及其相关性分析.
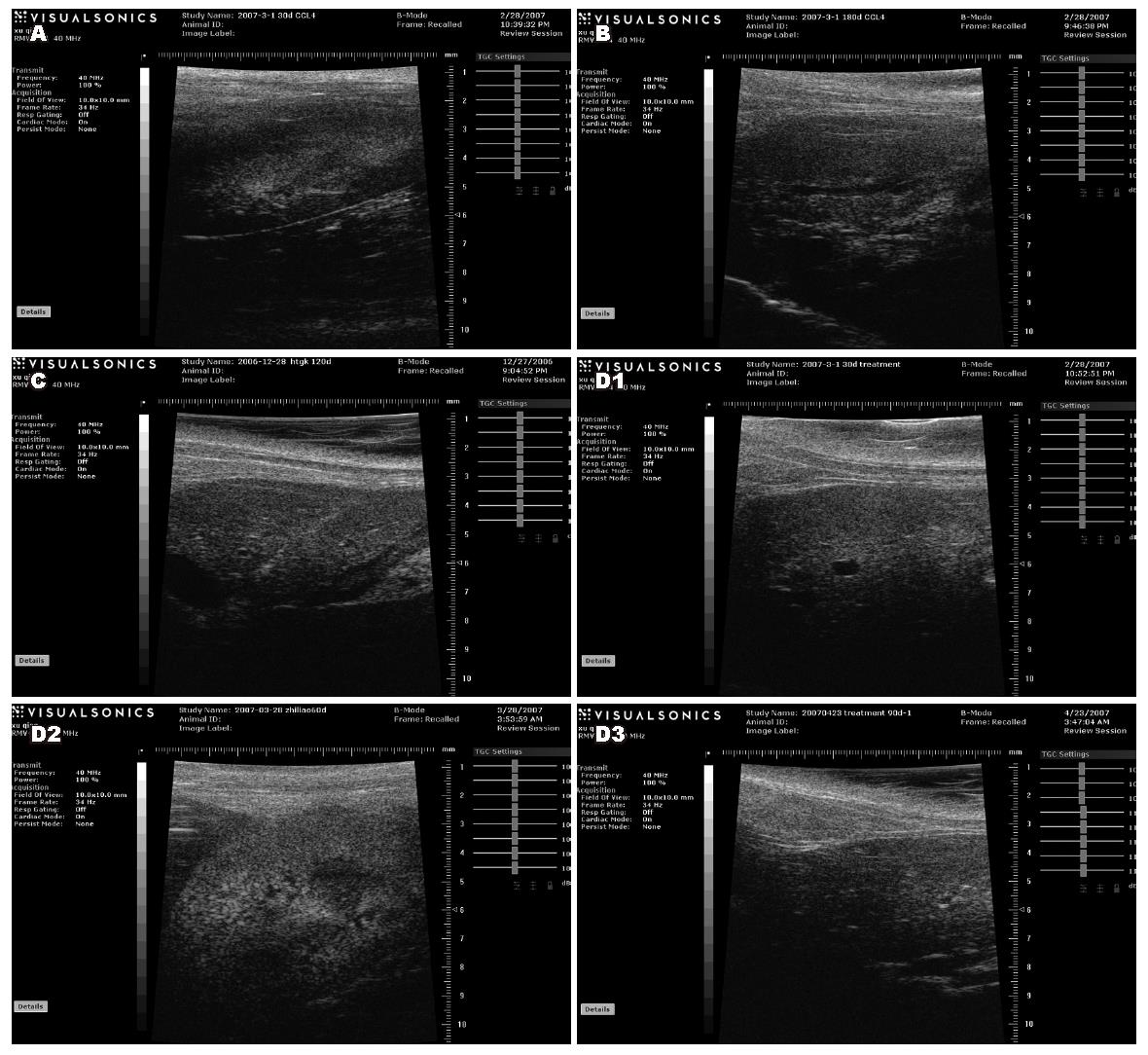
正常对照组小鼠肝脏表面光亮, 颜色暗红, 边缘锐利, 大小及各叶的比例均正常, 模型组小鼠肝脏表面光亮度下降, 表面有小米粒样改变, 呈暗紫红色, 边缘圆钝, 质脆, 体缩小, 有的与周围组织有黏连, 且脾肿胀明显. 预防组小鼠肝脏表面较光滑, 边缘微钝, 呈浅褐色, 肝肿大不明显, 未见明显脾肿胀. 治疗30 d小鼠肝脏肿大, 表明粗糙, 呈深褐色; 治疗60 d小鼠肝脏表面逐渐光滑, 颜色呈浅褐色; 治疗90 d小鼠肝脏肿大不明显, 呈暗红色. 与正常对照组比, 模型组肝表面呈中度锯齿状回声, 肝实质回声明显增强, 其中细点状分布明显增多, 预防组: 肝表面呈低度锯齿状回声, 肝实质回声减弱, 治疗组: 肝表面锯齿状回声不明显, 肝实质回声减弱, 其中点状分布不明显(图1).
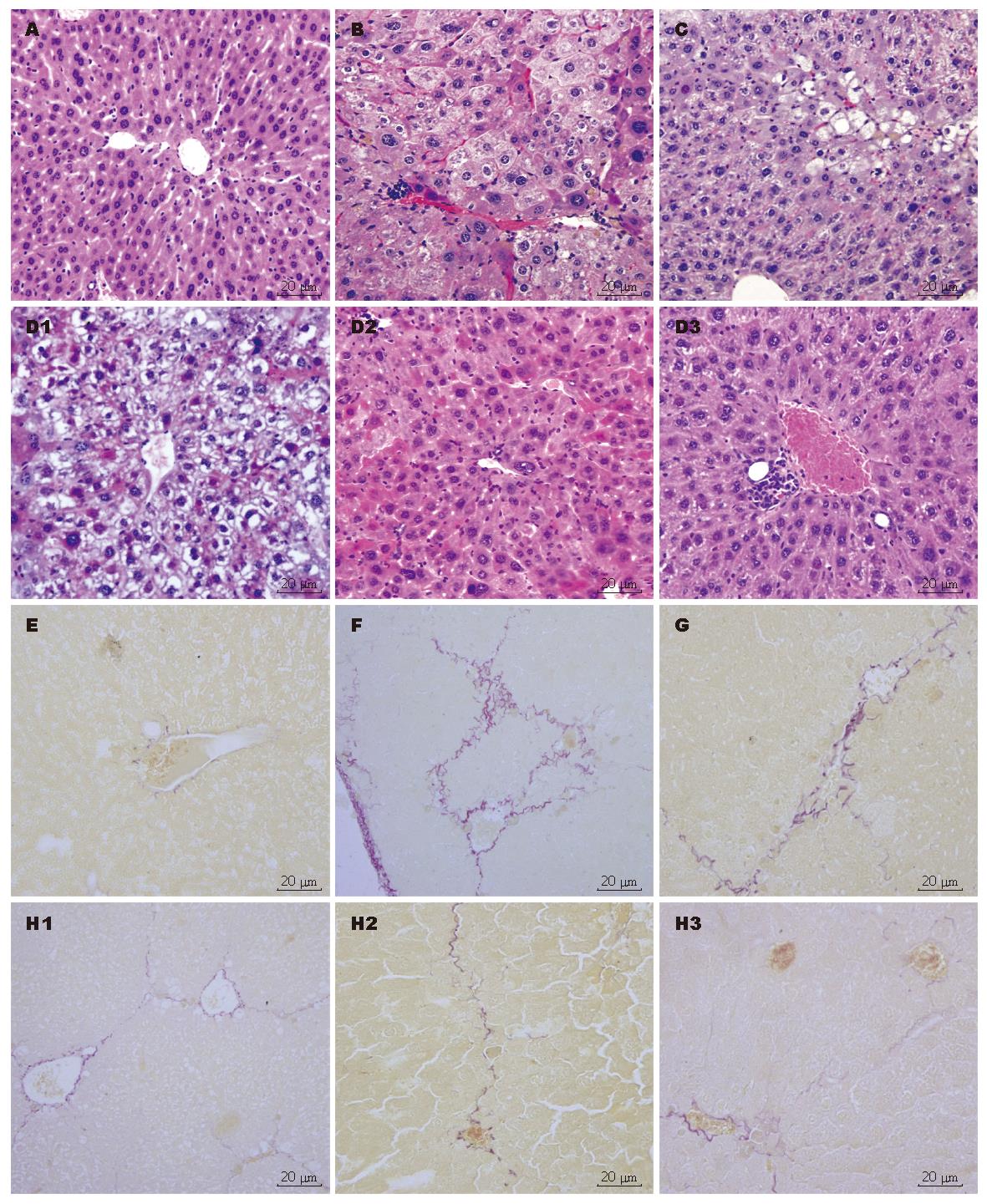
HE染色正常对照组肝脏肝小叶结构正常, 肝细胞索排列规则有序, 未见脂肪变性、坏死, 无纤维增生; 模型组可见肝小叶结构紊乱, 肝细胞索失去放射状肝索结构, 纤维结缔组织增生形成纤维条索, 纤维宽窄不一, 分隔肝组织形成假小叶, 纤维间隔内可见慢性炎性细胞浸润, 部分肝细胞呈脂肪变; 预防组可见纤维组织增生减轻, 间隔内少量炎性细胞浸润, 肝细胞空泡样变性; 治疗组30 d, 可见纤维组织增生减轻, 大量的肝细胞均呈空泡样或脂肪样变性, 核固缩, 中央静脉周围可见形态趋于正常的肝细胞; 治疗组60 d, 变性坏死的肝细胞减少, 出现大量形态近似正常的肝细胞; 治疗90 d: 形态近似正常的肝细胞进一步增加. VG染色正常对照组未见明显的呈红褐色的胶原纤维; 模型组可见胶原纤维显著增多, 主要分布于被膜下、肝小叶间和中央静脉周围; 与模型组相比, 预防组和治疗组胶原纤维数量明显减少, 尤治疗组减少明显(图2). PAS染色正常对照组肝细胞内含较多的呈紫红色的PAS阳性反应物; 模型组可见肝细胞内的PAS阳性反应物显著减少; 与模型组相比, 预防组和治疗组肝细胞内的PAS阳性反应物增多, 尤治疗组增多明显.
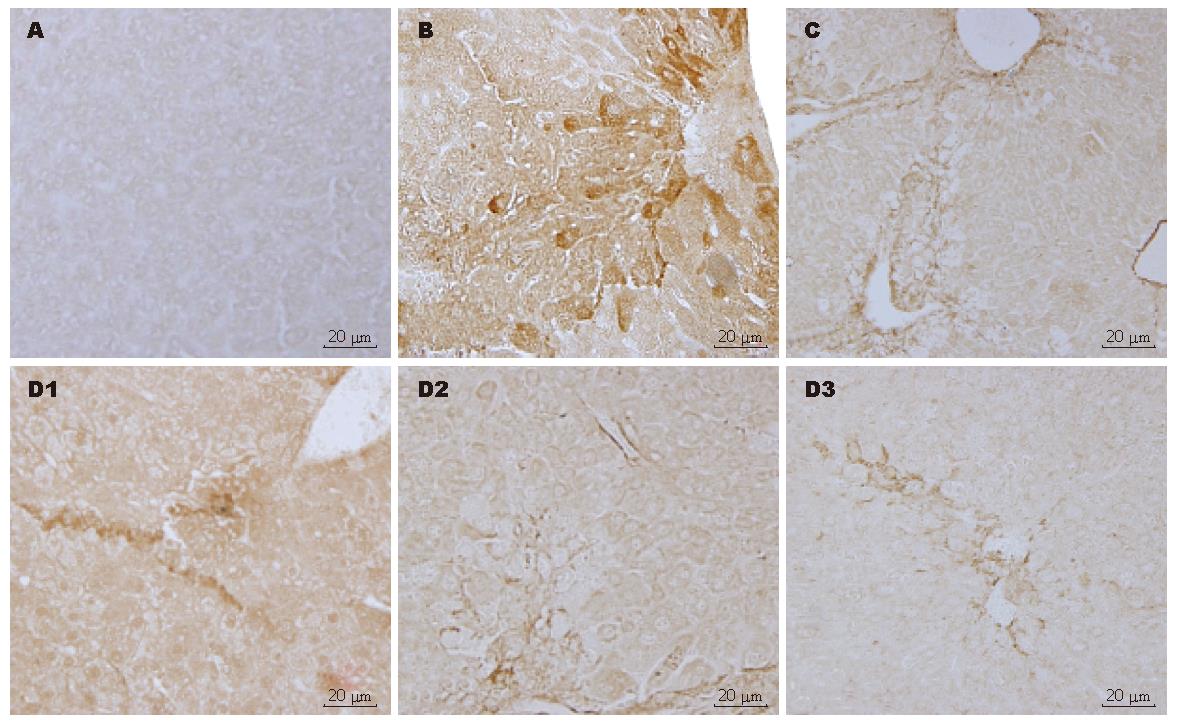
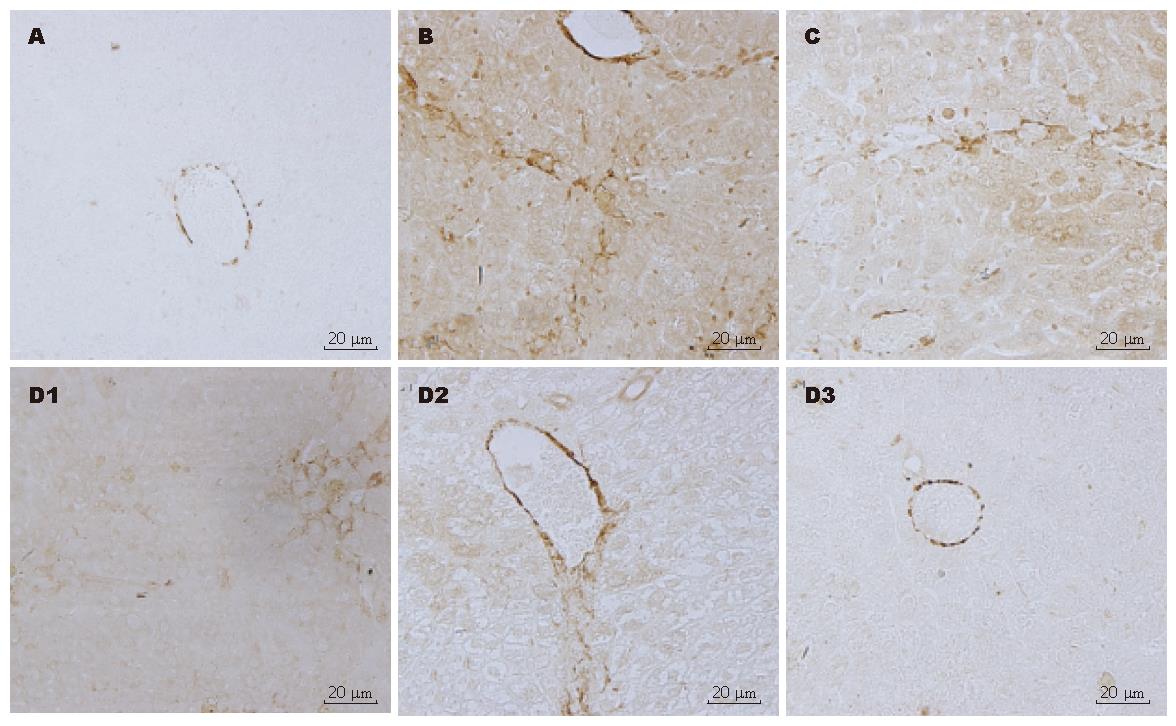
正常对照组肝脏中偶见TGF-β1表达; 模型组肝组织TGF-β1蛋白广泛分布, 尤集中于肝脏汇管区和增生的胶原间质, 着色呈均匀的浅棕色至深棕色; 预防组和治疗组阳染程度较模型组减轻, 尤治疗组明显(图3). 正常对照组肝脏中α-SMA阳性细胞较少, 多分布在小静脉周围; 模型组α-SMA蛋白分布广泛, 尤集中于增生的胶原间质, 着色呈均匀的浅棕色至深棕色; 预防组和治疗组(图4)阳染程度较模型组减轻, 尤治疗组明显. TGF-β和α-SMA平均吸光密度见表1.
慢性肝病所致的持续或反复的肝实质炎症及坏死, 可引起纤维结缔组织大量增生. 因其降解活性相对或绝对不足, 导致大量细胞外基质的沉积形成肝纤维化. 肝纤维化同时伴有肝小叶结构的破坏(肝再生结节), 则称肝硬化. 本实验研究借助西医对肝硬化鉴定指标, 即肝脏结构被损坏、纤维化组织增生、纤维性结节的出现为标准, 观察植物药HTGK防治肝硬化的药效作用.
中医早在两千多年《灵枢·水胀篇》指出: "色苍黄, 腹筋起, 此其候也", 说明前人对肝硬化已有深刻认识. 现代中医认为肝硬化的基本病机是正衰邪盛, 肝郁脾肾气血虚, 导致血瘀. 血瘀表现在肝硬化的病理上就是肝纤维化的形成. 故治疗以益气养阴、柔肝舒郁, 佐以活血化瘀为主. HTGK属植物药, 采取益气解毒, 扶正祛邪的中医理论, 应用现代工艺提取黄芪、半枝莲、白芍等纯植物原料中的皂甙、黄酮等有效的活性成分, 通过健脾益气、活血化瘀、疏肝理气、软坚散结、利水消肿来维持机体的动态平衡, 防治肝硬化的形成. 皂甙、黄酮已被证实具有保肝护肝、抗肿瘤[14]、抗氧化、抗菌、抗病毒等作用[15-18]. Kimura et al[19]发现皂甙及类似物是肝细胞分裂素, 能诱导肝细胞DNA的合成. 皂甙对鼠和人类肝脏特有的有机阴离子转运多肽具有抑制作用, 并且是他的一种运输底物[20]. 天然黄酮类化合物是植物体多酚类的内信号分子及中间体或代谢物. 现代药理研究表明, 该类化学物质在心血管系统、内分泌系统和抗肿瘤方面具有明显的药理作用. 特别是黄酮类化合物的抗氧化性质, 引起学者们的广泛关注.
我们在制备肝硬化模型时, 使用HTGK灌服进行干预, 结果预防(干预)组各项指标均优于模型组, 特别是沿汇管区周的纤维增生程度显著降低, 而肝细胞内糖原含量可见明显增加. 肝糖原是由许多葡萄糖分子聚合而成的物质, 正常状态下, 小肠黏膜细胞吸收单糖后, 由门静脉到达肝脏, 在肝内转变为肝糖原而贮存. 当机体需要时, 肝细胞又能把肝糖原分解为葡萄糖, 转化为能量, 所以患肝病时常可见肝糖原的改变, 因此肝糖原的含量变化可作为肝细胞功能状态的指标之一.
已有研究证实肝细胞变性坏死后, 可激活单核吞噬细胞系统产生各种细胞因子, 如TGF-β1、血小板衍生生长因子(platelet-derived growth factor, PDGF)、肿瘤坏死因子(tumor necrosis factor, TNF-α)等, 细胞因子介导的细胞-细胞相互作用, 以及基质-细胞相互作用引起的肝星状细胞(hepatic stellate cell, HSC)的激活, 转化为肌成纤维细胞(myofibroblastic-like cell, MFBLC), 表达多种细胞因子及受体, 并大量合成肝脏细胞外基质(extracellular matrix, ECM), 而ECM的降解可引起肝纤维化的形成[21-24]. 甚至肝小叶改建, 假小叶形成, 导致肝硬化发生. 生理状况下, 位于肝窦间隙的HSC处于静止状态, 与维生素A的贮存和代谢有关. 肝损伤后, HSC被活化, 胞质中肌性骨架蛋白, 如α-SMA表达增多, 分泌胶原等ECM的能力明显增强, 因此, HSC是肝纤维化发生发展的核心环节. α-SMA是HSC活化的重要标志[25-26]. TGF-β1是组织修复和肝纤维化的重要细胞因子[27-29], 调控HSC的活化、增殖. 有研究表明, 肝组织TGF-β1表达水平与肝组织纤维化程度密切相关, 在反映早期肝纤维化方面较透明质酸、层黏连蛋白、Ⅳ型胶原三项常规指标更敏感. TGF-β1是维持肝脏内环境的相对稳定的细胞因子之一, TGF-β1具有免疫调节、细胞分化、ECM形成等多种作用. TGF-β1在炎症早期具有免疫刺激功能, 在炎症中后期具有免疫抑制活性, 能抑制Th1细胞亚群的激活与分化, 减少白介素2, 白介素12(IL 2, IL12)和干扰素γ(IFN2γ)等细胞因子的分泌[30]. Peter博士认为肝病患者体内普遍缺乏免疫诱导素, 导致肝脏长期处于免疫缺陷状态, 这也是肝脏疾病产生和久治不愈的根本原因. 如能让肝脏产生免疫力, 才能从源头上清除肝病素, 使肝病转阴后不复发.
本实验结果显示, HTGK下调TGF-β1蛋白表达方面作用显著, 可能是在降低炎性反应的同时阻止了HSC活化, 导致TGF-β1蛋白表达下调, 胶原合成减少, 通过解除免疫抑制增强机体免疫功能、促进肝细胞修复、改善机体整体的抗病能力, 但最终解析HTGK促进硬化肝组织结构修复的作用机制还有待于进一步研究.
药物的靶向性是指药物直接作用于靶区(靶器官、靶组织、靶细胞), 靶向给药可提高疗效, 降低全身毒副作用[31-32]. HTGK的研制使用了入肝经的植物药材和药引, 研究结果证实HTGK能有效的抗肝纤维化、防止肝硬化形成. 通过我们的实验研究进一步证实对中医药的研究必须立足于中医理论的整体观, 在解决病变部位这一主要矛盾外, 同时要调整机体的平衡, 增强免疫力, 以达到标本兼治的目的. 中医药理论既古老又现代, 在现代化技术发展的今天仍指导着医药现代化的发展, 并为靶向用药的研究指明了方向.
目前, 在我国, 原发性肝癌患者合并肝硬化者占53.9%-85.0%, 甚至高达90%以上. 因此防治肝纤维化和肝硬化是当今医学领域的重要课题. 西医治疗肝硬化尚无特效疗法, 而中药却在治疗上表现出独特的优势.
唐文富, 副教授, 四川大学华西医院中西医结合科.
当今研发热点集中在以下几个方面: 肝硬化的基因治疗, 肝干细胞移植, 中药复方多方位的靶向治疗.
本文通过动物体内实验, 证实了植物药洪天肝康可有效逆转肝纤维化, 并能刺激肝组织细胞的增殖. 研究结果证实复方植物药具有一药多靶的作用, 是当今西医治疗所不能比拟的.
本文通过动物体内试验验证洪天肝康疗效, 为进一步临床应用提供可靠依据.
本文书写流畅, 层次分明, 内容详实, 具有一定的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Hsu YC, Chiu YT, Cheng CC, Wu CF, Lin YL, Huang YT. Antifibrotic effects of tetrandrine on hepatic stellate cells and rats with liver fibrosis. J Gastroenterol Hepatol. 2007;22:99-111. [PubMed] [DOI] |
| 2. | Tillmann HL. Antiviral therapy and resistance with hepatitis B virus infection. World J Gastroenterol. 2007;13:125-140. [PubMed] [DOI] |
| 3. | Zhang LJ, Zheng WD, Shi MN, Wang XZ. Effects of interleukin-10 on activation and apoptosis of hepatic stellate cells in fibrotic rat liver. World J Gastroenterol. 2006;12:1918-1923. [PubMed] [DOI] |
| 4. | Lin YL, Lee TF, Huang YJ, Huang YT. Antiproliferative effect of salvianolic acid A on rat hepatic stellate cells. J Pharm Pharmacol. 2006;58:933-939. [PubMed] [DOI] |
| 5. | Bergheim I, Guo L, Davis MA, Lambert JC, Beier JI, Duveau I, Luyendyk JP, Roth RA, Arteel GE. Metformin prevents alcohol-induced liver injury in the mouse: Critical role of plasminogen activator inhibitor-1. Gastroenterology. 2006;130:2099-2112. [PubMed] [DOI] |
| 6. | Liu JY, Chen CC, Wang WH, Hsu JD, Yang MY, Wang CJ. The protective effects of Hibiscus sabdariffa extract on CCl4-induced liver fibrosis in rats. Food Chem Toxicol. 2006;44:336-343. [PubMed] [DOI] |
| 7. | Jonassen TE, Christensen S, Marcussen N, Petersen JS. Intrarenal octreotide treatment prevents sodium retention in liver cirrhotic rats: evidence for direct effects within the thick ascending limb of Henle's loop. Am J Physiol Renal Physiol. 2006;291:F537-F545. [PubMed] [DOI] |
| 8. | Ruddell RG, Oakley F, Hussain Z, Yeung I, Bryan-Lluka LJ, Ramm GA, Mann DA. A role for serotonin (5-HT) in hepatic stellate cell function and liver fibrosis. Am J Pathol. 2006;169:861-876. [PubMed] [DOI] |
| 9. | Liu SQ, Yu JP, Chen HL, Luo HS, Chen SM, Yu HG. Therapeutic effects and molecular mechanisms of Ginkgo biloba extract on liver fibrosis in rats. Am J Chin Med. 2006;34:99-114. [PubMed] [DOI] |
| 10. | Li Q, Liu DW, Zhang LM, Zhu B, He YT, Xiao YH. Effects of augmentation of liver regeneration recombinant plasmid on rat hepatic fibrosis. World J Gastroenterol. 2005;11:2438-2443. [PubMed] [DOI] |
| 11. | Jeong DH, Lee GP, Jeong WI, Do SH, Yang HJ, Yuan DW, Park HY, Kim KJ, Jeong KS. Alterations of mast cells and TGF-beta1 on the silymarin treatment for CCl(4)-induced hepatic fibrosis. World J Gastroenterol. 2005;11:1141-1148. [PubMed] [DOI] |
| 12. | Oakley F, Meso M, Iredale JP, Green K, Marek CJ, Zhou X, May MJ, Millward-Sadler H, Wright MC, Mann DA. Inhibition of inhibitor of kappaB kinases stimulates hepatic stellate cell apoptosis and accelerated recovery from rat liver fibrosis. Gastroenterology. 2005;128:108-120. [PubMed] [DOI] |
| 13. | Di Sario A, Bendia E, Taffetani S, Omenetti A, Candelaresi C, Marzioni M, De Minicis S, Benedetti A. Hepatoprotective and antifibrotic effect of a new silybin-phosphatidylcholine-Vitamin E complex in rats. Dig Liver Dis. 2005;37:869-876. [PubMed] [DOI] |
| 14. | Salvi M, Fiore C, Armanini D, Toninello A. Glycyrrhetinic acid-induced permeability transition in rat liver mitochondria. Biochem Pharmacol. 2003;66:2375-2379. [PubMed] [DOI] |
| 15. | Lin JC. Mechanism of action of glycyrrhizic acid in inhibition of Epstein-Barr virus replication in vitro. Antiviral Res. 2003;59:41-47. [PubMed] [DOI] |
| 16. | Romero MR, Efferth T, Serrano MA, Castaño B, Macias RI, Briz O, Marin JJ. Effect of artemisinin/artesunate as inhibitors of hepatitis B virus production in an "in vitro" replicative system. Antiviral Res. 2005;68:75-83. [PubMed] [DOI] |
| 17. | Cherng JM, Lin HJ, Hsu YH, Hung MS, Lin JC. A quantitative bioassay for HIV-1 gene expression based on UV activation: effect of glycyrrhizic acid. Antiviral Res. 2004;62:27-36. [PubMed] [DOI] |
| 18. | Tandon A, Tandon BN, Bhujwala RA. Clinical spectrum of acute sporadic hepatitis E and possible benefit of glycyrrhizin therapy. Hepatol Res. 2002;23:55-61. [PubMed] [DOI] |
| 19. | Kimura M, Inoue H, Hirabayashi K, Natsume H, Ogihara M. Glycyrrhizin and some analogues induce growth of primary cultured adult rat hepatocytes via epidermal growth factor receptors. Eur J Pharmacol. 2001;431:151-161. [PubMed] [DOI] |
| 20. | Ismair MG, Stanca C, Ha HR, Renner EL, Meier PJ, Kullak-Ublick GA. Interactions of glycyrrhizin with organic anion transporting polypeptides of rat and human liver. Hepatol Res. 2003;26:343-347. [PubMed] [DOI] |
| 21. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] [DOI] |
| 22. | Zhang X, Yu WP, Gao L, Wei KB, Ju JL, Xu JZ. Effects of lipopolysaccharides stimulated Kupffer cells on activation of rat hepatic stellate cells. World J Gastroenterol. 2004;10:610-613. [PubMed] [DOI] |
| 23. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |
| 24. | Gaça MD, Zhou X, Issa R, Kiriella K, Iredale JP, Benyon RC. Basement membrane-like matrix inhibits proliferation and collagen synthesis by activated rat hepatic stellate cells: evidence for matrix-dependent deactivation of stellate cells. Matrix Biol. 2003;22:229-239. [PubMed] [DOI] |
| 25. | Mathurin P, Xiong S, Kharbanda KK, Veal N, Miyahara T, Motomura K, Rippe RA, Bachem MG, Tsukamoto H. IL-10 receptor and coreceptor expression in quiescent and activated hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2002;282:G981-G990. [PubMed] [DOI] |
| 26. | Uchio K, Tuchweber B, Manabe N, Gabbiani G, Rosenbaum J, Desmoulière A. Cellular retinol-binding protein-1 expression and modulation during in vivo and in vitro myofibroblastic differentiation of rat hepatic stellate cells and portal fibroblasts. Lab Invest. 2002;82:619-628. [PubMed] [DOI] |
| 27. | Breitkopf K, Haas S, Wiercinska E, Singer MV, Dooley S. Anti-TGF-beta strategies for the treatment of chronic liver disease. Alcohol Clin Exp Res. 2005;29:121S-131S. [PubMed] |
| 28. | Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis. Liver Int. 2006;26:8-22. [PubMed] [DOI] |
| 29. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 30. | Fantini MC, Becker C, Tubbe I, Nikolaev A, Lehr HA, Galle P, Neurath MF. Transforming growth factor beta induced FoxP3+ regulatory T cells suppress Th1 mediated experimental colitis. Gut. 2006;55:671-680. [PubMed] [DOI] |
| 31. | Phillips KA, Veenstra DL, Sadee W. Implications of the genetics revolution for health services research: pharmacogenomics and improvements in drug therapy. Health Serv Res. 2000;35:128-140. [PubMed] |
| 32. | Muvaffak A, Gurhan I, Gunduz U, Hasirci N. Preparation and characterization of a biodegradable drug targeting system for anticancer drug delivery: microsphere-antibody conjugate. J Drug Target. 2005;13:151-159. [PubMed] [DOI] |