修回日期: 2007-12-20
接受日期: 2008-01-15
在线出版日期: 2008-02-18
目的: 探讨内源性生物素在结肠组织中的表达及其对免疫组化结果的影响.
方法: 14例结肠黏膜组织标本按不同的免疫学方法进行实验和分析.
结果: 8例出现内源性生物素阳性表达 (57.14%), 主要位于表面上皮细胞胞质, 尤其近基底侧. 15%蛋清封闭液可以封闭结肠组织中的内源性生物素. 传统SP法、SP法+15%蛋清液、PV-6002两步法和改进后的两步法Bax阳性表达数分别为12例(85.71%)、10例(71.43%)、4例(28.57%)和8例(57.14%), 在这四种方法中Bax中等强度以上表达数分别为10例、6例、0例和5例.
结论: 内源性生物素在结肠组织中主要表达在表面上皮细胞胞质, 尤其是近基底侧; 免疫组化时可首选生物素标记的检测系统.
引文著录: 高春, 王爱英, 韩亚京. 内源性生物素在结肠组织中的表达及其对免疫组化的影响. 世界华人消化杂志 2008; 16(5): 551-555
Revised: December 20, 2007
Accepted: January 15, 2008
Published online: February 18, 2008
AIM: To investigate the normal expression of endogenous biotin (EB) in colonic tissues and its influence on the results of immuno-histochemistry (IHC).
METHODS: Fourteen specimens were tested and analyzed with different immunology methods.
RESULTS: EB was expressed on the fundic endoplasm of surface epithelial cells in 8 of the 14 colonic tissue samples, and 15% egg white blocking fluid could eliminate EB in colonic tissues from human beings. Traditional SP, SP + 15% egg white blocking fluid, two-step PV-6002 and improved two-step PV-6002 showed that Bax was positively expressed in 12 (85.71%), 10 (71.43%), 4 (28.57%) and 8 (57.14%) colonic tissue samples, respectively, whereas moderately and strongly expressed in 10, 6, 0, and 5 colonic tissue samples, respectively.
CONCLUSION: Endogenous biotin is expressed mostly in the fundic endoplasm of surface epithelial cells in colonic tissue samples from human beings. The biotinylated detection system is the first choice of method during IHC.
- Citation: Gao C, Wang AY, Han YJ. Expression of endogenous biotin in colonic tissues and its influence on the results of immunohistochemistry. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 551-555
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/551.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.551
随着免疫组化技术在临床诊断和科学研究中获得越来越广泛的运用, 内源性生物素因其对免疫组化结果产生较大影响而受到极大关注. 常用的检测系统中, 包括SP、SABC和LSAB等, 均是用生物素标记的二抗, 而文献报道加热抗原修复会重新暴露内源性生物素的活性[1-2], 由此导致实验结果的假阳性也引起学者们的广泛关注[3]. 因为内源性生物素较多分布在线粒体中, 以往的研究过多的集中在含线粒体丰富的组织, 如肝脏、肾脏和乳腺等[4-5]. 而肠道作为内源性生物素产生的重要部位之一, 对其表达情况却研究甚少, 国内外文献中均未见报道.
目前, 免疫组化的检测系统较多, 既包括上述以SP为代表的生物素标记的三步法检测系统, 也包括许多非生物素标记的检测系统, 例如EnVision、PicTureTM、PowerVision等, 他们大都是简化的两步法检测系统. 后者显示较高的特异性, 而且敏感性也较高, 因此有学者认为, 内源性生物素含量丰富的组织应该放弃以SP为代表的生物素标记的三步法检测[6]. 本研究旨在通过不同的实验方法探讨内源性生物素在结肠组织中对免疫组化结果的影响.
结肠黏膜标本取自北京大学第三医院消化内镜中心, Bax一抗和SP检测系统由美国NeoMarkers公司提供, PV-6002为两步法的非生物素标记的检测系统, 购自北京中杉公司.
1.2.1 标本的制备: 结肠镜黏膜活检, 标本立即用40 g/L甲醛固定, 常规石蜡包埋, 4 µm厚连续切片, 每份标本均制作成8张免疫组化用的切片, 另有1张作HE染色.
1.2.2 蛋清封闭液的制备: 取新鲜鸡蛋蛋清, 无菌操作, 纱布过滤后4 ℃冰箱保存, 使用时用去离子水稀释成不同的浓度, 室温孵育均为30 min, 其后PBS冲洗3次, 每次各5 min.
1.2.3 免疫组化: (1)按照SP/PV-6002步骤进行; (2)抗原修复采用微波高火15 min, 修复液采用0.01 mol/L柠檬酸(pH 6.0); (3)对照设立包括阳性对照、阴性空白对照和阴性替代对照, 阳性对照由NeoMarkers公司提供, 空白对照由既往实验证实, 替代对照用PBS取代一抗.
1.2.4 实验方法: (1)切片脱蜡水化后常规使用过氧化氢液封闭内源性过氧化物酶活性, 使用血清减轻非特异性背景染色, 随之直接滴加SP液, DAB显色, 普通光学显微镜下观察; (2)在上一步基础上增加微波高温抗原修复, DAB显色和镜下观察; (3)微波抗原修复后增加蛋清封闭液的处理过程, 余同上; (4)传统的免疫组化SP法操作; (5)增加蛋清封闭液的处理后, 按照常规SP法操作; (6)按照PV-6002两步法说明书操作; (7)将PV-6002两步法的二抗作用条件由室温30 min改为37 ℃孵育60 min, 余仍按照说明书操作; (8) PV-6002两步法的操作, 不加一抗观察二抗的单一影响; (9)HE染色进行普通病理诊断, 并辅助免疫组化结果的判断.
1.2.5 结果判定: 记分参照Rahman et al的标准并作适当修改. 染色强度记分: 无色0分; 淡黄色1分; 黄色2分; 棕褐色3分. 阳性细胞数记分: <25%, 1分; 26%-50%, 2分; 51%-75%, 3分; >75%, 4分. 根据染色强度和阳性细胞数计分之和进行判断: 0分为阴性(-), 1-2分为弱阳性(+), 3-5分为阳性(++), 6-7分为强阳性(+++). 所有结果均经3位作者在病理医师帮助下分别阅片, 若有疑义共同商议后确定.
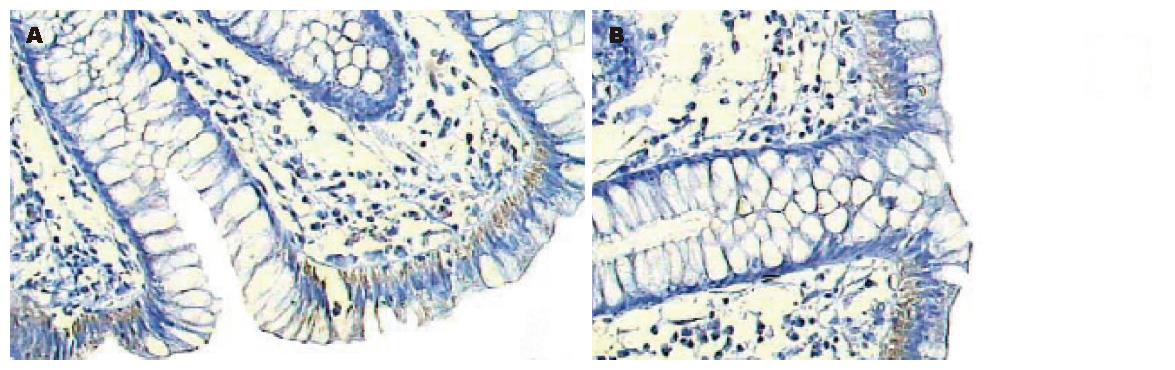
方法1和2操作前者反应是石蜡包埋结肠组织未经热修复的情况, 后者反应的是微波热修复后的情况. 前者均未见阳性表达; 后者出现明显的内源性生物素表达, 14份标本中8份出现阳性(57.14%), 其中中等强度以上的表达有6份(42.86%). 表达部位主要是在结肠黏膜表面上皮细胞的胞质, 且绝大多数在近核的基底侧(表1, 图1).
| 实验方法 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 001 | - | - | - | +++ | +++ | + | +++ | - |
| 002 | - | ++ | - | +++ | ++ | - | ++ | - |
| 003 | - | ++ | - | ++ | - | - | - | - |
| 004 | - | +++ | - | +++ | - | - | + | - |
| 005 | - | - | - | + | + | - | - | - |
| 006 | - | - | - | +++ | +++ | + | +++ | - |
| 007 | - | - | - | - | - | - | - | - |
| 008 | - | + | - | ++ | ++ | + | ++ | - |
| 009 | - | ++ | - | ++ | + | - | - | - |
| 010 | - | + | - | ++ | + | - | - | - |
| 011 | - | +++ | - | +++ | ++ | - | + | - |
| 012 | - | +++ | - | +++ | ++ | + | ++ | - |
| 013 | - | - | - | - | - | - | - | - |
| 014 | - | - | - | + | + | - | + | - |
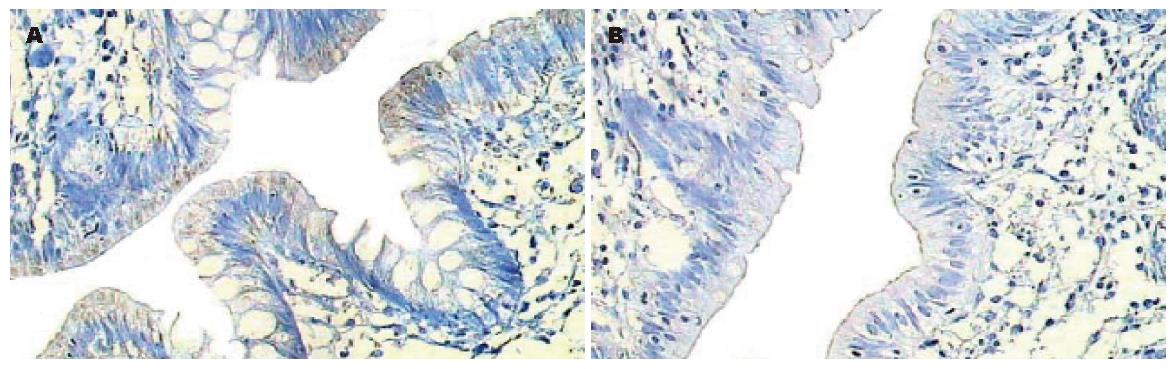
观察不同浓度的蛋清封闭液对结肠组织内源性生物素的封闭效果, 浓度分别为5%、15%和30%, 孵育均为室温30 min. 结果显示, 15%蛋清封闭液可以得到满意的效果, 内源性生物素被成功封闭(图2); 5%的蛋清封闭液不能完全封闭, 在内源性生物素表达部位存在部分着色, 但强度明显下降; 30%蛋清封闭液的封闭效果不满意, 整个背景均有轻微的着色. 15%蛋清封闭液的结果见表1.
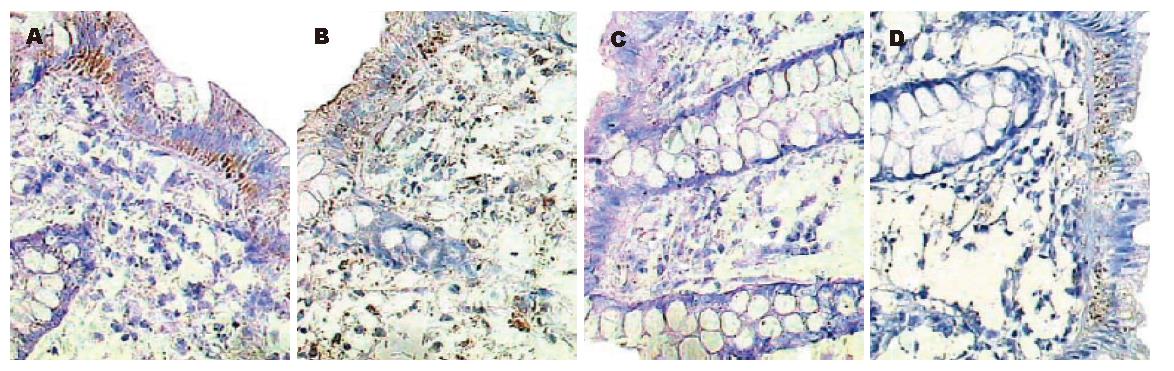
方法4反应的是未经蛋清封闭液处理, 用生物素标记SP系统的检测结果; 方法5反应的是经过蛋清封闭液封闭内源性生物素后, SP系统的检测结果; 方法6反应的是按说明书操作的两步法非生物素标记系统的检测结果; 方法7反应的是调整两步法检测系统二抗作用条件后的结果(图3).
4种方法的样本阳性数有明显差异, 其中方法4阳性数最多, 14例标本中有12例阳性(85.71%), 中等度以上表达的有10 例; 增加蛋清液封闭内源性生物素后(方法5), 阳性表达数降至10例(71.43%), 而中等度以上表达的仅有6例(42.86%). 增加了内源性生物素的封闭后, 原有的12例阳性标本中有7例出现不同程度的强度下降(58.33%), 甚至有2例均为中等强度以上表达的阳性标本从阳性直接转为阴性(表1).
更换两步法非生物素的检测系统后, 按照步骤操作(二抗作用条件为室温30 min)实验, 阳性数仅为4例(28.57%), 且强度均较弱, 无1例达到中等度及以上表达; 提高二抗的作用温度至37 ℃、延长作用时间至60 min, 阳性数上升至8例(57.14%), 其中中等度以上表达的有5例(35.71%), 仅略低于SP系统. 调整后的PV-6002系统与SP系统逐一比较, 14例标本中有9例检测结果完全一致, 5例存在差异, 其中4例PV-6002系统强度弱于SP系统, 3例SP法阳性而两步法为阴性, 仅有1例两步法为弱阳性而SP法为阴性. 方法8证实了非生物素检测系统的二抗对结果没有影响, HE染色是为了辅助免疫组化结果的判定.
生物素是一种含硫水溶性维生素, 广泛分布于动物及植物各组织, 是多种羧化酶辅基的成分, 在人体内主要位于线粒体和细胞质中, 参与多种生理和病理反应. 内源性生物素是指体内所含有的能够和抗生物素蛋白结合的分子或基团, 肠道是其产生的主要部位之一. Rodriguez-Soto et al发现在甲醛固定、石蜡包埋组织中内源性生物素活性被封闭, 而经过微波高温修复后活性重新恢复[1-2]. 本研究证实了这一观点, 14例石蜡包埋结肠组织如果不经高温热修复, 在常规脱蜡水化后直接与外源性的抗生物素蛋白反应, DAB显色, 并未发现有阳性着色. 经过微波高温热修复, 8例出现明显着色, 且有6例表达强度在中等度及以上; 主要部位在黏膜表面上皮细胞的胞质, 尤其近核基底侧. 本研究证实了结肠是内源性生物素高表达的组织之一, 详细报道了内源性生物素在石蜡包埋结肠组织中的表达情况.
早在1981年Wood et al[7]就发现内源性生物素会对免疫组化的结果产生影响, 并且初步找到解决的方法, 随后又陆续有研究报道[8]. 目前有很多厂家提供内源性生物素的封闭液, 然而, 有研究表明在某些情况下, 这些封闭液并不能达到满意的效果[9]. Miller et al推荐了一种简单的封闭液, 即蛋清封闭液[10]. 考虑到蛋清来源容易、价格便宜、操作简单、并且可以自由调整浓度, 我们研究了蛋清封闭液的效果, 结果发现采用合适的浓度在结肠组织中可以取得满意的效果, 浓度过高或过低时效果均不满意. 封闭的效果存在较高的浓度依赖性, 这可能是即用型的封闭液在某些组织中不能取得满意效果的原因之一. 本研究结果提示, 在石蜡包埋结肠组织中, 内源性生物素的活性可以被完全封闭, 影响可以被消除; 考虑到封闭的效果存在较高的浓度依赖性, 蛋清封闭液可成为首选的内源性生物素封闭液.
因为内源性生物素会对免疫组化的结果产生影响. 有学者认为应该在生物素含量丰富的组织放弃以生物素标记的免疫组化检测系统[6]. 本研究重点是在结肠组织中免疫组化时是否应该抛弃生物素标记的检测系统. 根据预实验的结果, 我们选择了在同一部位表达的Bax抗体作为研究所用的一抗, Bax是Bcl-2家族促凋亡亚家族的成员之一, 在正常多种组织有表达, 其中包括正常的结肠组织. 经过封闭后SP系统依然表现出高敏感性, 每一份标本均设立了阴性对照, 对照片未见着色, 同时实验片背景清晰, 未见非特异性着色, 表现出较高的特异性. 由实验结果可以看出, 经过合适的封闭过程, 用生物素标记的系统是可以取得理想结果.
反观两步法系统的检测结果, 按照说明书步骤操作, 阳性表达数很低, 14例标本中仅有4例出现阳性, 且表达均较弱, 没有1例达到中等度以上表达; 与SP系统比较, 背景更为清晰, 表现出非常高的特异性, 但低敏感性过低. 考虑到这一情况, 本研究改进实验条件, 将二抗的作用条件进行改善, 得到了较为理想的结果, 8例出现阳性表达, 但依然低于SP系统. 而且有3例SP系统检测为阳性在该方法中为阴性, 敏感性相对较低. 敏感性和特异性很难同时获取, 这也正是不同检测系统难以取舍的原因. SP为代表的生物素标记的检测系统由于采取三级放大, 敏感性高于两步法的检测系统, 特异性降低, 非特异性的背景染色增加. 本研究成功消除了内源性生物素的影响, 并且获得了理想效果. 根据研究结果, 在结肠组织中进行免疫组化操作时, 生物素标记的检测系统可作为首选方法之一.
感谢吕愈敏教授、李柯主治医师、张颖、尚惠茹在标本收集和处理上给予本课题的帮助.
随着免疫组化技术越来越广泛的运用, 内源性生物素因其对免疫组化结果的影响而受到极大关注. 目前, 国内外文献对结肠组织中内源性生物素的表达及其影响未见报道.
陈建荣, 副教授, 南通大学第二附属医院急诊医学中心
探讨免疫组化中各个影响因素及有效的消除方法, 是免疫组化方法学研究的重点. 本文探讨内源性生物素在结肠组织中对免疫组化结果的影响, 并提出合适的消除方法.
国外学者认为在内源性生物素含量丰富的组织中应该放弃以生物素标记的免疫组化检测系统.
本文首次报道了内源性生物素在石蜡包埋结肠组织中的表达情况, 并且通过实验证实了尽管结肠组织中内源性生物素含量丰富, 但是处理得当依然可以获得理想的结果.
在结肠组织中进行免疫组化操作时, 生物素标记的检测系统依然可列为首选方法之一. 本研究结果对应用免疫组化技术时合理选择不同的检测系统有一定意义.
本文研究有一定的先进性, 但建议进行统计学处理, 意义会更大.
编辑: 程剑侠 电编: 郭海丽
| 1. | Barker FG, Ozua P, Van Noorden S. False positive immunoreaction in products of conception. J Clin Pathol. 1994;47:1118-1119. [PubMed] [DOI] |
| 2. | Rodriguez-Soto J, Warnke RA, Rouse RV. Endogenous avidin-binding activity in paraffin- embedded tissue revealed after microwave treatment. Applied immunohistochemistry. 1997;5:59-62. [DOI] |
| 3. | Srivastava A, Tischler AS, Delellis RA. Endogenous biotin staining as an artifact of antigen retrieval with automated immunostaining. Endocr Pathol. 2004;15:175-178. [PubMed] [DOI] |
| 4. | Parkin RK, Boeckh MJ, Erard V, Huang ML, Myerson D. Specific delineation of BK polyomavirus in kidney tissue with a digoxigenin-labeled DNA probe. Mol Cell Probes. 2005;19:87-92. [PubMed] [DOI] |
| 5. | Skinnider BF, Folpe AL, Hennigar RA, Lim SD, Cohen C, Tamboli P, Young A, de Peralta-Venturina M, Amin MB. Distribution of cytokeratins and vimentin in adult renal neoplasms and normal renal tissue: potential utility of a cytokeratin antibody panel in the differential diagnosis of renal tumors. Am J Surg Pathol. 2005;29:747-754. [PubMed] [DOI] |
| 6. | Hasui K, Murata F. A new simplified catalyzed signal amplification system for minimizing non-specific staining in tissues with supersensitive immunohistochemistry. Arch Histol Cytol. 2005;68:1-17. [PubMed] [DOI] |
| 7. | Wood GS, Warnke R. Suppression of endogenous avidin-binding activity in tissues and its relevance to biotin-avidin detection systems. J Histochem Cytochem. 1981;29:1196-1204. [PubMed] [DOI] |
| 8. | Duhamel RC, Whitehead JS. Prevention of nonspecific binding of avidin. Methods Enzymol. 1990;184:201-207. [PubMed] [DOI] |
| 9. | Cooper K, Haffajee Z, Taylor L. Comparative analysis of biotin intranuclear inclusions of gestational endometrium using the APAAP, ABC and the PAP immunodetection systems. J Clin Pathol. 1997;50:153-156. [PubMed] [DOI] |
| 10. | Miller RT, Kubier P. Blockage of endogenous avidin-binding activity in immunohistochemistry: the use of egg whites. Applied immunohistochemistry. 1997;5:63-65. [DOI] |