修回日期: 2008-01-15
接受日期: 2008-01-22
在线出版日期: 2008-02-18
目的: 探讨大鼠胆道梗阻再通术后肾脏水通道蛋白3(AQP3)的变化及其意义.
方法: 50只大鼠, 任选10只为对照组, 其余为实验组, 实验组先建梗阻性黄疸(obstructive jaundice, OJ)模型, 7 d后解除梗阻; 按取材时间不同随机分为5组: OJ 0 h、OJ 24 h、OJ 72 h、OJ 1 wk和NC. 测定血生化指标, Western blot法检测肾脏AQP3水平.
结果: 随梗阻解除时间延长血清总胆红素(TBIL)和谷丙转氨酶(ALT)逐渐下降(TBIL: 93.26±1.32 vs 63.31±1.85, 30.78±1.40, 5.04±0.24, P<0.05; ALT: 70.95±1.22 vs 69.96±0.82, 30.74±1.52, 11.84±1.12, P<0.05); OJ 0 h与NC相比尿素氮(BUN)、血肌酐(Cr)无明显变化(P>0.05), AQP3表达降低; OJ 24 h BUN、Cr下降, AQP3表达进一步降低. OJ 72 h与OJ 24 h相比BUN、Cr无明显变化, AQP3表达增强, 但仍弱于NC(P<0.05); 到第7天, BUN、Cr和 AQP3均与NC无明显差别.
结论: 大鼠胆道梗阻解除后短期内因肾功能受损加重, AQP3表达下降后随肾功好转表达增强, 其灵敏性和特异度均高于BUN和Cr.
引文著录: 李云飞, 刘金钢. 胆道梗阻再通术后肾脏AQP3的变化及其意义. 世界华人消化杂志 2008; 16(5): 517-521
Revised: January 15, 2008
Accepted: January 22, 2008
Published online: February 18, 2008
AIM: To study the change of renal aquaporin 3 (AQP3) expression in rats after release of obstructive jaundice in biliary tract and its significance.
METHODS: Fifty Wistar rats were divided into control group (n = 10) and experimental group (n = 40). A model of experimental obstructive jaundice was established. Seven days after release of obstructive jaundice, serum biochemical parameters were detected. Rats in the experimental group were randomly divided into five subgroups: OJ 0 h, OJ 24 h, OJ 72 h, OJ 1 wk and non-operated control (NC). Biochemical parameters in venous blood were detected and the expression level of renal AQP3 was determined by Western blot.
RESULTS: The TBIL and ALT gradually decreased after release of obstructive jaundice in biliary tract (TBIL: 93.26 ± 1.32 vs 63.31 ± 1.85, 30.78 ± 1.40, 5.04 ± 0.24, P < 0.05; ALT: 70.95 ± 1.22 vs 69.96 ± 0.82, 30.74 ± 1.52, 11.84 ± 1.12, P < 0.05). There was no significant difference in levels of BUN and Cr between the OJ 0 h and NC subgroups, but the expression level of AQP3 was lower in the OJ 0 h subgroup than in the NC subgroup. Both BUN and Cr were significantly decreased 24 h after operation and the expression of AQP3 was further decreased. The levels of BUN and Cr did not markedly change between the OJ 24 h and OJ 72 h subgroups. The expression level of AQP3 was slightly higher, but still lower in the OJ 24 h subgroup than in the NC subgroup (P < 0.05). The expression levels of BUN, Cr and AQP3 were not significantly different between the two groups 7 days after operation.
CONCLUSION: The renal function is further damaged after release of obstructive jaundice in biliary tract. The expression level of AQP3 becomes higher when renal function improves. The sensitivity and specificity of AQP3 are higher than those of BUN and Cr.
- Citation: Li YF, Liu JG. Change of renal aquaporin 3 expression in rats after release of obstructive jaundice and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 517-521
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/517.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.517
水通道蛋白(aquaporin, AQP)是一组构成水通道并与水通透有关的细胞膜转运蛋白[1]. 迄今, 在人体已发现13种[2-3]. 存在于肾脏的AQPs至少有7种, 即AQP1-7, 其中AQP3主要分布于集合管主细胞基底侧膜, 在介导水通过集合管主细胞基底侧膜转运时起重要作用[4]. AQP3除对水有高度通透性外, 对尿素和甘油也有较高通透性, 属可通透其他分子的AQP[5-6]. 研究表明, 各种原因导致的肾功能衰竭都可使AQP3表达下降, 但关于梗阻性黄疸(obstuctive jaundice, OJ)术后肾脏AQP3的变化尚少有研究. 本实验旨在探讨胆道梗阻解除后肾脏AQP3的变化及其意义.
成年(鼠龄为4 wk)♂Wistar大鼠, 由中国医科大学实验动物中心提供, 共50只、体质量250-300 g, 全部经检疫合格, 实验前饲养7 d无疾病. 任选10只作为对照组(NC), 其余为实验组. 主要实验器材和试剂包括Hitachi7600全自动生化分析仪、德国UP200H组织超声匀浆器、德国Heraus-Biofuge-PrimoR超速低温离心机、日本岛津UV-260紫外分光光度计、美国BIO-RAD-PAC300型垂直电泳槽、美国BIO-RAD MiniPROTEAN Ⅱ cell型转印电泳槽、上海天能公司产GIS-2020型凝胶扫描成像系统; AQP-3一抗: SANTA CRUZ, AQP-3(C-18)SC-9885, 二抗: SANTA CRUZ, SC-2351 BOVINE anti-goat IgG-AP; 电泳用聚丙烯酰胺凝胶、Tris及甘氨酸等均购自上海生物工程公司.
所有大鼠术前12 h禁食, 4 h禁水, 以0.3 mL/100 g体质量的给药量腹腔内注射水合氯醛麻醉. 术区备皮, 安尔碘消毒, 上腹正中切口长约1.5-2 cm入腹. 实验组于肝门区游离胰腺前段胆总管, 7号丝线穿过胆总管下端暂不结扎, 丝线两端分别通过圆针在腹直肌外缘穿过肌层, 后用9号胰腺导管作为衬垫至于结扎处胆总管上打结, 力度适中, 以导管产生轻度形变为宜. 然后逐层关腹. 全程注意无菌操作. 我们这里用7号丝线结扎, 可防丝线过细切断胆总管; 以胰管作衬垫, 可以利用导管的弹性确切的封闭胆总管, 又不至于使胆总管产生缺血坏死, 而且在解除梗阻时原切口入腹, 利用胰管做标记易于快速找到胆总管, 只需剪断胰管表面线结取出胰管便可做到梗阻的再通, 从而大大减轻了二次手术的打击. 另外, 该模型也更符合临床病理生理, 因为梗阻性黄疸患者其胆道梗阻无外乎胆管内肿瘤或结石阻塞以及胆管外的异常压迫, 而并不是完全的胆总管离断或封闭[7]. 麻醉清醒后6 h自由进食标准大鼠饲料, 饮用自来水, 分笼饲养. 每日以青霉素2万单位肌注以预防感染. 假手术对照组仅打开腹腔游离胆总管, 不予结扎.
梗阻性黄疸模型建立后7 d, 动物无一死亡, 部分有轻微切口感染. 两组大鼠分别称质量, 如前法麻醉、解除梗阻. 实验组又按解除梗阻后的取材时间不同随机分为4组, 每组10只: OJ 0 h: 梗阻解除即刻取材组(相当于梗阻未解除时的情况); OJ 24 h: 梗阻解除24 h后取材组; OJ 72 h: 梗阻解除72 h后取材组; OJ 1 wk: 梗阻解除7 d后取材组; 按上述分组打开腹腔, 见实验各组不同程度的腹水. 抽取腔静脉血5-8 mL, 保存于-20 ℃冰箱内待测生化指标; 取左侧肾脏称质量, 置于-80 ℃冰箱内待测AQP3(右侧肾脏另作他用), 肝脏也一并取出称质量.
全自动生化分析仪检测血清总胆红素(TBIL)、谷丙转氨酶(ALT)、尿素氮(BUN)、血肌酐(Cr).
采用半定量免疫印迹(Western blot)检测肾脏AQP3. 取肾脏标本(已作分组标记)用生理盐水冲净后剪碎, 加入10 mL细胞裂解液用组织超声匀浆器进行匀浆, 匀浆液4 ℃ 4000 g离心30 min, 去除完整的细胞、细胞核和线粒体等. 然后取其沉淀(含膜的成分)加入裂解液进行匀浆, 4 ℃ 17500 g离心约1.5 h, 其上清富含胞膜蛋白, 用以进行电泳. 各取富含胞膜蛋白的上清样品50 μL, 在12%的聚丙烯酰胺凝胶上电泳进行免疫印迹并转移到硝酸纤维素(NC)膜上; NC膜在1×TBS中浸泡10 min, 100 g/L脱脂奶粉封闭1 h, 1×TBS-T洗膜两次, 5 min/次; 浸入一抗溶液中4 ℃过夜取出NC膜, 用1×TBS快速洗一次, 后用1×TBS-T洗膜两次, 5 min/次; 转到二抗溶液中浸泡2 h(室温), 1×TBS-T洗膜两次, 5 min/次, 1×TBS洗膜5 min, 染色至条带呈现, 终止染色. 用GIS-2020凝胶图象分析系统扫描分析结果.
统计学处理 数据均以mean±SD表示, 采用SPSS13.0统计软件包处理, 用单因素方差分析(ANOVA), P<0.05有统计学意义.
与NC组相比梗阻第7天(OJ 0 h)和梗阻解除后24 h(OJ 24 h), 体质量和肾脏质量明显减轻, 而肝脏质量则明显增加(P<0.05); 至梗阻解除后72 h(OJ 72 h)到1 wk(OJ 1 wk), 体质量、肾脏质量和肝脏质量均恢复至与NC组无明显差异(P>0.05); TBIL和ALT均随梗阻解除时间的延长而下降, 至术后1 wk(OJ 1 wk)恢复至与NC组无明显差异(P>0.05); 梗阻第7 d时(OJ 0 h), Cr和BUN与对照组相比无明显差异(P>0.05), 在术后24 h(OJ 24 h)两者均显著升高(P<0.05), 虽然术后72 h与24 h相比两者有下降趋势, 但没有明显差异(P>0.05), 至术后1 wk恢复至与NC 组无明显差异(P>0.05, 表1).
| 分组 | BW(g) | LKW(g) | LW(g) | ALT(U/L) | TBIL(μmol/L) | Cr(μmol/L) | BUN(μmol/L) |
| OJ 0 h | 269.2±10.4a | 1.13±0.03a | 13.5±0.4a | 70.95±1.22 | 93.26±1.32 | 24.13±0.30 | 7.60±0.23 |
| OJ 24 h | 265.3±9.8a | 1.13±0.04a | 13.5±0.3a | 69.96±0.82 | 63.31±1.85 | 28.31±0.37a | 9.18±0.27a |
| OJ 72 h | 277.4±7.3 | 1.16±0.02 | 12.3±0.4 | 30.74±1.52 | 30.78±1.40 | 28.17±0.33 | 9.07±0.13 |
| OJ 1 wk | 278.4±9.4 | 1.17±0.02 | 12.4±0.5 | 11.84±1.12 | 5.04±0.24 | 24.09±0.22 | 7.54±0.33 |
| NC | 278.4±6.3 | 1.18±0.02 | 12.3±0.7 | 11.36±0.90 | 5.13±0.34 | 24.00±0.20 | 7.39±0.32 |
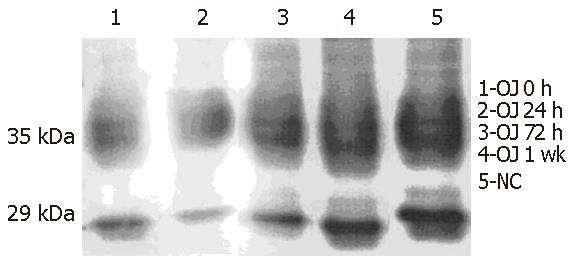
胆道梗阻第7天(OJ 0 h)AQP3表达较NC组弱(P<0.05); 梗阻解除后24 h(OJ 24 h)AQP3表达进一步减弱(P<0.05); 至术后72 h(OJ 72 h)AQP3表达仍弱于NC组(P<0.05), 但与OJ 24 h、OJ 0 h相比已有所升高(P<0.05); 至术后1 wk(OJ 1 wk)AQP3表达与NC组相比已无明显差异(P>0.05), 35 kDa和29 kDa分别为糖基化和未糖基化的AQP3(图1)
OJ是肝胆外科常见疾病. OJ围手术期可发生多种并发症如脓毒血症、胃肠道出血、急性肾功能衰竭(acute renal failure, ARF)等, 其中ARF最为常见. 在接受手术的OJ患者中约8%-9%发生ARF, 死亡率高达68%[8-9].
导致OJ围手术期肾功能受损的因素十分复杂, 已有的研究表明, 缺血再灌注损伤、胆汁酸对肾脏的毒性作用、内毒素血症和一氧化氮(NO)及大量氧自由基等都是肾功能受损的危险因素[10-15]. 本实验结果显示, 胆道梗阻时由于上述各种有害因素的作用使肾功能受损, AQP3合成受到抑制, 表达下降(OJ 0 h); 而解除梗阻后, 由于手术打击、麻醉等作用短期内使血内本已很高的胆红素进一步入血, 再加上其他有害因子使肾脏受损加重, AQP3表达进一步下降(OJ 24 h). 随各种损伤因子的减少, 肾功能逐渐改善, AQP3表达也逐渐增强, 直至恢复正常(OJ 72 h、OJ 1 wk、NC). 当然, 调节AQP3表达的因素众多, 如抗利尿激素(血管加压素)、盐皮质激素、血浆渗透压、糖皮质激素、胰岛素水平等均影响AQP3的表达[16-20]. 胆道梗阻解除后这些因素的变化如何, 尚需进一步研究.
目前, 监测肾功能变化的常用指标是BUN和Cr. 但其只能定性不能定位, 而且肾脏有强大的贮备能力, 出现异常时肾脏疾病往往已进展到晚期. 临床上, 当肾小球滤过率(GFR)降至正常的25%-50%时, 才发生氮质血症, Cr升高, 但患者可仍无临床症状[21]. 肾活检虽能早期发现并判断肾脏受损的程度, 但由于他的有创性, 临床应用受到限制. 因此, 寻找一种灵敏度高、特异性强, 又能从功能和结构两方面反映肾功能变化的指标十分必要. AQPs是肾小管上的功能性整合膜蛋白, 分别定位于肾小管的不同部位. 如本实验所示胆道梗阻第7天(OJ 0 h)时AQP3表达弱于NC组, 显然说明肾脏功能受损; 但此时BUN、Cr却与NC组无明显差异. 另外, 胆道梗阻解除后短期内(OJ 24 h)由于各种损伤因子对肾脏的损害加重, AQP3表达也进一步减弱, 此时BUN、Cr才出现异常升高; 术后3 d(OJ 72 h)BUN、Cr与OJ 24 h相比无明显变化, AQP3表达虽弱于NC组却较前两者(OJ 0 h、OJ 24 h)明显增强. 这表明AQP3反映肾功能受损的灵敏性高于BUN、Cr, 能更好地说明肾功能的变化. AQP3主要分布于集合管主细胞基底侧膜, 其表达的下降和增强至少说明了这部分肾小管功能和结构的变化. 到解除梗阻后第7天(OJ 1 wk)损害肾脏的各种因子逐渐下降, 肾功能好转, AQP3表达恢复, BUN、Cr也降至正常. 这说明通过检测肾脏AQP3可以早期发现胆道梗阻解除后肾功能不全, 并能从结构和功能两方面反映肾功的变化, 其灵敏度和特异性均好于BUN、Cr. 最近, 有研究表明, OJ大鼠肾脏AQP2的表达是进行性下降的[22]. 一个关于急性肾盂肾炎患儿尿液中AQP变化的研究发现, 急性肾盂肾炎早期尿液AQP2的排泌显著高于NC组及治疗后的患儿, 而AQP3则没有显著变化; 该研究认为这可能是由于肾小管上皮细胞受损导致脱落入小管腔的顶质膜碎片增多所致[23]. 据此我们推测, 由于AQP2是肾小管上的功能性整合膜蛋白, 各种损伤因子使得肾小管上皮细胞坏死脱落, AQP2也存在其中随终尿排出, 其多少与肾小管损伤程度成正比. 国内许顶立et al[24]研究认为可以通过检测尿液AQP2的量来预测充血性心力衰竭的程度, 检测方法简单易行. 我们是测量肾脏原位的AQP3, 那么胆道梗阻再通术后尿液AQP3的变化如何; 由于本研究所显示的AQP3对肾功能预测的灵敏性和其固有的特异性, 如果可以通过检测尿液AQP3的变化来估计肾功能受损的程度, 则更有利于临床推广应用. 这些都需要进一步深入研究.
大鼠胆道梗阻解除后短期内AQP3表达下降; 随梗阻解除时间延长, AQP3表达增强. AQP3变化反映了肾功能的变化, 且其早于BUN和Cr两者变化的出现, 反映肾功能变化的灵敏性和特异度高于BUN、Cr.
感谢中国医科大学盛京医院麻醉科王勇讲师在实验过程中给予的无私帮助和指导!
梗阻性黄疸围手术期可发生多种并发症, 其中以肾功能衰竭最为常见. 肾脏AQP是一类功能性整合膜蛋白. 研究表明, 肾功能受损时都伴有AQP的变化. 但梗阻性黄疸术后肾脏AQP的变化及其意义尚少有研究.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科
自AQP发现以来, 肾脏AQP在各种条件下的变化一直是人们研究的热点. 但梗阻性黄疸围手术期肾脏AQP的变化尚较少研究. 本实验就胆道梗阻解除后肾脏AQP3的变化及其意义进行了探索, 以期有所发现.
新近研究发现梗阻性黄疸时肾脏AQP2表达下调, 并发现多巴胺对其表达有调节作用.
检测AQP3有助于早期发现肾功能受损, 从而指导临床更加及时地进行预防和治疗.
本文研究内容较重要, 思路较新颖, 实验设计合理, 具有一定的创新性和科学意义.
编辑: 程剑侠 电编: 郭海丽
| 1. | Kruse E, Uehlein N, Kaldenhoff R. The aquaporins. Genome Biol. 2006;7:206. [PubMed] [DOI] |
| 2. | Petrović MM, Vales K, Stojan G, Basta-Jovanović G, Mitrović DM. Regulation of selectivity and translocation of aquaporins: an update. Folia Biol (Praha). 2006;52:173-180. [PubMed] |
| 3. | Morishita Y, Sakube Y, Sasaki S, Ishibashi K. Molecular mechanisms and drug development in aquaporin water channel diseases: aquaporin superfamily (superaquaporins): expansion of aquaporins restricted to multicellular organisms. J Pharmacol Sci. 2004;96:276-279. [PubMed] [DOI] |
| 4. | Nejsum LN. The renal plumbing system: aquaporin water channels. Cell Mol Life Sci. 2005;62:1692-1706. [PubMed] [DOI] |
| 5. | Nielsen S, Frøkiaer J, Marples D, Kwon TH, Agre P, Knepper MA. Aquaporins in the kidney: from molecules to medicine. Physiol Rev. 2002;82:205-244. [PubMed] [DOI] |
| 6. | Ishibashi K, Sasaki S, Fushimi K, Uchida S, Kuwahara M, Saito H, Furukawa T, Nakajima K, Yamaguchi Y, Gojobori T. Molecular cloning and expression of a member of the aquaporin family with permeability to glycerol and urea in addition to water expressed at the basolateral membrane of kidney collecting duct cells. Proc Natl Acad Sci USA. 1994;91:6269-6273. [PubMed] [DOI] |
| 8. | Green J, Better OS. Systemic hypotension and renal failure in obstructive jaundice-mechanistic and therapeutic aspects. J Am Soc Nephrol. 1995;5:1853-1871. [PubMed] |
| 9. | Fogarty BJ, Parks RW, Rowlands BJ, Diamond T. Renal dysfunction in obstructive jaundice. Br J Surg. 1995;82:877-884. [PubMed] [DOI] |
| 10. | Tajiri K, Miyakawa H, Liu J, Kamiyama T, Marumo F, Sato C. Enhanced renal susceptibility to ischemia-reperfusion injury in the rat with obstructive jaundice. Hepatogastroenterology. 1997;44:789-795. [PubMed] |
| 11. | Yüksek YN, Kologlu M, Daglar G, Doganay M, Dolapci I, Bilgihan A, Dolapçi M, Kama NA. Intestinal ischemia-reperfusion injury augments intestinal mucosal injury and bacterial translocation in jaundiced rats. Hepatogastroenterology. 2004;51:171-175. [PubMed] |
| 12. | Rodrigo R, Avalos N, Orellana M, Bosco C, Thielemann L. Renal effects of experimental obstructive jaundice: morphological and functional assessment. Arch Med Res. 1999;30:275-285. [PubMed] [DOI] |
| 13. | Kaler B, Karram T, Morgan WA, Bach PH, Yousef IM, Bomzon A. Are bile acids involved in the renal dysfunction of obstructive jaundice? An experimental study in bile duct ligated rats. Ren Fail. 2004;26:507-516. [PubMed] [DOI] |
| 14. | Kucuk C, Sozuer E, Ikizceli I, Avsarogullari L, Keceli M, Akgun H, Muhtaroglu S. Role of oxygen free radical scavengers in acute renal failure complicating obstructive jaundice. Eur Surg Res. 2003;35:143-147. [PubMed] [DOI] |
| 15. | Inan M, Sayek I, Tel BC, Sahin-Erdemli I. Role of endotoxin and nitric oxide in the pathogenesis of renal failure in obstructive jaundice. Br J Surg. 1997;84:943-947. [PubMed] [DOI] |
| 16. | Terris J, Ecelbarger CA, Nielsen S, Knepper MA. Long-term regulation of four renal aquaporins in rats. Am J Physiol. 1996;271:F414-F422. [PubMed] |
| 17. | Kwon TH, Nielsen J, Masilamani S, Hager H, Knepper MA, Frokiaer J, Nielsen S. Regulation of collecting duct AQP3 expression: response to mineralocorticoid. Am J Physiol Renal Physiol. 2002;283:F1403-F1421. [PubMed] [DOI] |
| 18. | Matsuzaki T, Suzuki T, Takata K. Hypertonicity-induced expression of aquaporin 3 in MDCK cells. Am J Physiol Cell Physiol. 2001;281:C55-C63. [PubMed] |
| 19. | Cutler CP, Phillips C, Hazon N, Cramb G. Cortisol regulates eel (Anguilla anguilla) aquaporin 3 (AQP3) mRNA expression levels in gill. Gen Comp Endocrinol. 2007;152:310-313. [PubMed] [DOI] |
| 20. | Higuchi S, Kubota M, Iguchi K, Usui S, Kiho T, Hirano K. Transcriptional regulation of aquaporin 3 by insulin. J Cell Biochem. 2007;102:1051-1058. [PubMed] [DOI] |
| 22. | Wang Y, Liu JG, Han JL. Downregulation of AQP2 and AQP2 mRNA expression in kidney medulla of rats with bile duct ligation. Hepatobiliary Pancreat Dis Int. 2007;6:636-640. [PubMed] |
| 23. | Rodionova EA, Kuznetsova AA, Shakhmatova EI, Prutskova N, Nielsen S, Holtbäck U, Natochin Y, Zelenina M. Urinary aquaporin-2 in children with acute pyelonephritis. Pediatr Nephrol. 2006;21:361-367. [PubMed] [DOI] |